抗疫第一线 | 新格元单细胞产品助力新冠队列研究
发布时间:2021-08-24 14:26:12
6月16日,由陆军军医大学卞修武院士带领,陆军军医大学平轶芳及北京协和医院张抒扬联合通讯, 国内多家医院和科研院所合作在武汉疫情期间进行的全面的大规模病理队列研究近日在国际前沿期刊《Cell Research》上发表。来自中国科学技术大学附属第一医院,北京协和医院,东部战区总医院,南京大学金陵医院,武汉金银潭医院,南方医科大学第一临床医学院,瑞金医院,上海交通大学,中央战区总医院,浙江大学,中国急诊科重症医学研究所,南方医科大学南方医院,南京大学危重病急救与危重症研究重点实验室的专家团队参与此项重要研究。新格元单细胞测序产品被用于此项工作中的尸检组织单细胞测序。文章题为:A cohort autopsy study defines COVID-19 systemic pathogenesis(IF=20.507)。
本文成功绘制了新冠感染尸检2h后的肺部组织图谱,并发现新冠病毒可以通过CD147,transferrin receptor-1和neuropilin-1感染单核和巨噬细胞,这可能是新冠病毒挟持免疫细胞进行全身性传播的途径。

研 究 背 景
当前,引起全球大流行的新冠病毒SARS-CoV-2是一种新型β型冠状病毒。自发现疫情以来全球积极应对,2020年2月4日,武汉火神山医院开始正式接诊新型冠状病毒感染的肺炎确诊患者,中国速度举世震惊!
在全社会共同抗疫的背景下,新格元积极响应,3月20日,新格元自主设计,开发并生产的单细胞测序试剂送到了武汉火神山医院以促进新型冠状病毒的研究,响应科技抗疫。火神山医院检验科夏欣一主任亲自接收,并对产品给予高度评价和肯定。科技抗“疫”—新格元单细胞试剂盒驰援火神山!
研 究 方 法
与其他冠状病毒,中东呼吸综合征(MERS)和严重急性呼吸综合征(SARS)相比,SARS-CoV-2表现出低致死率和高传播性的特征。研究表明SARS-CoV-2不仅能够引起呼吸系统表征,也会引起肺部以外系统的病症,但是这种全身性的发病机制还尚不清楚,究竟是由局部病毒入侵导致免疫系统适应不良引起,还是由治疗所介导引起?本研究通过以下方法系统探究了新冠病毒全身性感染的机制。
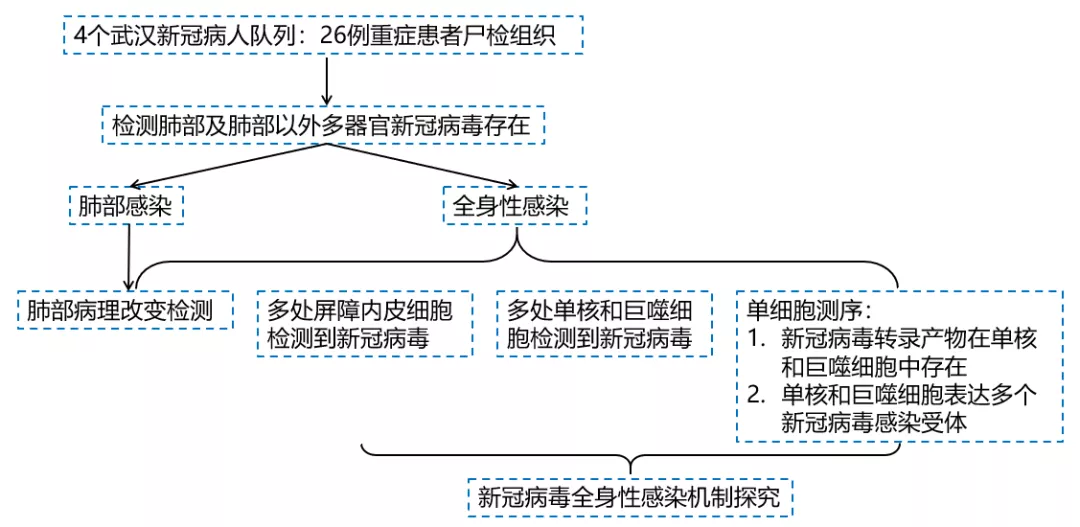
研 究 结 果
新冠病毒感染的器官倾向性
在本研究中,使用的研究队列为武汉新冠病人队列的26例尸检病例,平均年龄为67.5岁,均为感染新冠的重症病患。患者从新冠发病到死亡的中位时间为38.5天,引起死亡的主要原因包括严重肺损伤(新冠相关呼吸衰竭和/或伴随肺部真菌感染),肺血栓栓塞,夹层动脉瘤破裂和心血管疾病(Fig 1a)。
为了更加全面的解析新冠感染的器官倾向性,以及这种多器官病症与疾病进展的关系,通过检测SARS CoV-2病毒RNA,刺突蛋白(S蛋白)或者类病毒粒子,发现SARS-CoV-2病毒RNA在26例死亡患者的多种器官中存在,包括呼吸道,消化道,泌尿生殖,心血管,免疫系统,内/外分泌腺和皮肤(Fig 1b,c)。根据病毒分布,可以将新冠分为三种病理亚型,为肺部感染,全身感染和其他(Fig 1b-d)。并且新冠病毒阳性的器官数量与肺部检测到的病毒RNA的量呈现正相关(Fig 1e),这个结果说明肺部感染较多的病毒或者病毒清除能力不足可能导致病毒的全身性感染。在新冠重症患者中,SARS-CoV-2较SARS-CoV具有更加广谱的器官感染能力(Fig 1f)。
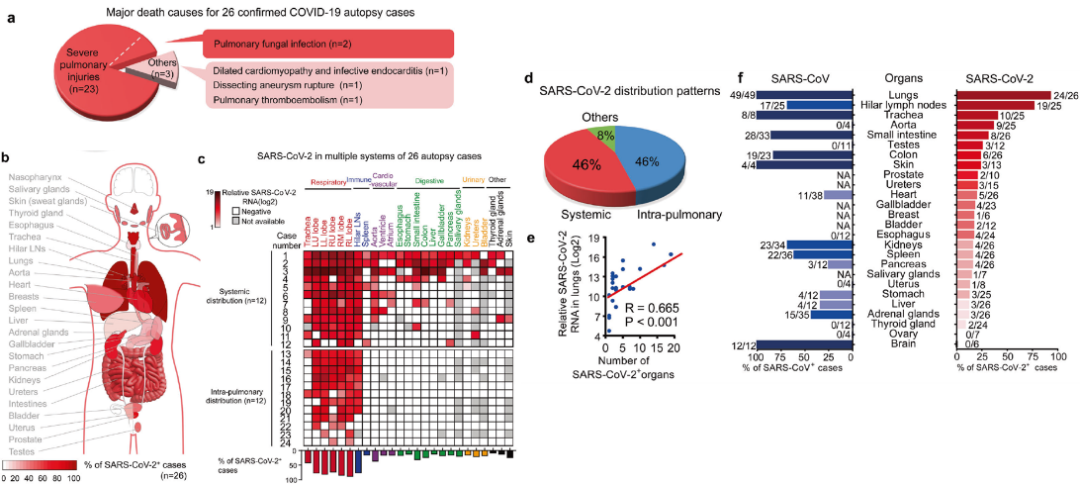
Fig 1 新冠病毒可感染肺部及肺部以外多个器官
新冠病毒引起普遍的肺部病理改变
在本研究的队列中,肺部病理表现为弥漫性肺泡损伤(diffuse alveolar damage,DAD)的三个阶段:渗出,增生和纤维化(Fig 2a)。针对其中15例连续尸检病例,作者通过H&E和免疫组化染色对患者肺部的病理学进行了统计分析(Fig 2b-d)。作者发现DAD纤维化早在病症出现第15天就开始出现,并且随着疾病进展而增加,表明DAD纤维化是早期和重症新冠感染的并发症(Fig 2d)。在发病后15-36内,病毒保持较高丰度,但是随着后续疾病进展,逐渐下降(Fig 2e)。在呼吸衰竭的患者尸检中,作者还观察到了其他肺部病理改变,包括肺泡浆液性和蛋白渗出,透明膜形成和肺泡/间质纤维化,这些都可能是构成空气扩散受阻的组织病理学基础(Fig 2f)。另外,在10例有确证呼吸衰竭记录,使用过呼吸机和检测过动脉氧分压的病患中,肺泡或者支气管出现了粘液栓塞(Fig 2g),并且这种粘液栓塞的数量与动脉氧分压的值呈现负相关(Fig 2h),说明低氧血症伴随着粘液分泌的增加,可能限制了呼吸机的治疗效果。

Fig 2 新冠感染引起肺部病理改变
内皮细胞为新冠病毒易感细胞类型
通过免疫荧光实验,作者发现在新冠患者的肺切片中,处于血气屏障或者肺血管中的内皮细胞,存在SARS-CoV-2的刺突蛋白(Fig 3a),这可能是SARS-CoV-2通过血气屏障进入肺部以及在全身各器官进行传播的途径。利用免疫组化实验,在具有滤过屏障功能的肾小球和肾近曲小管上皮中也检测到了刺突蛋白的表达(Fig 3b)。同时在血液-睾丸屏障中的内皮细胞,生精小管中的生精细胞和基质细胞,以及睾丸检测为新冠阳性患者的精子都检测到了刺突蛋白的表达(Fig 3c)。结合这些结果证明了SARS-CoV-2存在于多处生理屏障的内皮细胞中,包括血气屏障,过滤屏障和血液-睾丸屏障。说明内皮细胞可能是新冠病毒的易感细胞类型,进而导致了全身性的病毒传播。
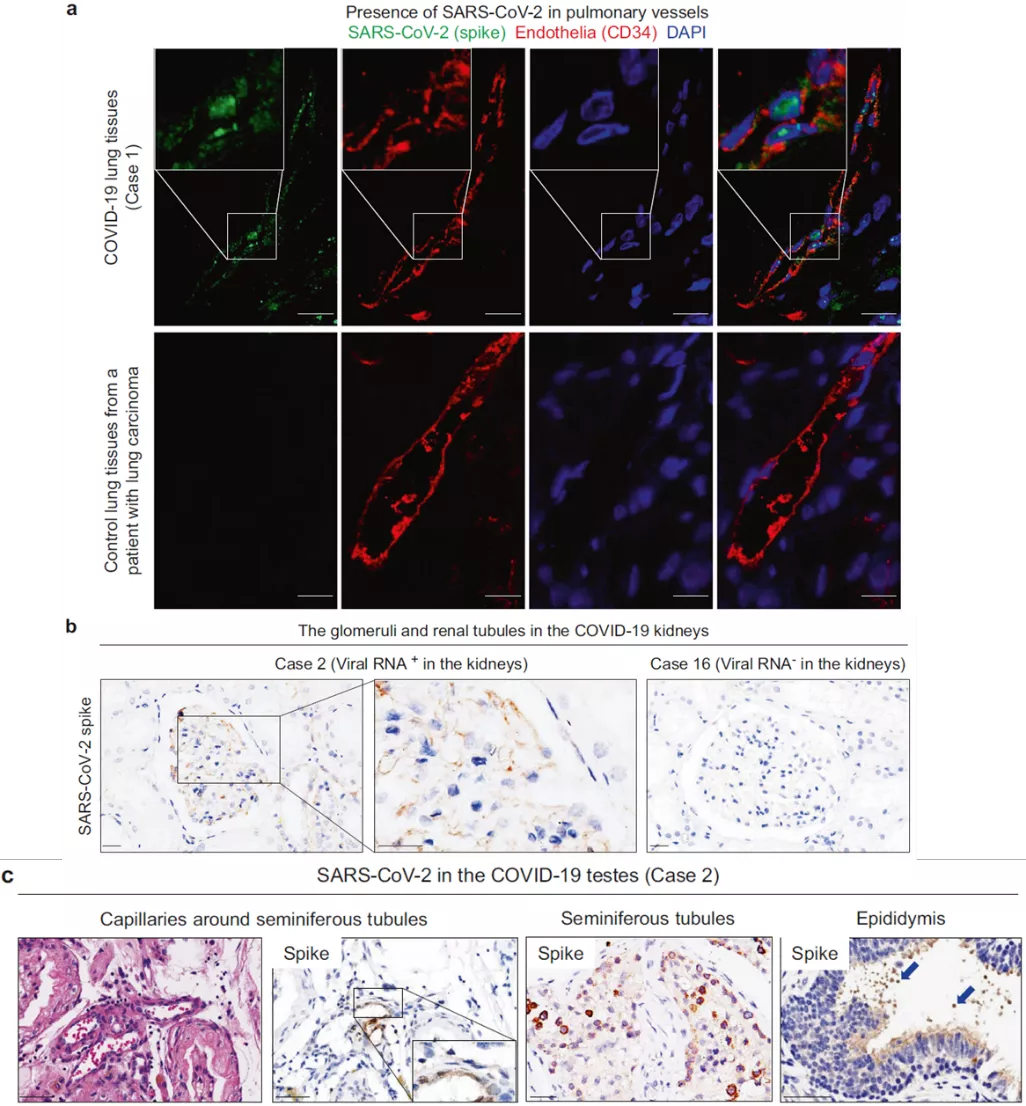
Fig 3 新冠病毒感染生理屏障处的内皮细胞
单细胞测序发现新冠病毒能够感染单核细胞和巨噬细胞
为了进一步研究新冠病毒的传播途径,作者检测了单核细胞和巨噬细胞中是否感染新冠病毒。首先通过免疫组化实验,作者发现肺泡浸润的免疫细胞主要是CD68阳性的巨噬细胞,并且表现为SARS-CoV-2的刺突蛋白阳性(Fig 4a)。连续切片的免疫组化进一步验证了,SARS-CoV-2的刺突蛋白也存在于淋巴结和脾脏的单核和巨噬细胞中(Fig 4b-c),并且存在于尸检的肺,肾脏,淋巴结,脾脏和肠道组织的外周血单个核细胞中(Fig 4d)。随后作者利用单细胞测序技术,绘制了一例新冠患者(case 17)死后2h的肺组织图谱。通过经典marker鉴定共得到11种细胞类型,其中包括两种CD14阳性的单核细胞亚型(CD14+ Mono-1,-2),两种单核来源肺泡巨噬细胞亚型(MoAM-1,-2)以及其他的细胞类型(Fig 4e)。其中CD14+ Monocyte表达VCAN,而MoAMs同时表达C1QA和C1QC(Fig 4h)。接着作者在CD14+ Monocyte中,检测到了新冠病毒相关转录产物的表达,包括开放阅读框10(ORF10)和衣壳蛋白(Fig 4f)。为了探究新冠病毒感染单核和巨噬细胞的机制,作者检测了CD14+Mono-1,-2和MoAM-1,-2细胞中新冠病毒感染细胞的受体,包括BSG(表达CD147蛋白),TFRC(表达transferrin receptor-1)和NRP1(表达neuropilin-1)的表达情况。结果显示新冠病毒可能是通过CD147,transferrin receptor-1和neuropilin-1,而不是ACE2来感染单核和巨噬细胞的。综上,新冠病毒可能会挟持单核细胞和巨噬细胞进行全身性的传播。
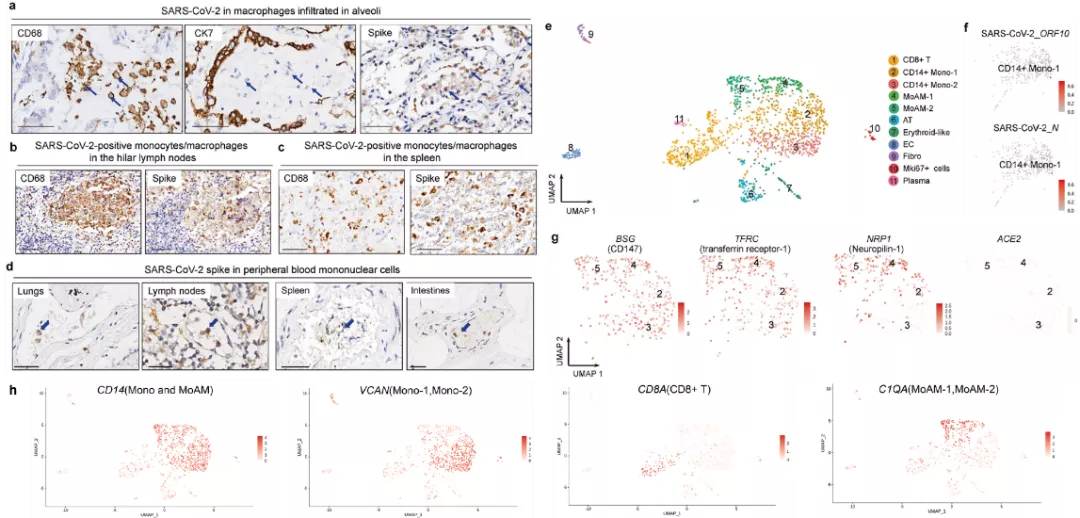
Fig 4 单细胞测序显示新冠病毒感染单核和巨噬细胞
研 究 结 论
越来越多的证据表明新冠病毒存在于肺部以外的多器官中,并且重症患者常伴随肺部以外的器官病变。然而病毒如何在全身多器官进行传播,这种传播与疾病发生发展的相关性仍然是个谜。作者通过来自武汉新冠病人队列,检测新冠病毒在26例尸检新冠感染重症患者多器官中的分布,证实新冠病毒存在于肺部及肺部以外多个器官,建立靶器官病毒感染的直接证据。生理屏障处的内皮细胞是新冠病毒的易感细胞类型,增加了病毒通过侵染屏障系统进行全身性传播的可能性。被感染的内皮还可能造成血管功能障碍,可能诱发血栓形成,这些与在因新冠感染而死亡的患者中观察到的缺血性或出血性改变一致。另外通过免疫组化以及单细胞测序技术,发现新冠病毒可以通过除了ACE2,其他的受体,包括CD147,transferrin receptor-1和neuropilin-1,来感染进而挟持单核和巨噬细胞,进行全身性的传播。这些研究结果,进一步描述了新冠病毒感染的器官倾向性和致病性,为深入了解病毒感染的机制提供了基础,减少病毒全身性传播提供了新的治疗方向。








