1.皮肤鳞状细胞癌单细胞图谱
本文共分析了原发和复发cSCC病人(其中1例原发cSCC为鲍恩病)的6例肿瘤组织及3例癌旁组织单细胞数据,共计14626个细胞。通过聚类分群及细胞注释,共得到了7种主要细胞类型,包括上皮细胞、成纤维细胞、髓系免疫细胞、T细胞、内皮细胞、肥大细胞和B细胞。这些主要细胞类型皆存在着样本异质性。原发cSCC的细胞类型较为均衡,而与原发cSCC相比,复发cSCC组织含有更高比例的成纤维细胞和B细胞。综合而言,上皮细胞、成纤维细胞和髓系免疫细胞是cSCC肿瘤微环境的主要组成细胞。
图1 皮肤鳞状细胞癌单细胞图谱
2.复发cSCC肿瘤特异角质细胞的间充质转化特性
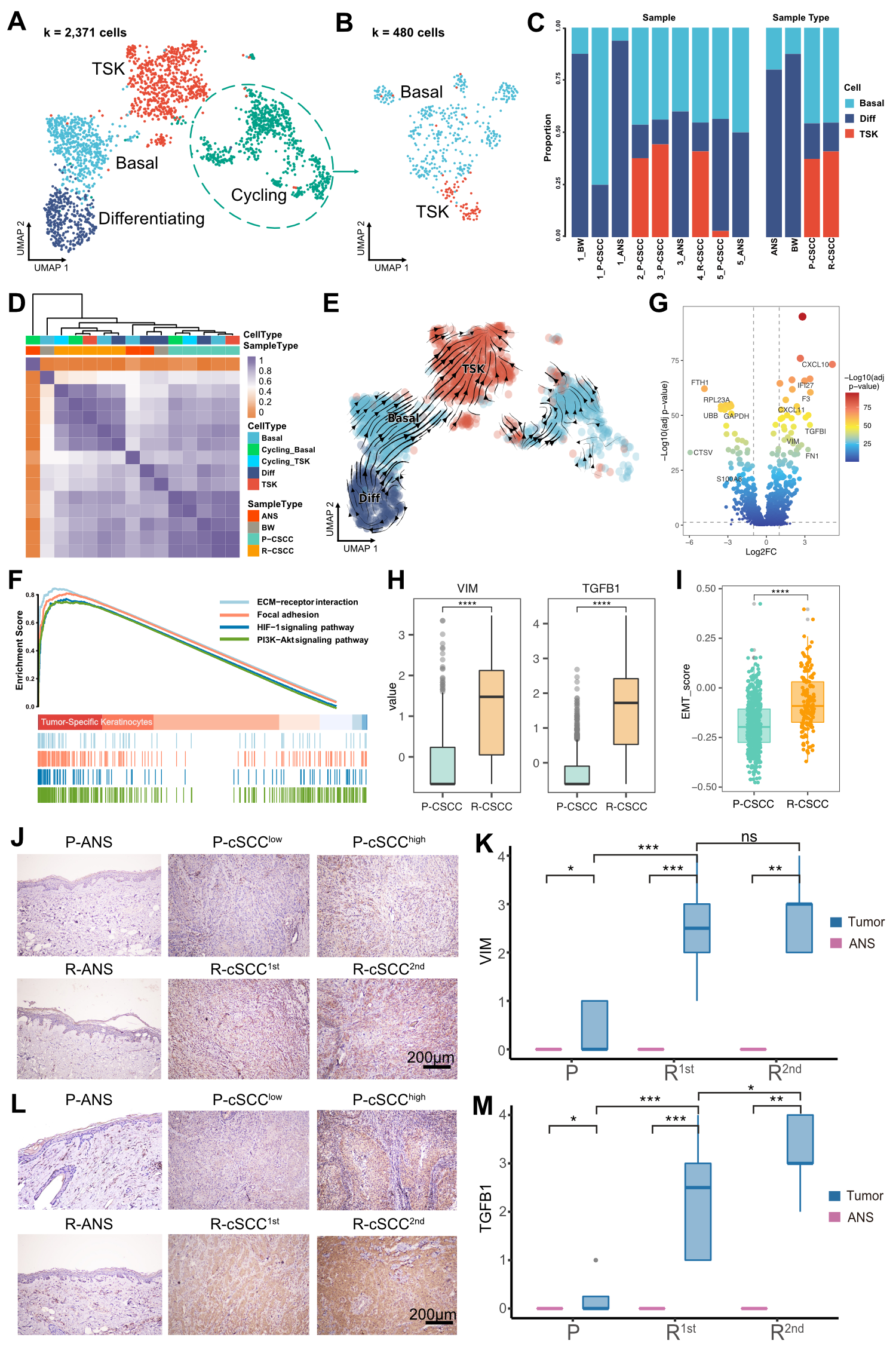
为了解析cSCC中上皮细胞的异质性,作者对上皮细胞进行了亚群细分,共得到了4个上皮细胞亚群,分别是:基底细胞、增殖上皮细胞、分化上皮细胞和肿瘤特异角质细胞(TSKs)。其中,增殖上皮细胞主要包含基底细胞和TSKs。癌旁组织和鲍恩病肿瘤组织含有较高比例的分化上皮细胞,而原发和复发cSCCs肿瘤组织则含有高比例的TSKs。通过RNA速率分析,观察到分化上皮细胞和基底细胞倾向于分化到TSKs。通过富集分析发现,TSKs上调了PI3K-Akt通路、ECM受体相互作用、焦点粘连和HIF-1信号通路相关功能,说明其与肿瘤进展或肿瘤治疗抵抗有关。通过对原发和复发的TSKs进行组间差异分析,发现复发TSKs上调了上皮间充质转化(EMT)相关基因VIM和TGFB1,且EMT基因集合得分在复发样本的TSKs中显著升高。本文作者进而对VIM和TGFB1进行了免疫组化实验的验证,证实了复发cSCC与EMT相关。
图2 复发cSCC肿瘤特异角质细胞的间充质转化特性
3.复发cSCC呈现T细胞荒漠特征
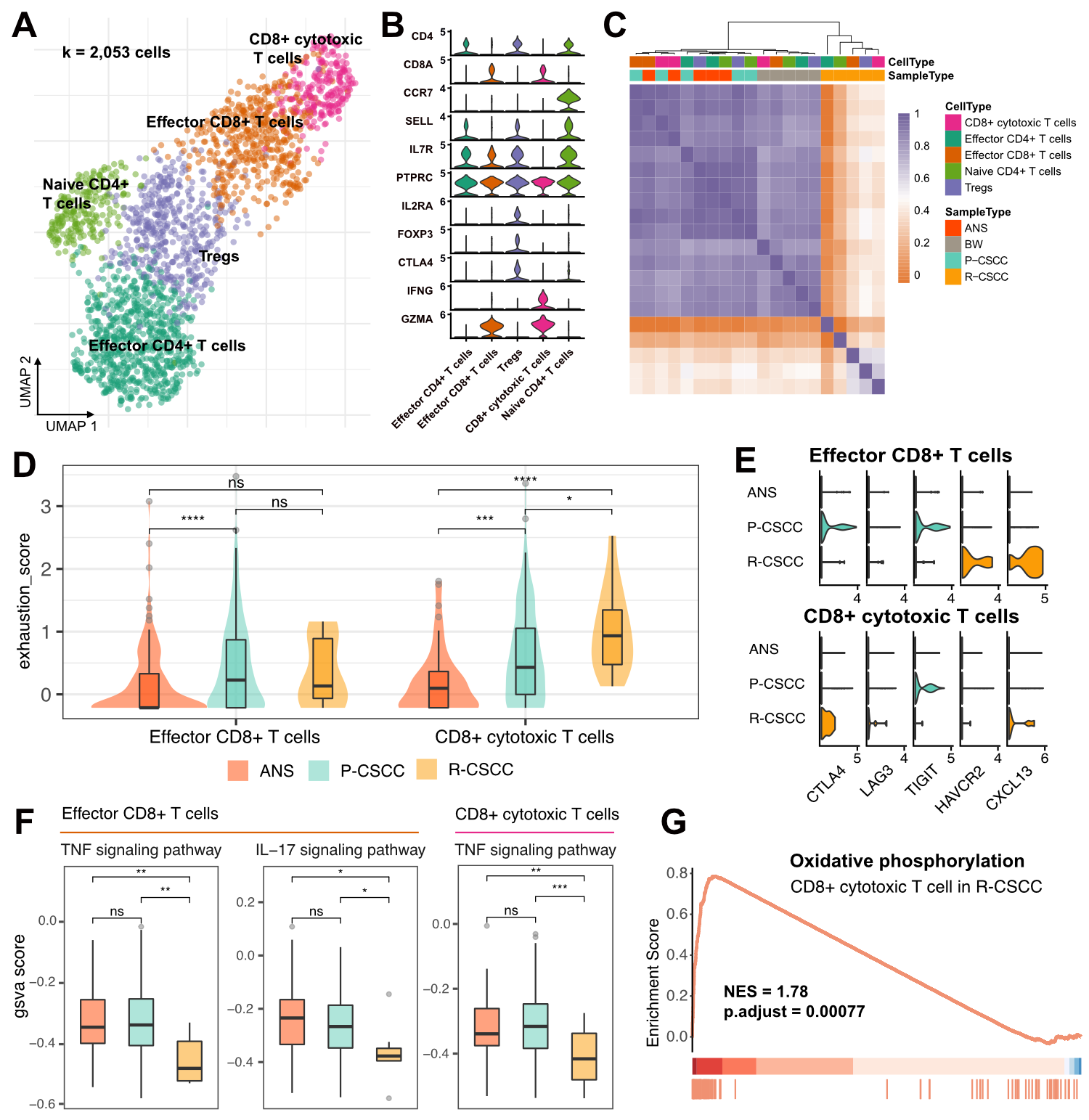
对T细胞亚群细分共得到5个亚群,分别是:CD4+效应T细胞、调节性T细胞(Tregs)、初始CD4+T细胞、CD8+效应T细胞和CD8+细胞毒性T细胞。CD4+和CD8+T细胞在原发cSCC中含量丰富,而在复发cSCC中则呈现了低T细胞浸润的情况,说明复发cSCC是一种T细胞缺失的肿瘤。通过细胞类型相关性计算发现,来自癌旁和原发cSCC的T细胞更为相似,而复发cSCC的T细胞则独立聚类,呈现了与其他样本组织差异较大的表达特性。
紧接着,作者对比了癌旁、原发cSCC和复发cSCC的CD8+效应T细胞和CD8+细胞毒性T细胞的耗竭评分。与癌旁和原发cSCC相比,复发cSCC组的CD8+细胞毒性T细胞显著上调了耗竭功能。作者又查看了免疫检查点抑制因子相关基因的组间差异表达情况,发现原发cSCC组的CD8+效应T细胞高表达了CTLA4和TIGIT,CD8+细胞毒性T细胞也上调了TIGIT。而在复发cSCC组中,CD8+效应T细胞则高表达了HAVCR2(TIM3)和CXCL13,CD8+细胞毒性T细胞高表达了CTLA4和CXCL13,并上调了LAG3表达。以上结果表明了原发和复发cSCC的T细胞耗竭是不同免疫抑制因子导致的。
在此基础上,作者还对炎症相关功能进行了探究。通过对炎症相关通路进行GSVA富集分析,发现CD8+效应T细胞在原发cSCC和癌旁组织中有相似的炎症水平,而在复发cSCC中则下调了TNF和IL-17信号通路水平,且IL-17信号通路水平也在复发组cSCC的CD8+细胞毒性T细胞中显著下调。此外,GSEA富集分析发现,与原发cSCC相比,复发cSCC的CD8+细胞毒性T细胞显著上调了氧化磷酸化功能,说明这些细胞处在高代谢状态。
综合而言,作者揭示了复发cSCC中的T细胞浸润水平低,且T细胞处于低炎症状态,这有可能是cSCC复发的重要原因。
图3 cSCC肿瘤微环境中T细胞的组成和转录组特征
4.SPP1+CD209high/low肿瘤相关巨噬细胞的促肿瘤特性
髓系免疫细胞是cSCC肿瘤微环境中最为丰富的细胞类型,且已有报道称其参与了肿瘤进展和转移,因此作者对髓系免疫细胞进行了亚群细分。髓系细胞亚群细分共得到了10个亚群,其中4个群为肿瘤相关巨噬细胞(TAMs),分别是:SPP1+CD209highTAMs、SPP1+ CD209lowTAMs、CXCL10+TAMs和增殖TAMs。除此之外,还注释到了单核细胞(Monocytes)、树突细胞(DCs)和髓源抑制免疫细胞(MDSCs)等细胞亚群。RNA速率分析发现TAMs和DCs有分化向单核细胞的倾向,而MDSCs则位于分化轨迹末端,CytoTRACE分化潜能分析进一步确认了RNA速率分析的结果。有文献报道巨噬向单核分化方向与cAMP信号相关,而在数据中也看到了cAMP信号通路水平与分化拟时序显著负相关。
近来有研究表明,SPP1+TAMs亚群存在血管生成相关特性,并与肿瘤转移相关。在本文数据中,存在两群在复发cSCC中占比较高的SPP1+TAMs,分别是SPP1+CD209highTAMs和SPP1+CD209lowTAMs。因此作者进一步分析了这两群细胞的吞噬功能和血管生成功能,并发现SPP1+CD209highTAMs亚群拥有更高的吞噬功能得分,而SPP1+CD209lowTAMs亚群则拥有最高的血管生成功能得分。另外,CD1a+CD1c+DCs是吞噬功能水平最高的髓系免疫细胞亚群。通过组间对比发现,SPP1+CD209highTAMs和CD1a+CD1c+DCs的吞噬功能水平都在复发cSCC组显著下调。且SPP1+CD209highTAMs的血管生成功能水平在原发和复发cSCCs组中皆显著上调。此外,作者也对炎症相关通路进行了分析,发现TAMs和单核细胞拥有较高的炎症水平,且SPP1+TAMs和单核细胞亚群的炎症水平存在组间差异。综上,复发cSCC组SPP1+TAMs的吞噬功能和炎症水平下降,但上调了血管生成水平,这有可能是导致cSCC复发的机制。

图4 cSCC肿瘤微环境中髓系免疫细胞的组成和转录组特征
5.复发cSCC中IL7R+癌症相关成纤维细胞与肿瘤特异角质细胞的细胞互作
成纤维细胞是肿瘤微环境中另一重要细胞类型,通过亚群细分共得到了3个癌症相关成纤维(CAFs)亚群,分别是:mCAFs、iCAFs和IL7R+CAFs。值得注意的是,复发cSCC中含有更多的IL7R+CAFs,而原发cSCC则含有更高比例的mCAFs。RNA速率分析发现iCAFs可以分化成mCAFs进而分化成IL7R+CAFs,这与原发和复发的CAFs亚群细胞比例变化趋势一致,从而可以认为CAFs细胞亚群的分化与cSCC复发相关。同样,在IL7R+CAFs亚群中也看到了炎症水平的变化。与癌旁组织相比,原发cSCC中的细胞炎症水平稍有升高,而复发cSCC中的细胞验证水平则显著下调,揭示了cSCC复发存在IL7R+CAFs低炎症水平的特征。
为了进一步了解IL7R+CAFs的生物学功能,作者进行了细胞互作分析,结果显示IL7R+CAFs高表达了与EMT相关的配体,而分析与这些配体基因相关的受配体对,发现TSKs与IL7R+CAFs的互作水平最强。因此,在复发cSCC中,IL7R+CAFs可以通过与TSKs的细胞互作促进TSKs的EMT功能。
图5 cSCC中癌症相关成纤维细胞转录组变化与细胞互作
6.细胞互作分析揭示MDK通路在复发cSCC中的作用
上述分析结果均揭示了原发和复发cSCC中免疫微环境细胞比例和细胞功能上的差异,作者认为原发和复发cSCC存在细胞间互作差异,于是作者进一步对原发和复发cSCC分别进行了细胞互作分析。结果显示,在原发cSCC中,iCAFs和IL7R+CAFs与其他细胞类型有更多的互相作用;而在复发cSCC中,TSKs、iCAFs、mCAFs和IL7R+CAFs与其他细胞类型的相互作用更多,TSKs在复发cSCC免疫微环境中发挥了更重要的作用。对比原发和复发cSCC与TSKs相关的细胞互作,发现复发cSCC组上调了MDK通路。MDK被报道在多种癌症中与细胞分化、生长、迁徙、血管生成及生存时间相关。在原发cSCC中,iCAFs和IL7R+CAFs可以分泌高水平的MDK以影响细胞间互相作用;而在复发cSCC中,则是TSKs分泌高水平的MDK,而其受体表达在TSKs和其他细胞类型中,从而调节了TSKs与其他细胞类型的强细胞互作。对MDK和成纤维细胞marker基因VIM的实验证实了其作用:与原发cSCC相比,第一次和第二次复发cSCC样本中有更高的MDK表达。并且,MDK表达与VIM和TGFB1正相关,证明它可能可以调控cSCC的EMT功能。
图6 原发和复发cSCC细胞互作差异