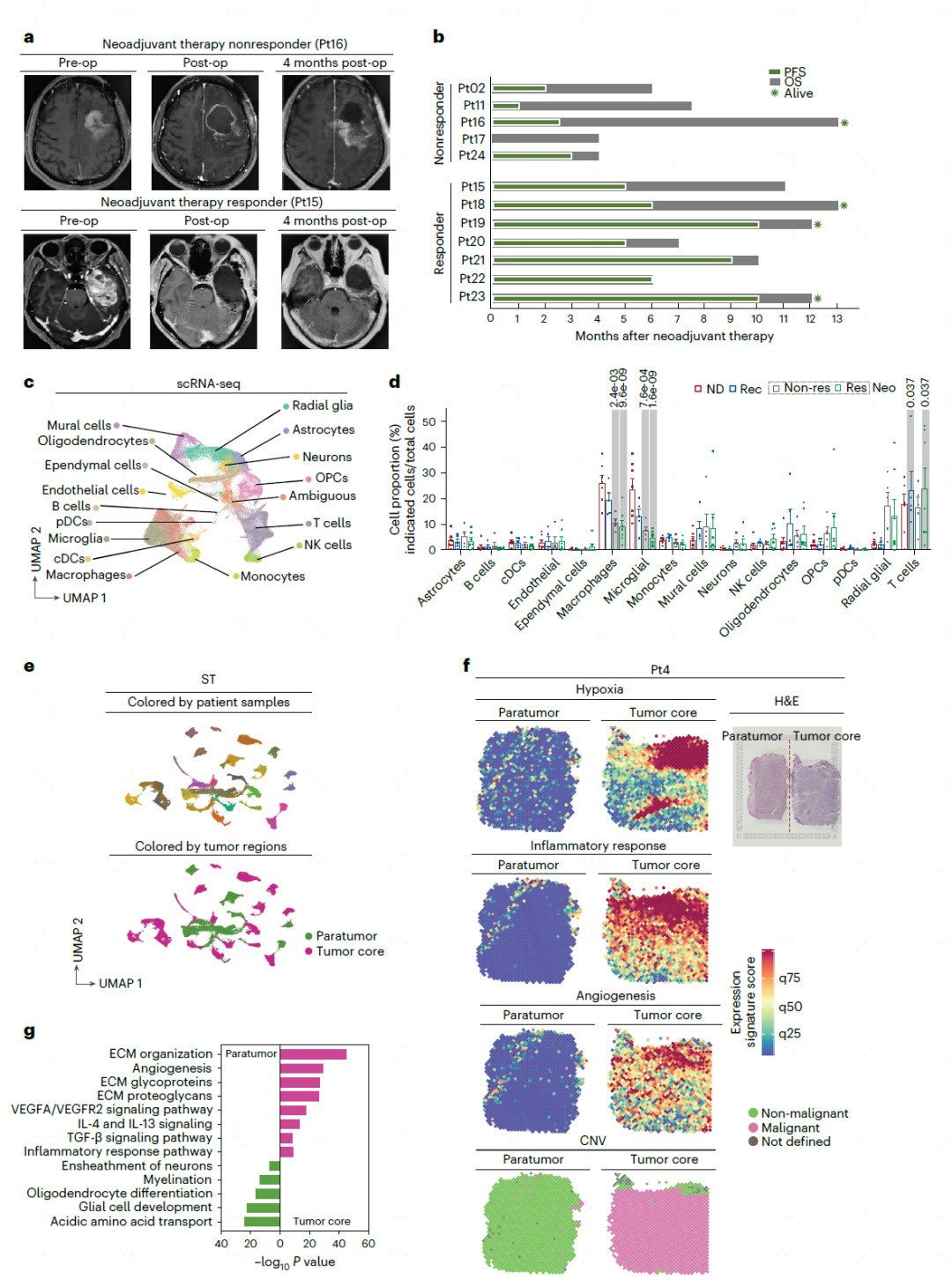
作者首先发现,与Non-res相比,Res表现出更好的无进展生存期和总生存期(图1b)。为了有效地评价肿瘤微环境,接下来对肿瘤组织解离出的149,048个优质细胞进行scRNA-seq分析(图1c)。比较发现,Neo/Rec和ND样品的T细胞、小胶质细胞和巨噬细胞有显著差异。最重要的是巨噬细胞占总细胞的37.5%,并且在疾病阶段被低估,这表明它们在GBM进展和治疗中的重要功能(图1d)。利用cNMF矩阵分析,显示了患者存在异质性,并寻找共享的表达模块(图1e)。ST分析表明,与瘤旁区相比,缺氧、血管生成和炎症反应的在肿瘤核心区域更为明显。肿瘤核心中与细胞外基质组织、血管生成、IL-4、IL-13信号传导和炎症相关的基因表达增加(图1f,g)。这些发现强调了不同GBM肿瘤区域存在动态的空间图谱。
4.SIGLEC9+ TAM来源于单核细胞
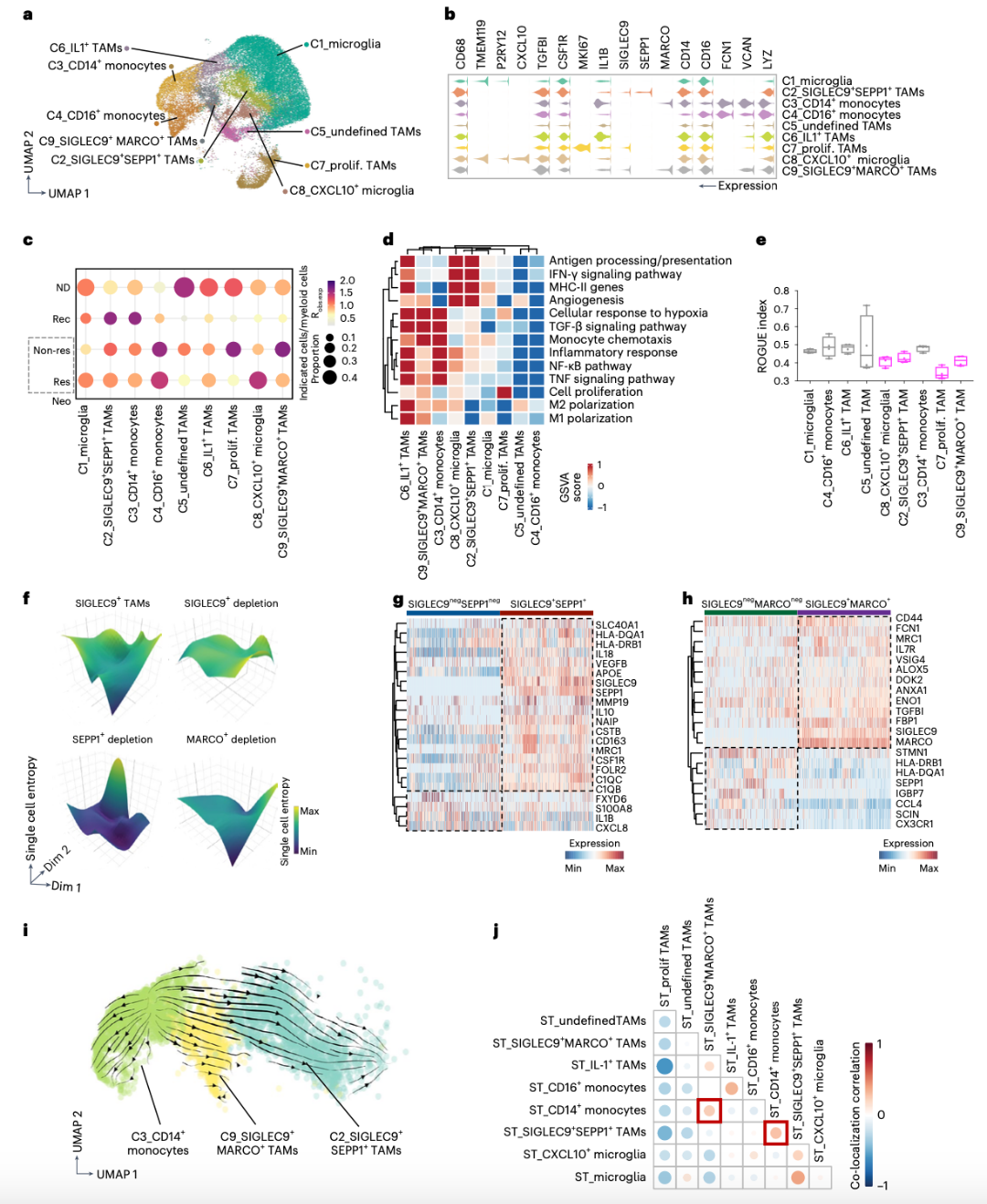
为了探索SIGLEC9+ TAM的来源,作者进行了RNA速率分析。结果表明,单核细胞从CD14+单核细胞(C3)向SIGLEC9+SEPP1+ TAM(C2)和SIGLEC9+MARCO+TAM(C9)方向分化(图2i)。值得注意的是,SIGLEC9+MARCO+ TAM在单核细胞趋化途径中表现出富集(图2d),进一步支持了单核细胞迁移到肿瘤中并逐步分化为SIGLEC9+ TAM的观点。因此,推演出SIGLEC9+MARCO+ TAM可能代表循环单核细胞向SIGLEC9+SEPP1+ TAM分化的过渡状态。利用反卷积将ST和scRNA-seq数据整合,通过推断细胞类型在ST点内的空间共定位,发现SIGLEC9+SEPP1+ TAM或SIGLEC9+MARCO+ TAM与CD14+单核细胞的共定位于同一区域,进一步表明它们来源于CD14+单核细胞(图2j)。
5.SIGLEC9+ TAM在新辅助治疗后积累
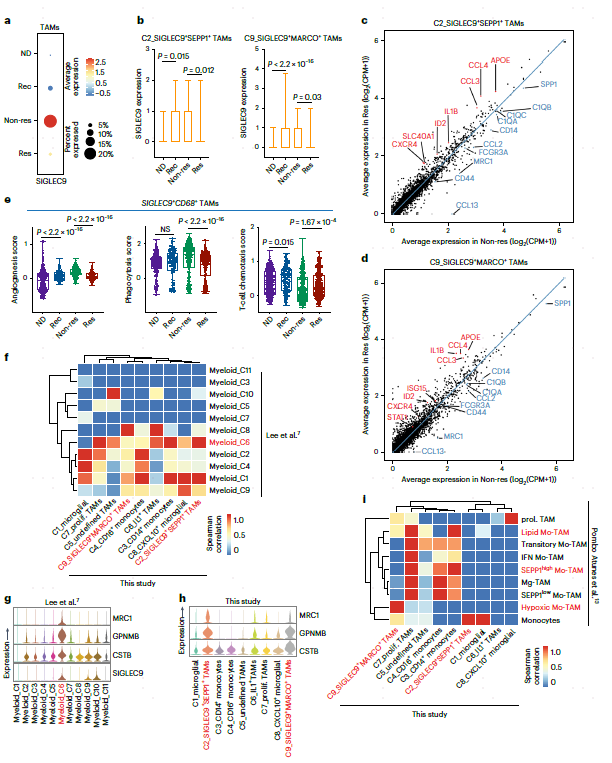
SIGLEC9在单核细胞和巨噬细胞中有大量表达,并且发现SIGLEC9在无应答样本中的表达明显高(图3a)。此外,SIGLEC9在SIGLEC9+SEPP1+ TAM和SIGLEC9+MARCO+ TAM上的表达在应答样本中显著降低,提示其具有抑制作用(图3b)。接下来,本文检测了ST样品中含有SIGLEC9+ TAM-的点的空间分布。Res中SIGLEC9+MARCO+细胞的比例低于Non-res样本,而SIGLEC9+SEPP1+ TAM的分布没有变化。SIGLEC9+MARCO+ TAM主要位于瘤旁区,SIGLEC9+SEPP1+ TAM位于肿瘤核心,支持循环CD14单核细胞的逐步迁移过程,即循环单核细胞首先浸润瘤旁区并分化为SIGLEC9+MARCO+ TAM,然后迁移到肿瘤核心并分化为SIGLEC9+SEPP1+ TAM。
差异基因分析显示,与ICB治疗的Res相比,Non-res中SIGLEC9+SEPP1+和SIGLEC9+MARCO+ TAM表达更高的C1QA、C1QB、CD14和SPP1。在Res中,炎症因子APOE、IL1B、STAT1、T细胞趋化因子CCL3、CCL4和IFN-γ相关的ISG15上调(图3c,d)。值得注意的是,SIGLEC9+ TAM在Res表现出更好的T细胞趋化性,这表明它们可以增强ICB治疗的阳性反应(图3e)。作者还对最近发表的两个GBM scRNA-seq据集进行了交叉研究比较。SIGLEC9+ TAM与新辅助PD-1治疗的GBM数据集中的myeloid_C6亚群相似,都表达免疫抑制基因,如GPNMB、CSTB和MRC1(图3f-h)。在复发性GBM数据集中,SIGLEC9+SEPP1+ TAM与TAM亚群一致表达吞噬/脂质和抗炎基因,SIGLEC9+MARCO+ TAM与缺氧TAMs相似(图3i),表明SIGLEC9+ TAM的免疫抑制功能。
图3 SIGLEC9+巨噬细胞在新辅助抗PD-1治疗后持续存在
6.SIGLEC9+ TAM与临床中预后不良有关
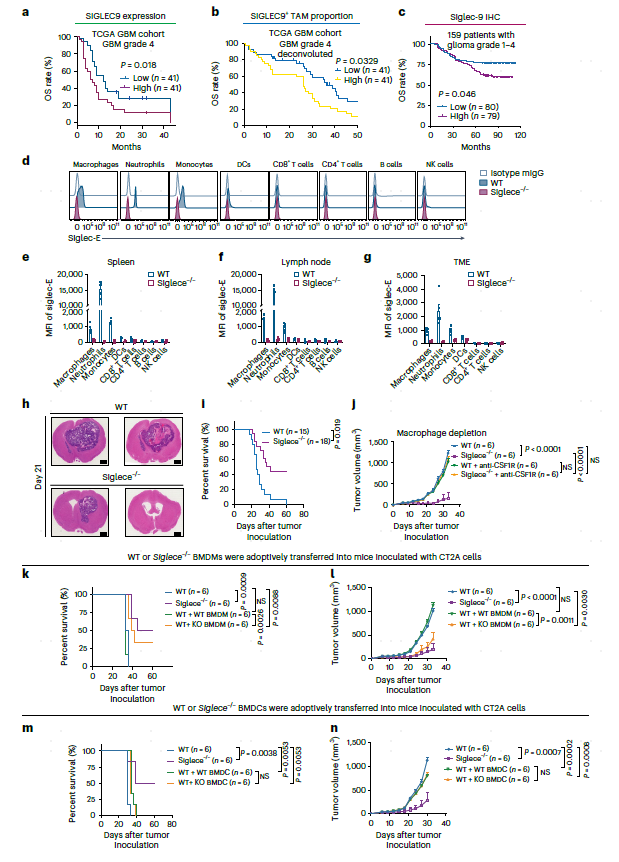
接下来,本文评估了大量临床队列中的SIGLEC9基因表达。结果发现,在癌症基因组图集(TCGA)GBM队列中,SIGLEC9的表达与OS呈负相关(图4a)。使用CIBER-SORTx反卷积分析33对TCGA数据,以本文的scRNA-seq为参考,发现SIGLEC9+ TAM比例显示与同一队列中的OS呈负相关(图4b)。此外,还使用大量GBM队列生成的组织微阵列,通过免疫组织化学(IHC)评估Siglec-9。结果与预期一致,该队列中高水平的Siglec-9与OS呈负相关(图4c)。
图4 小鼠GBM模型中,SIGLEC9+巨噬细胞与预后不良相关,SIGLEC9缺失影响肿瘤生长
7.Siglece缺失增强了小鼠的抗肿瘤活性
Siglece是小鼠SIGLEC9的同源物,作者使用野生型(WT)和Siglece敲除(Siglece−/−)小鼠进行了反向研究。首先在蛋白质水平上评估了C57/BL6小鼠的Siglec-E表达。WT小鼠在脾和淋巴结中的巨噬细胞、中性粒细胞和单核上高度表达Siglec-E,在DCs上的表达较少,但在T细胞、B细胞或自然杀伤(NK)细胞上几乎没有表达,而Siglece−/−小鼠在所有这些免疫细胞上缺乏Siglec-E的表达(图4e),同样在肿瘤浸润白细胞中发现了Siglec-E的表达,与接种CT2A胶质瘤细胞的小鼠合成肿瘤的脾脏和淋巴结观察到的表达相似(图4g)。Siglece的缺失明显阻碍了腭内肿瘤的生长(图4h),从而延长了小鼠的存活时间(图4i)。
由于Siglec-E在其他髓系细胞上表达(图4d-g),使用CSF1R单克隆抗体阻断,致巨噬细胞消融并消除肿瘤中的TAM浸润后,发现巨噬细胞的耗竭完全消除了缺乏Siglece小鼠的肿瘤生长抑制(图4j)。此外,与单独Siglec-E敲除相比,携带肿瘤的Siglece−/−小鼠在CSF1R+巨噬细胞耗尽时的存活率显著下降。为了进一步排除Siglece−/−小鼠的非特异性缺失因素,培养了骨髓源性巨噬细胞(BMDM)转移到肿瘤携带肿瘤的小鼠中。移植的Siglece−/− BMDMs阻碍了WT肿瘤小鼠的肿瘤生长和小鼠的延长了小鼠的存活时间(图4k,l)。相比之下,与WT BMDCs相比,转移的Siglece−/−骨髓源性DCs(BMDCs)对肿瘤生长的影响没有不同(图4m,n)。这些结果表明,在小鼠GBM模型中,表达Siglece的巨噬细胞是介导肿瘤根除的主要细胞群。
8.Siglece缺失会激活巨噬细胞和T细胞
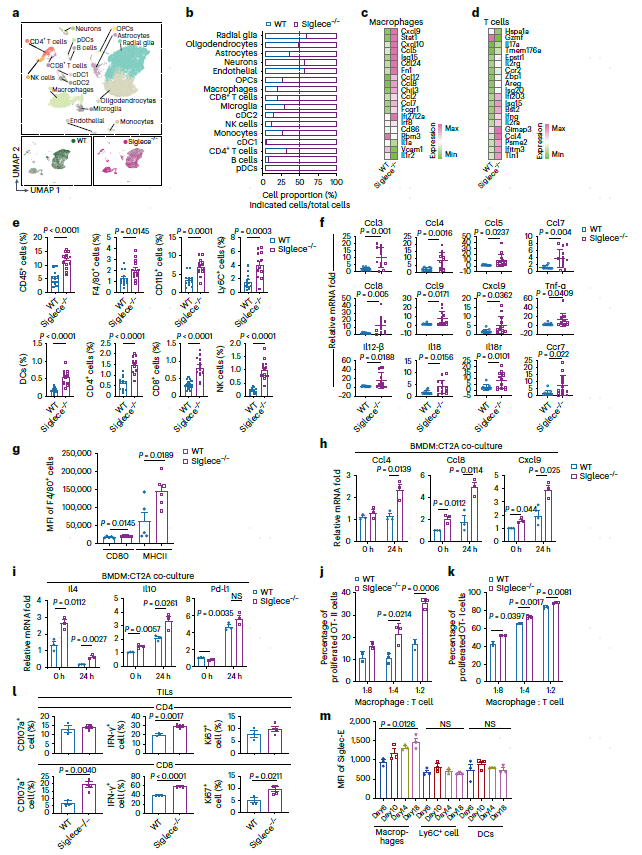
接下来,作者使用scRNA-seq分析评估了Siglece-/-小鼠的颅内肿瘤微环境(图5a)。Siglece-/-小鼠的肿瘤中巨噬细胞、T细胞、NK细胞和DC免疫细胞大幅增加(图5b)。巨噬细胞抗肿瘤反应的基因的表达上调,包括趋化因子Ccl3、Ccl4、Ccl5、Ccl7、Ccl8、Ccl9、Cxcl9和Cxcl10,它们招募和激活细胞溶解性T细胞,以及IFN-γ刺激的基因,如Isg15(图5c),T细胞在颅内Siglece-/-肿瘤中表达的Il2、Il17a和Ifng水平高于WT(图5d)。FACS分析还显示,与WT相比,Siglece缺失时,CD45+细胞、髓样细胞和淋巴细胞的浸润显著增加,这与scRNA-seq分析一致(图5e),这些结果还通过RT-PCR分析得到了验证(图5f)。接下来,分析了肿瘤内巨噬细胞,发现Siglece-/-巨噬细胞中CD80和MHC-II等活化标志物的表达增加(图5g)。与CT2A细胞共同培养Siglece-/- BMDMs显著增加了趋化因子的表达,包括Ccl4、Ccl8和Cxcl9(图5h)。
图5 Siglece的缺失导致免疫细胞浸润增强,巨噬细胞和T细胞活化
研究发现,当与CT2A细胞共同培养时,BMDMs中的Siglece缺失显著增加了Il4和Il10的表达。虽然Pd-l1表达随着Siglece的缺失而增加,但它在共同培养后仍然与WT BMDM相似(图5i)。两个相左的结果表明,由Siglec-9耗尽引发的抗肿瘤功能更有可能通过免疫激活来介导,而不是通过缓解的免疫抑制来介导。
接下来的问题是Siglece的敲除是否可以优先启动T细胞激活。Siglece-/- BMDM分别显著增加了OT-II或OT-I转基因小鼠增殖性CD4+和CD8+ T细胞的比例(图5j,k)。Siglece敲除小鼠的肿瘤浸润淋巴细胞(TILs)也显示激活标志物的表达增加,如CD107a、IFN-γ和Ki67(图5l)。此外,还发现在WT小鼠皮下肿瘤生长期间,巨噬细胞上Siglec-E的表达增加,而不是DCs的表达(图5m)。这一结果进一步支持了负反馈回路的存在,其中Siglece可以作为巨噬细胞的免疫检查点防止免疫系统的过度反应。
9.Siglece-/-与T细胞合作抑制GBM生长
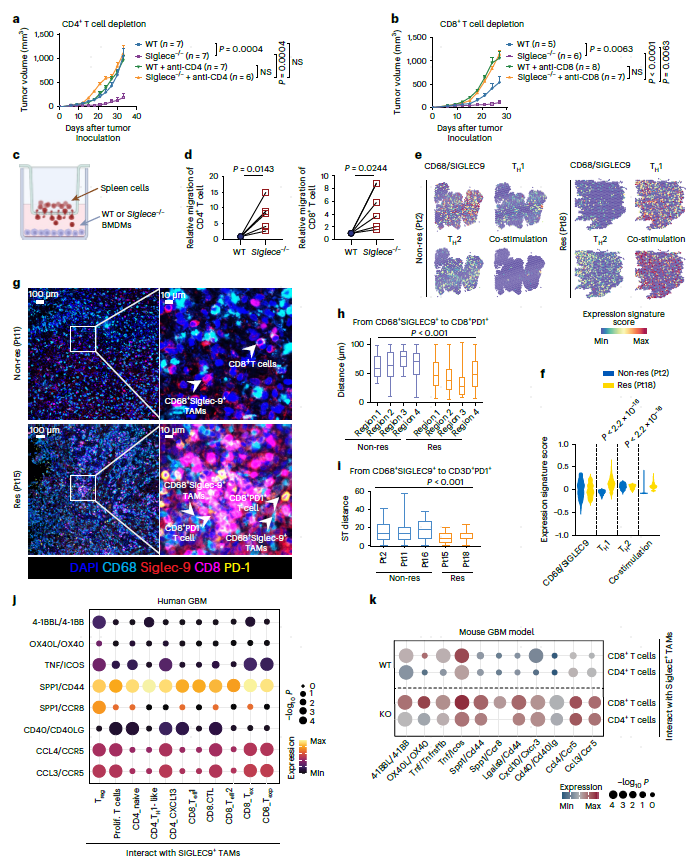
为确定SIGLEC9+ TAM是否与CD4+或CD8+ T细胞一起清除小鼠GBM肿瘤,作者使用抗体耗尽WT和Siglece-/-荷瘤小鼠的CD4+或CD8+ T细胞。结果与之前相似,虽然Siglece敲除抑制了肿瘤生长,但Siglece-/-小鼠的CD4+ T细胞枯竭显著降低了肿瘤生长抑制,并导致肿瘤生长速度与WT小鼠相似(图6a)。值得注意的是,Siglece-/-或WT小鼠的CD8+ T细胞耗尽导致无法抑制肿瘤生长,Siglece缺陷小鼠加速了肿瘤生长,这表明Siglec-E可能以CD8+ T细胞细胞毒性依赖的方式介导肿瘤排斥(图6b)。结果表明,靶向Siglece可减轻Siglece+ TAMs的免疫抑制特性,并且该结果是由CD4+ T细胞和CD8+ T细胞介导的。
图6 靶向Siglece+巨噬细胞与T细胞协同抑制肿瘤生长,Siglece+/SIGLEC9+巨噬细胞与T细胞存在空间关联
10.SIGLEC9+ TAMs直接与GBM中的T细胞相互作用
对WT或Siglece-/- BMDM进行共同培养T细胞迁移进行评估。Siglece-/- BMDM显著增强了CD4+ T细胞和CD8+ T细胞的迁移(图6d)。将SIGLEC9+ TAM和T细胞相互作用与scRNA-seq和ST数据关联,对ST数据中CD68+SIGLEC9+细胞和T细胞共定位分析显示,Res中TH1和共刺激特征增加(图6e,f)。多重免疫组化显示,在Res中,CD68+SIGLEC9+细胞在空间上更接近CD8+PD-1+ T细胞(图6g,h)。同样,ST数据中CD68+SIGLEC9+细胞和CD3+PDCD1+ T细胞之间的空间距离在Res中比Non-res更接近(图6i)。scRNA-seq数据显示,SIGLEC9+ TAM通过CCL4-CCR5、CCL3-CCR5、SPP1-CC8、CD40-CD40L和4-1BBL-4-1BB等多个互作对与T细胞相互作用(图6j)。这些相互作用在小鼠GBM中发现,并且Siglece敲除后得互作更增强,支持巨噬细胞与T细胞互作是Siglec-9/Siglec-E依赖性的(图6k)。
11.Siglece缺失增强了抗PD-1/PD-L1治疗的疗效
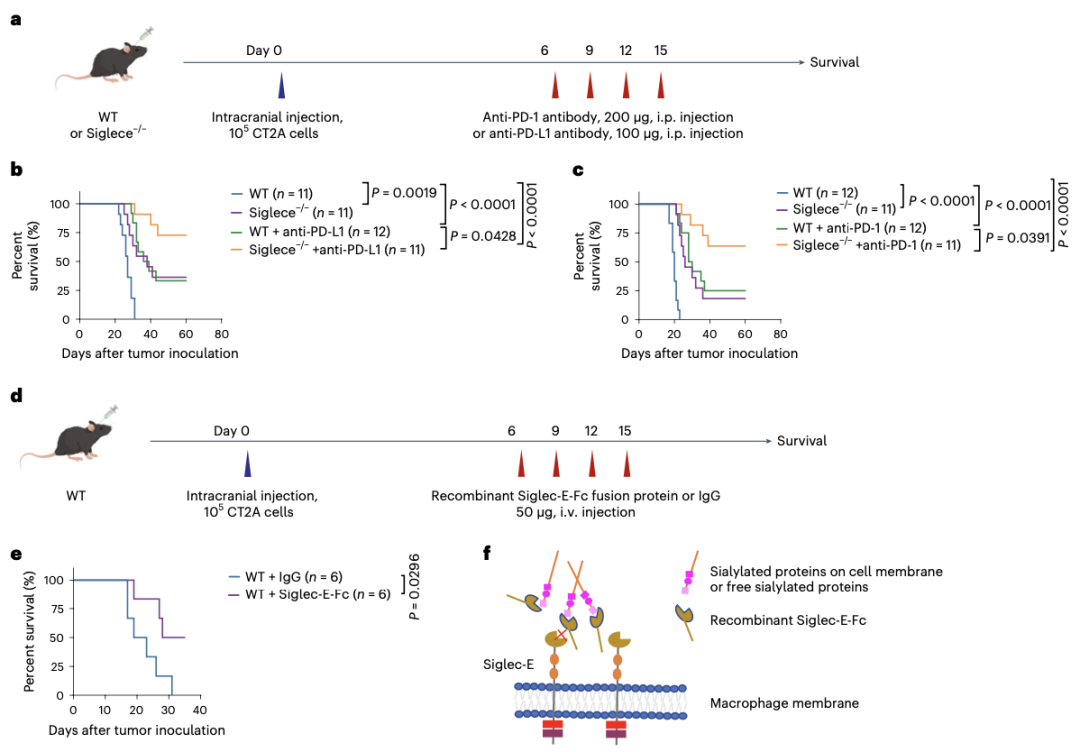
作者试图验证Siglece缺失诱导的炎症肿瘤微环境是否可以与ICB治疗协同抗肿瘤。WT或Siglece-/-小鼠颅内接种CT2A胶质瘤细胞,然后用抗PD-1或抗PD-L1抗体治疗(图7a)。与不治疗相比,治疗后的生存期显著延长(图7b,c)。接下来,作者用由Siglec-E胞外结构域重组蛋白治疗患肿瘤的小鼠,该蛋白融合到小鼠IgG2a Fc结构域(Siglec-E-Fc),并观察到与IgG治疗相比融合蛋白治疗后存活时间较长(图7d,e)。
因此作者提出,Siglec-E-Fc可以与肿瘤细胞膜上的唾液酸化蛋白或游离唾液酸化蛋白结合,从而与巨噬细胞上的内源性Siglec-E竞争结合位点,以阻断Siglec-E信号传导(图7f)。结合本文结果和最近的一项研究表明,针对Siglec-9的阻断抗体可以大大减轻肿瘤负担,并提高人源化小鼠B16黑色素瘤抗PD-1治疗效果。
图7 Siglece的缺失增强了ICB治疗的疗效,是GBM治疗的潜在靶标