1.晚期NSCLC患者PL和LM对免疫治疗的局部响应存在差异
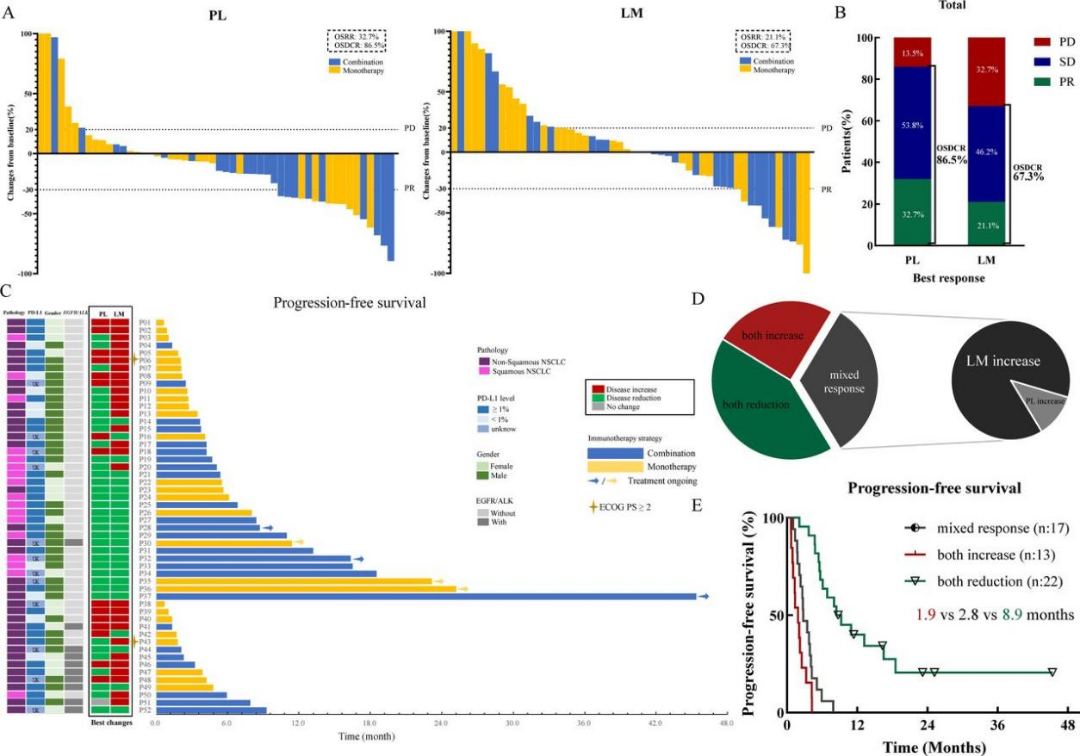
本文分析了52名接受免疫治疗的肝转移NSCLC患者的临床数据来分析器官特异性疗效差异。52名患者均有完整的影像学疗效评估数据。无论免疫单药治疗还是联合治疗,LM病灶的器官特异性客观缓解率和疾病控制率均低于PL病灶。值得注意的是,52名患者中有17名患者表现为混合疗效,其中15名患者均表现为LM病灶增大,且这部分患者的OS和PFS均显著低于PL和LM病灶均缩小的患者,提示在接受免疫治疗时,尽管PL病灶得到控制,但LM病灶局部控制不佳仍然提示较差的生存获益。
图2:晚期NSCLC患者的PL和LM对免疫治疗的器官特异性响应
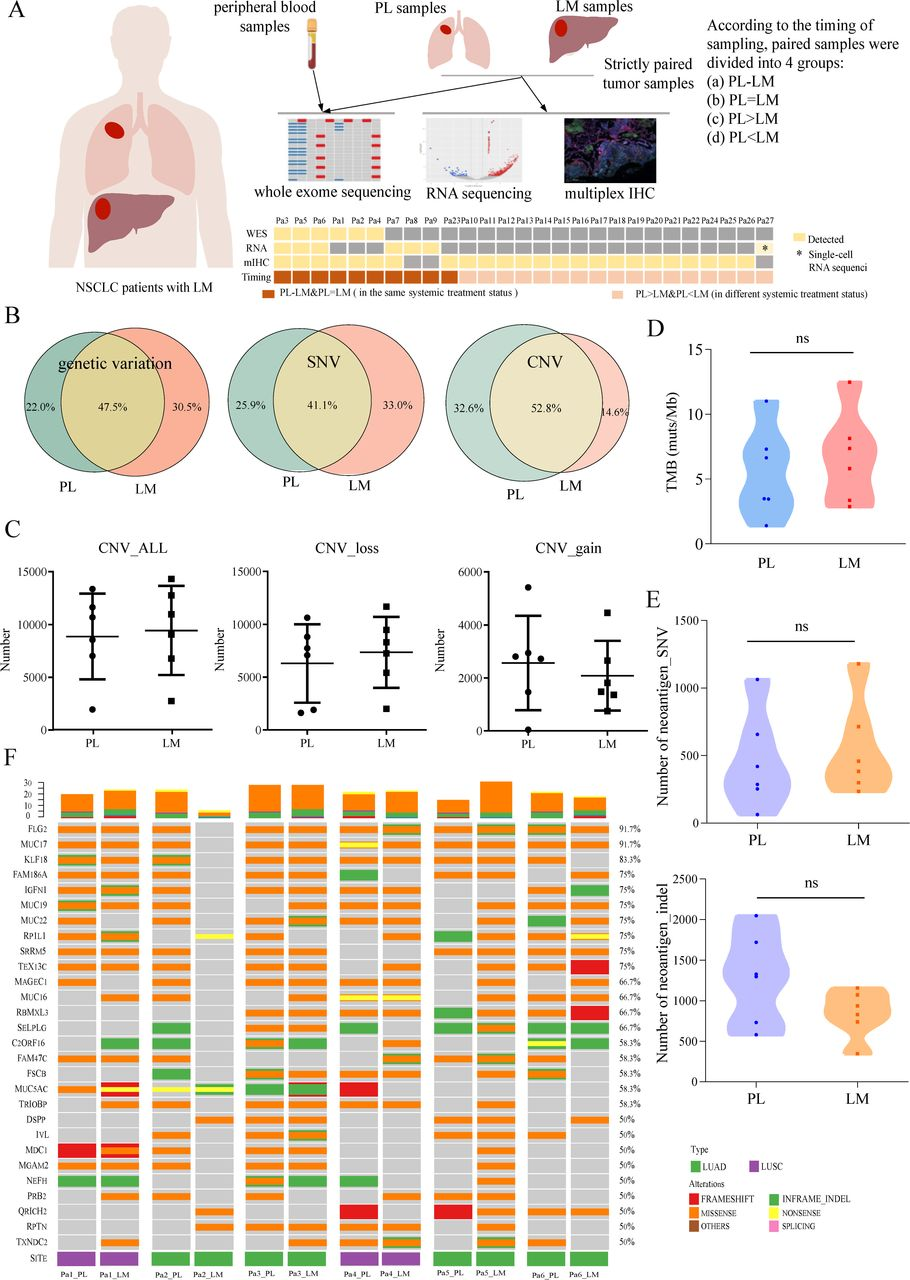
2.WES揭示了配对PL和LM样本间有限的基因组异质性
研究人员对6名患者的配对PL和LM样本(肿瘤治疗状态相同的时间点取样)及外周血对照样本进行了全外显子测序(WES)来探索基因组水平的突变异质性。从整体遗传变异、CNV和SNV突变水平上看,PL和LM两组间并显著差异。另外,肿瘤突变负荷(TMB)和SNV和indel预测的新抗原数量也显示组间无显著性差异。进一步分析突变的异质性基因,也没有发现PL和LM之间显著不同的基因突变。以上WES分析结果均表明,配对PL和LM样本间的基因组异质性较低。
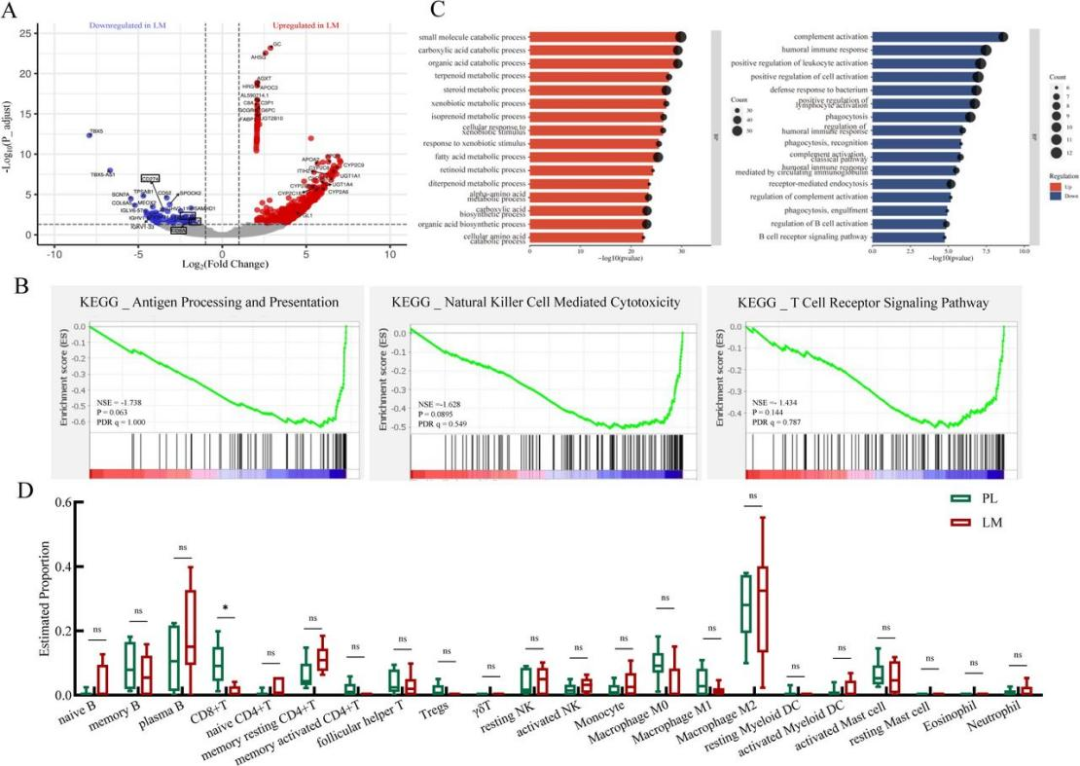
3.bulk RNA测序揭示PL比LM更富集促免疫信号通路
为评估 PL和LM之间的转录组异质性,研究人员对6对同时采样的配对PL和LM样本进行了bulk- RNA测序。差异基因分析共发现了571个差异基因,其中469个基因在PL组上调,102个基因在LM组上调,体现了肿瘤间的转录组异质性。对差异基因进行富集分析发现,LM上调基因主要与代谢酶功能相关,与肝脏组织常规生理功能相符合;而PL组则富集了免疫相关功能,其中与T细胞激活有关的基因CD8A、LCK和ICOS在PL组上调。对可影响免疫治疗疗效的基因集合进行GSEA分析发现,抗原呈递、NK细胞介导的细胞毒性和T细胞受体信号通路在PL组富集,可部分解释PL和LM免疫治疗响应的差异。反卷积免疫浸润分析发现,PL组的CD8+T细胞占比显著高于LM组。
图4:NSCLC患者转录组差异显示LM存在免疫抑制的肿瘤微环境
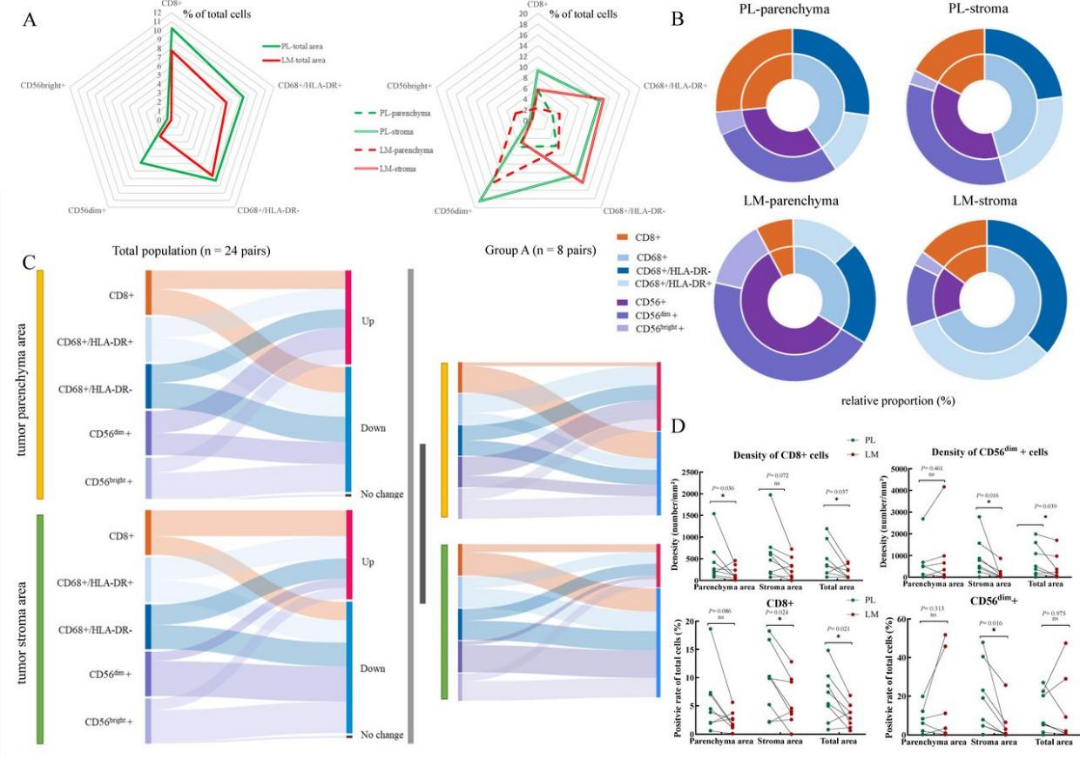
4.mIHC揭示PL的T细胞和NK细胞的肿瘤浸润比例高于LM
为进一步在蛋白质水平上确认PL和LM之间的免疫细胞浸润差异,研究人员对24对肿瘤样本的肿瘤实质区域和肿瘤基质区域进行了mIHC分析,并着重关注了肿瘤治疗状态相同的时间点取样的配对样本(Group A)。分析共纳入了5个蛋白marker (panCK、CD8A、CD56、CD68和HLA-DR),用于识别panCK+肿瘤细胞、CD8+T细胞、CD56dim+细胞毒性NK细胞、CD56bright+免疫调节NK细胞、CD68+HLA-DR+巨噬细胞(M1-like)和CD68+HLA-DR-巨噬细胞(M2-like)。通过分析免疫细胞的浸润比例发现,PL组CD8+、CD56+和CD68+细胞在实质和基质区域浸润趋势相似;而LM组实质区域主要免疫浸润细胞类型为CD56+细胞,基质区域则主要为CD68+细胞。进一步对比PL和LM组蛋白marker的密度和阳性细胞比例,发现在所有样本中仅有CD56+细胞在PL中显著高于LM组,而在排除治疗影响的Group A中则发现CD8+和CD56+细胞均在LM中显著降低,与转录组测序结果一致。
图5:mIHC显示NSCLC患者免疫浸润水平的差异
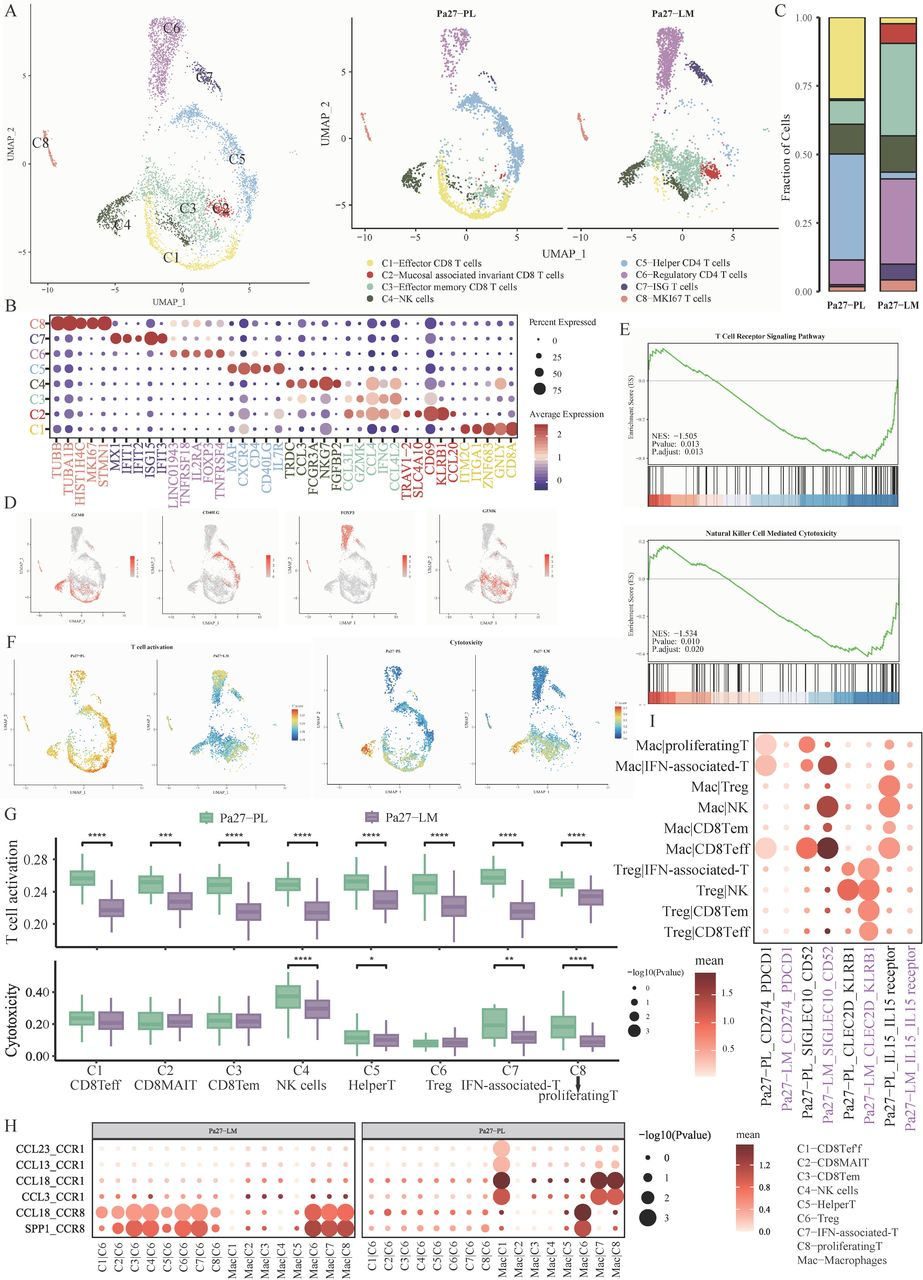
5.单细胞转录组测序揭示PL中有更多CD8Teff细胞浸润和更高的NK细胞毒性
为了验证转录组测序和mIHC中得到的结果,研究人员进一步对一名NSCLC患者的配对PL和LM新鲜肿瘤组织进行了单细胞测序,并着重研究了T和NK细胞在肿瘤免疫微环境中的差异。单细胞测序结果发现LM中有更多的Treg和CD8Tem,而PL则有更多CD8Teff和HelperT,与前文结果一致。对T和NK细胞进行GSEA富集分析同样发现了NK细胞介导的细胞毒性和T细胞受体信号通路在PL中显著上调。通过单细胞基因集合分析发现,各细胞亚群的T细胞激活水平都呈现为PL高于LM,且CD8Teff和干扰素相关T细胞亚群的T细胞激活水平最高。T细胞毒性水平也呈现组间差异,其中NK细胞、HelperT细胞、干扰素相关T细胞和增殖T细胞的毒性水平在PL组显著高于LM组,且NK细胞是所有亚群中细胞毒性水平最高的亚群。
为了进一步理解T和NK细胞在PL和LM组分布差异的机制,研究人员分别对PL和LM样本进行了细胞相互作用分析。分析显示,PL组有更多Teff招募相关的趋化因子表达,包括CCL23、CCL13、CCL18和CCL3;与此同时,与Treg招募相关的互作对CCL18_CCR8和SPP1_CCR8则在LM组更为显著。另外,LM组的T和NK细胞可以通过CLEC2D_ KLRB1和SIGLEC10_CD52互作对抑制T细胞激活与T细胞增殖。值得一提的是,与免疫治疗相关的PD-1/L1则仅在PL组的CDTeff细胞和巨噬细胞间有显著互相作用,可推测在PD-1/L1免疫治疗后LM的免疫微环境中的CD8Teff无法被恢复活性。综上,LM中存在更加抑制的免疫微环境,表现为更低的CD8+T细胞和NK细胞浸润水平和激活水平,以及他们受损的细胞毒性能力。
图6:单细胞测序显示T和NK细胞在配对PL和LM间的差异