1. αPD-1-(iRGD)2的合成表征与抗肿瘤机制识别
作者首先通过糖工程方法,将PD-1抗体与iRGD进行位点特异性附着,合成程序性细胞死亡蛋白-1(PD-1)抗体-iRGD环肽偶联物αPD-1-(iRGD)2,并对合成产物特征进行确认分析,表明其对PD-1蛋白的结合亲和力及其半衰期和血清稳定性等;体外实验等表明αPD-1-(iRGD)2作用于PD-1+ T细胞和肿瘤细胞,并提高T细胞活化标志物(CD69和CD25)和细胞毒性标志物(GZMB和IFNg)的表达;小鼠模型实验表明αPD-1-(iRGD)2在肿瘤中具有穿透性和优先分布性,具有广谱的抗肿瘤作用;T细胞迁移抑制和CD8+ T细胞耗竭实验等表明αPD-1-(iRGD)2的抗肿瘤作用依赖于肿瘤微环境中肿瘤特异性CD8+ T细胞在TME中的扩增,并且αPD-1-(iRGD)2可能参与并激活了肿瘤特异性CD8+ T细胞。
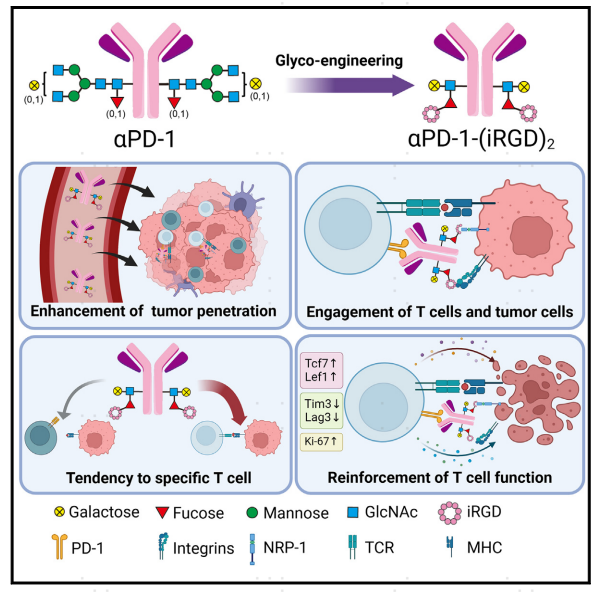
图1. 基于糖工程的抗体-肽偶联物αPD-1-(iRGD)2浸润肿瘤核心并与T细胞和肿瘤细胞结合,激活肿瘤特异性T细胞发挥抗肿瘤作用
2.αPD-1-(iRGD)2重塑肿瘤免疫微环境
为了解析αPD-1-(iRGD)2给药后的免疫景观,作者对CD45+肿瘤浸润免疫细胞进行了单细胞RNA测序。通过密度梯度离心和荧光活化细胞分选分离不同处理组的CD45+细胞,将来自同一治疗组的6只小鼠的CD45+免疫细胞汇集在一起并使用相同的标签进行标记。通过UMAP聚类及marker表达情况注释出T细胞(Trac、Trbc、Cd3d)、树突状细胞(DC) (Cd74、H2-Aa)、巨噬细胞(Adgre1、Itgax、Cd83),单核细胞(Cd14)和NK细胞(Nkg7、Klrb1c和Klrg1) 细胞类型。
在CD8+ T细胞、CD4+ T细胞和NK细胞中观察到效应功能的增强。在用αPD-1-(iRGD)2处理的小鼠中,TME中的NK细胞表达了更高水平的效应基因(Nkg7、Gzma、Prf1和Klrg1)、共刺激因子(Slamf7、Cd244a和Klrk1)、迁移基因(Itgb2、Itga2、Icam1)以及免疫刺激细胞因子和受体(Ifng、Ifngr1、Il2ra和Il2rb)。在CD4+ T细胞中,免疫刺激因子和受体(Ifng、Il2ra、Il18r等)以及共刺激因子(Cd27、Cd28) mRNA水平升高,而Il4、Il6 mRNA水平下调。对于CD8+ T细胞,在αPD-1-(iRGD)2处理小鼠的CD8+ TILs中,几种效应基因(Gzma、Ifng、Ifngr1等)、炎症细胞因子受体(Il2ra、Il7r、Il12rb1等)和共刺激因子(Cd28、Cd27等)的表达水平上调。在αPD-1-(iRGD)2给药后,CD8+ T细胞中最显著的变化之一是几个与干细胞和记忆相关的基因(Lef1, Tcf7, Bach2和Ikzf2)的上调。
除T细胞和NK细胞外,髓系细胞也直接或间接参与了αPD-1的抑瘤作用。KEGG富集分析的结果显示,αPD-1-(iRGD)2处理的小鼠DCs中,IFNg、抗原加工和递呈的反应增强;巨噬细胞中脂多糖和生物刺激的细胞反应富集,表明αPD-1-(iRGD)2可以同时改善DC和巨噬细胞的功能。
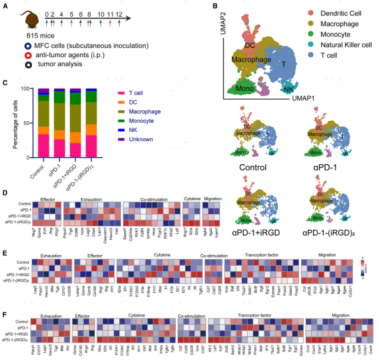
图2. αPD-1-(iRGD)2重塑肿瘤微环境
为了进一步了解αPD-1-(iRGD)2如何改变CD8+ T细胞的分化程序,作者对T细胞重新进行了细分注释,通过UMAP聚类及marker表达情况注释出6个亚型,包括CD8+ Better Teff、CD8+ Teff、CD8+ Int Tex、CD8+ Term Tex、CD8+ Tmem和CD4+ T细胞。在αPD-1-(iRGD)2处理小鼠的TILs中,以干细胞和记忆相关基因(Tcf7、Il7r、Lef1和Bach2)表达和效应基因(Gzma、Gzmb和Ifng)中等表达为特征的CD8+ T细胞亚群(CD8+ Better Teff)的丰度增加,而耗竭相关基因(Pdcd1、Lag3、Havcr2 (TIM-3)和Entpd1)在该CD8+ TILs群体中是表达较低。CD8+ Better Teff细胞的扩增表明αPD-1-(iRGD)2增强了TILs的效应功能,同时避免了耗竭并维持了CD8+ TILs的干细胞和记忆特性。
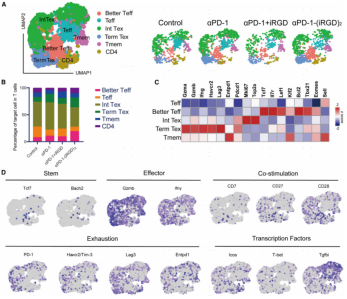
图3. αPD-1-(iRGD)2引起TILs群体(CD8+ Better Teff)的扩增
3. 小鼠αPD-1-(iRGD)2的构建与评价
CS1003是一种人源化抗体,对人和鼠PD-1蛋白具有相似的亲和力。为了排除CS1003抗体的人源化Fc结构域对αPD-1-(iRGD)2抗肿瘤效果产生影响,作者还利用另一种小鼠αPD-1(G4C2, TopAlliance)构建了αPD-1-(iRGD)2,并确认了小鼠αPD-1-(iRGD)2同样具有预期的分子量、与小鼠PD-1的亲和力及明显的抗肿瘤效果。












