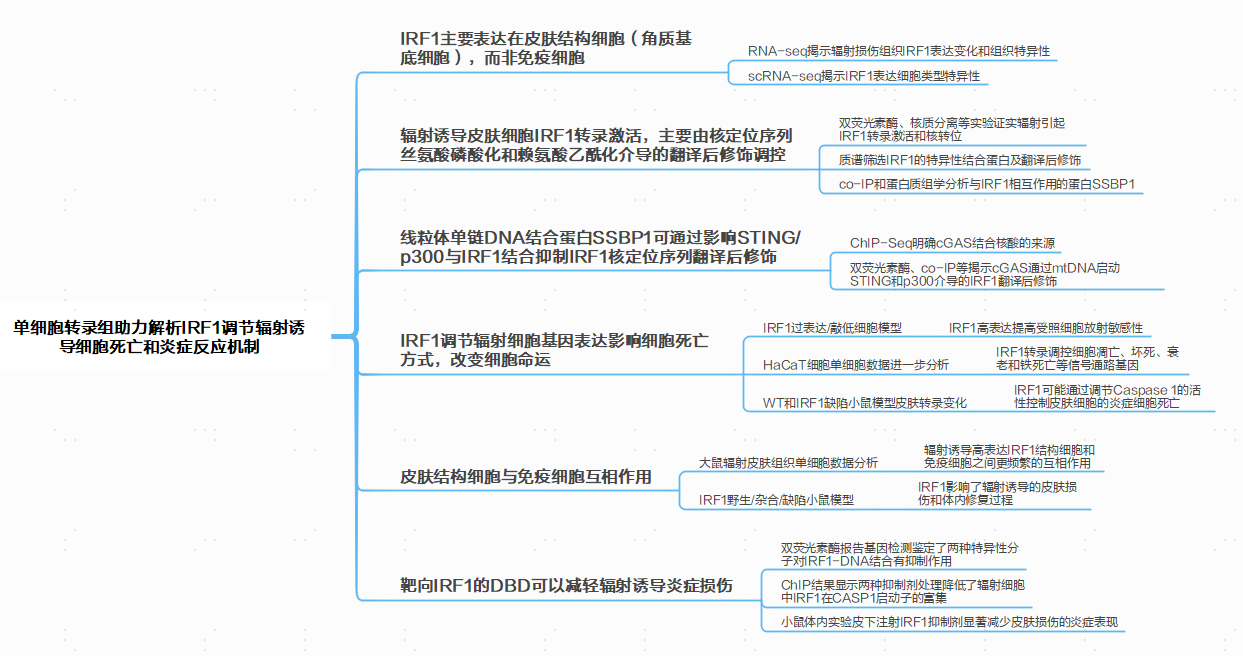
皮肤、肺部和肠道等屏障器官是抵御日常环境攻击的第一道防线,当遇到例如病原体感染、紫外线(UV)辐射、电离辐射和细胞毒性时,防御系统会被激活,招募激酶和酶来修复受损的基因组,并激活炎症信号通路以防止组织损伤。一般认为炎症反应是由免疫细胞执行的,其中主要群体包括髓系细胞和淋巴细胞,它们分别构成先天性免疫系统和适应性免疫系统。基于既往RNA-seq研究结果,作者发现在辐照处理后,相比于胃或肺组织,IRF1在大鼠皮肤组织和HaCaT细胞中特异性富集,且这些研究中的差异基因功能富集分析结果显示出干扰素相关免疫反应激活。结合辐射后大鼠皮肤组织和人永生化角质形成细胞(HaCaT)单细胞转录组测序数据,发现IRF1主要在皮肤结构细胞,尤其是角质基底细胞中表达,而在免疫细胞中表达较低(图2)。
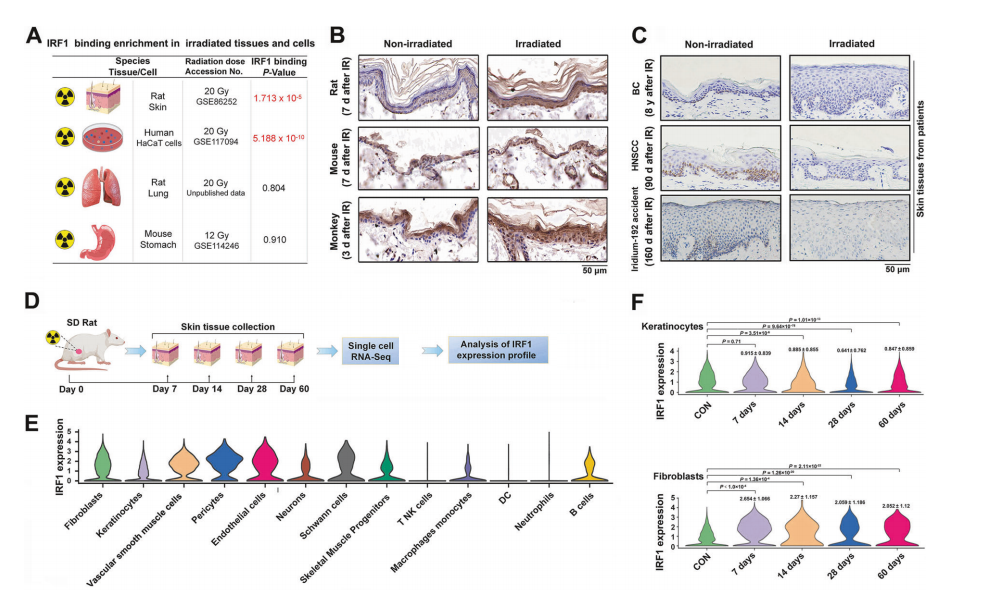
接下来作者通过双荧光素酶、核质分离、质谱、ChIP-seq等实验发现辐射可引起mtDNA释放诱导cGAS-STING信号通路激活,促进IRF1核定位序列发生丝氨酸磷酸化和赖氨酸乙酰化翻译后修饰,进而促进IRF1核转运和转录激活;同时蛋白质组学、co-IP等实验证实SSBP1作为IRF1的抑制性分子伴侣,可通过影响STING/p300与IRF1结合抑制IRF1核定位序列翻译后修饰和转录激活。
随后作者构建了IRF1低表达/过表达皮肤细胞系,开展系列功能研究,结果表明IRF1过表达能够促进未辐照皮肤细胞的死亡和衰老,同时限制细胞的自我更新、增殖和迁移,此外 IRF1的激活也会导致促进细胞死亡的基因表达增加,改变了辐射细胞的分化命运(图3C-N)。为了证实这一发现,作者对辐照的HaCaT细胞的scRNA-Seq数据进行了深入挖掘。检测了不同细胞死亡方式的特征基因,包括凋亡、坏死、焦亡等,发现高剂量辐射诱导了不同细胞死亡方式的特征基因表达(图3O)。通过SCENIC分析,鉴定出330多个IRF1的靶向基因,并发现这些基因参与了细胞死亡相关的多条生物学信号通路。此外,对这些靶基因进行GSVA分析,结果显示IRF1转录调控细胞凋亡、坏死、衰老和铁死亡等信号通路基因(图3Q)。此外还通过拟时序分析可视化了与细胞死亡相关的生物标志物在细胞分化过程中的表达变化(图3R)。以上结果均说明了辐照后IRF1通过调节特定基因的表达来影响细胞的死亡方式,改变细胞的命运。
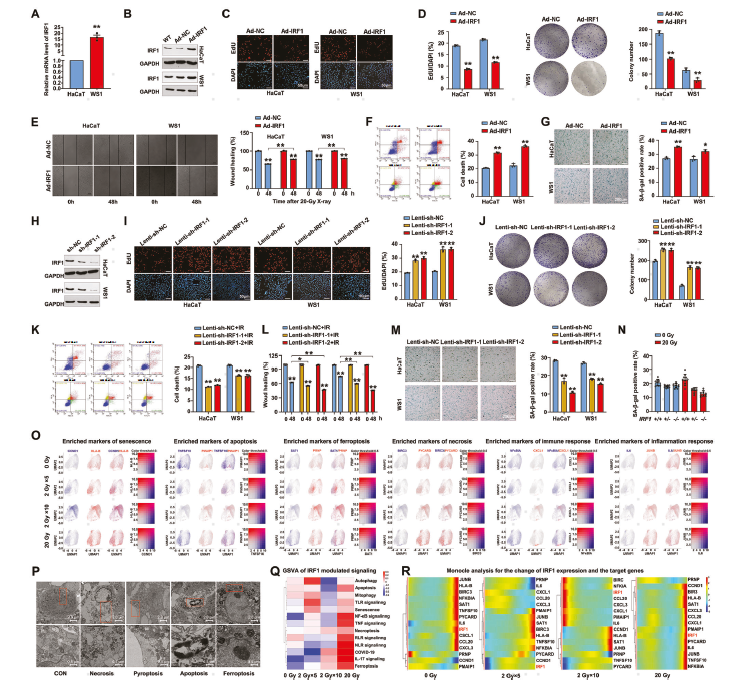
图3 IRF1在辐射的皮肤细胞中触发多种细胞死亡
作者采用IRF1敲除小鼠进一步探究IRF1促进放射性皮肤损伤进展的机制,对敲除小鼠皮肤损伤组织进行转录组测序、ChIP和免疫荧光等研究,证实IRF1可能通过Caspase 1调控皮肤细胞的炎症细胞死亡。对大鼠辐射皮肤中结构细胞与免疫细胞的互相作用进行分析,结果显示,辐射诱导结构细胞和免疫细胞之间更频繁的互相作用;基于IRF1表达水平,将角质细胞和成纤维细胞分为IRF1高表达和低表达细胞簇,发现IRF1不同表达水平也会影响炎症相关的通路作用,例如CCL和IL1信号通路(图4A-B)。接受辐射后的缺陷小鼠表现出正常皮肤结构,辐射诱导的皮肤损伤及炎症浸润较轻,IRF1的敲除显著影响了淋巴细胞的增殖、分化和活化以及组织重塑,表明IRF1在体内干扰了放射性皮肤损伤及其修复过程(图4E-K)。
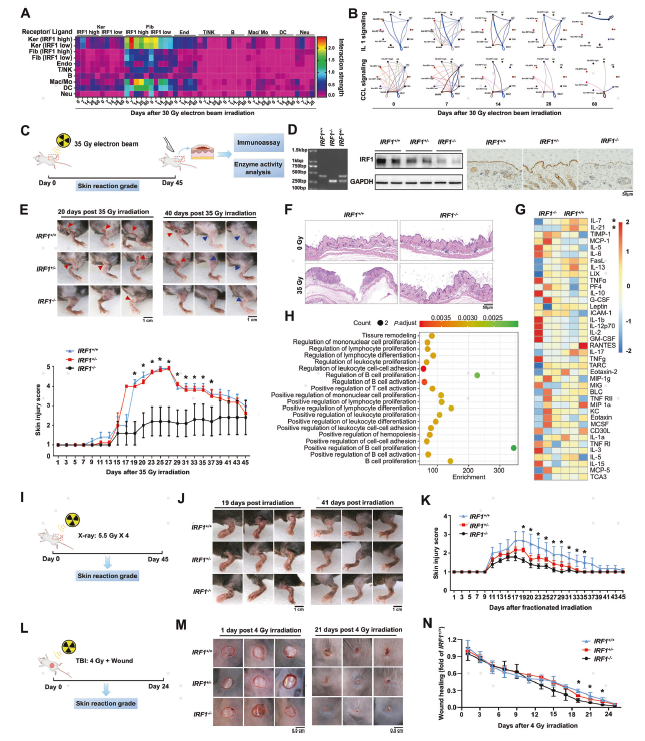
图4 IRF1影响辐射诱导的炎症性皮肤损伤
在明确IRF1激活对放射性皮肤损伤的作用及机制后,作者通过双荧光素酶实验等方法,筛选出两种可抑制IRF1转录活性的小分子化合物I-2和I-19。在此基础上,开展体外细胞实验和小鼠在体实验,证实了这两种抑制性小分子能够通过靶向IFR1的DNA结合区域(DBD)来抑制IRF1转录活性,从而有效减轻放射性皮肤损伤,体内外均显示出对辐射诱导皮肤损伤的的保护作用。因此,作者认为靶向IRF1转录活性位点的小分子化合物可有效减轻放射性皮肤损伤进展,同时也可能对其他IRF1过度激活相关的疾病(如新冠等)有效。