湘雅医院肖湘成教授团队采用新格元单细胞技术发表免疫相关肾脏疾病临床研究成果
发布时间:2021-04-27 12:02:13

4月16日,中南大学湘雅医院肾内科肖湘成教授团队联合新格元生物科技有限公司在国际前沿期刊《Frontiers in Immunology》上发表免疫相关肾脏疾病单细胞转录组测序文章,题为:A Partial Picture of the Single-Cell Transcriptomics of Human IgA Nephropathy。文章采集5例肾脏穿刺样本,利用新格元自主研发的GEXSCOPE®解离试剂,成功解离出高活性的细胞悬液,细胞活性在85%-91%,解决了肾脏穿刺样本难解离的问题,成功助力肾脏穿刺样本的研究。
研 究 背 景
IgA肾病(IgAN)是全球最常见的原发性肾小球疾病。该疾病进展缓慢,在诊断的20-30年内有30-40%的患者发展为终末期肾病。迄今为止,IgA肾病的发病机制尚不明确,缺乏对促进疾病进展的细胞类型和分子途径的综合分析。本文利用单细胞RNA测序(scRNA-seq)对IgAN和对照受试者的肾脏活检样本进行全面的分析。首次发现IgAN系膜细胞表现出MALAT1、GADD45B、SOX4和EDIL3等基因的表达增加,这些基因与细胞增殖和基质积聚有关。IgAN肾小管细胞中过表达的基因主要富集在包括TNF信号、IL-17信号和NOD样受体信号在内的炎症通路中。受体-配体分析揭示了IgAN中系膜细胞与其他细胞之间的潜在相互作用。与微量蛋白尿组相比,伴有显性蛋白尿的IgAN患者表现出参与几个信号通路的基因升高。该研究结果为IgAN的发病机制提供了新的认识,并确定了新的治疗靶点。
研 究 结 果
01. 肾脏样本细胞组成
从4例IgAN患者和1例健康供体中收集5例肾脏活检组织标本,总共获得20,570个细胞,通过聚类分析定义了14种不同的细胞类型,分别为:PTC,近端小管细胞;LOH,髓袢细胞;PC,主细胞;IC,闰细胞;DTC,远端小管细胞;EC,内皮细胞;POD,足细胞;MES,系膜细胞;SMC,平滑肌细胞;DC,树突状细胞;MC,巨噬细胞;MON,单核细胞;CC,循环细胞;FIB,成纤维细胞。

图1单细胞RNA测序分析IgAN和对照者的细胞谱系
02. IgAN患者肾小球基因表达变化的鉴定
作者接下来比较了IgAN患者与健康对照者肾小球固有肾细胞的转录组。通过比较IgAN和对照受试者的转录谱,定义了系膜细胞、内皮细胞和足细胞中的代表性DEGs(图2A)。
本文首次报道了IgAN系膜细胞中几种基因(MALAT1、GADD45B、SOX4和EDIL3)的过表达。MALAT1与细胞外基质(ECM)产生、氧化应激和纤维化有关,在IgAN系膜细胞中上调。GADD45B已被证明在DNA损伤、细胞生长和凋亡中发挥重要作用。GADD45B可能参与了局灶节段性肾小球硬化(FSGS)的足细胞损伤。FOS在IgAN患者中富集,在系膜增殖和肾小球硬化中具有重要作用。一致地,基因表达谱显示IgAN系膜细胞中FOS表达升高。GO富集分析显示系膜细胞中的DEGs富集了包括整合素结合和离子通道结合在内的生物学过程(图2C)。
为了进一步验证研究中的发现,作者将4例IgAN患者的结果与已发表的从Gene Expression Omnibus(GSE131685)下载的肾脏细胞图谱数据进行了比较。发现IgAN系膜细胞和内皮细胞中有更多的高表达DEGs。
此外,内皮细胞分为肾小球内皮细胞和血管内皮细胞。GO和KEGG富集分析显示内皮细胞中的DEGs富集了生物学过程或信号,包括细胞-基质粘附、凋亡信号和氧化的正调控(图2D,E)。
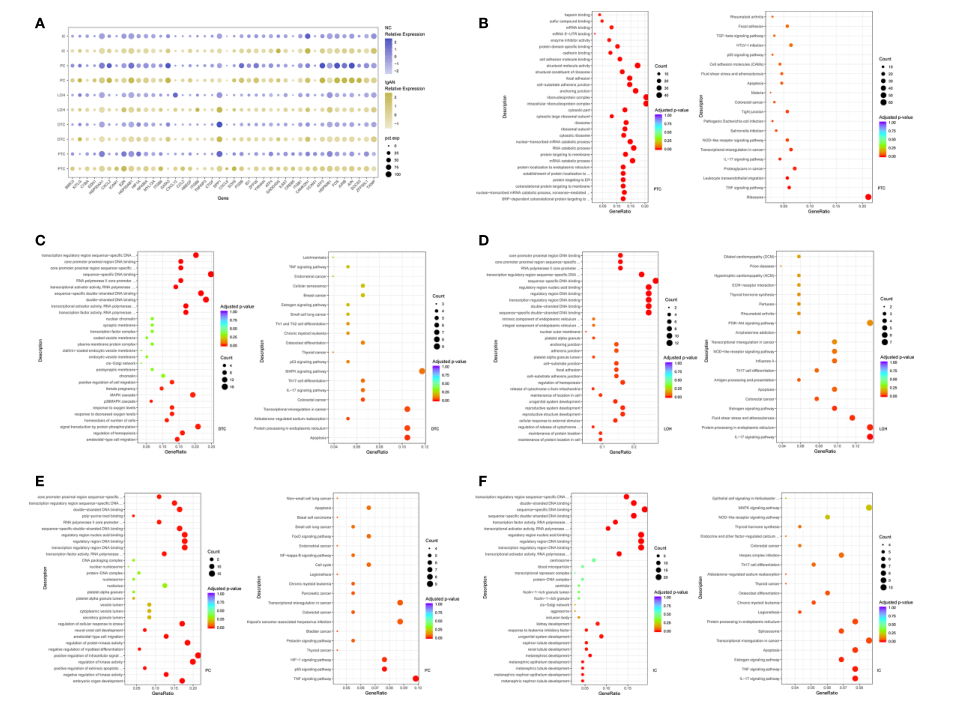
图2 IgAN和对照受试者肾小球和免疫细胞中的DEGs和细胞间信号传导
03. IgAN患者肾小管细胞富集炎症、基质重塑等相关特征
肾小管上皮细胞分为5组,在IgAN和对照者的肾小管中发现了代表性的DEG(图3A)。IgAN患者中发现肾小管细胞信号网络改变。比较IgAN和对照者的近曲小管细胞,发现参与TNF信号、IL-17信号、NOD样受体信号和调节白细胞跨内皮迁移的基因上调(图3B)。比较远端小管细胞中的DEG发现,IgAN中参与MAPK级联、p38MAPK级联的基因富集(图3 C)。IgAN中Henle细胞环增加了参与TNF信号、IL-17信号、Th17细胞分化、NOD样受体信号的基因。
在IgAN中,主细胞和闰细胞富集了参与TNF信号、IL17信号、Th17细胞分化的基因(图3E,F)。此外,NFKBIA,TXNIP,CXCL3,和CXCL2,都参与NOD样受体信号调节,在主细胞和闰细胞中均增加。

图3 IgAN和对照受试者肾小管中的DEGs和细胞间信号
04. 通过配体-受体相互作用分析确定IgAN的细胞-细胞串扰
探索细胞间通讯和信号网络可能为鉴定IgAN新的治疗靶点提供新的机会。图4提出了肾脏不同细胞类型中受体和配体的潜在相互作用(图4A)。IgAN系膜细胞表达CXCL1和CCL2。CXCL1是CXC趋化因子家族的一员,作为系膜来源的调节剂诱导IgAN中其他细胞的损伤。说明系膜细胞中表达的CXCL1和CCL2可能都与内皮连接处表达的趋化因子受体ACKR1相互作用。此外,系膜细胞表达JAGGED1,内皮细胞中表达其受体NOTCH4,表明Jagged/Notch信号通路参与了IgAN的发病机制(图4B)。系膜细胞表达生长因子FGF2和PDGFD,通过与足细胞或髓袢中表达的各自受体FGFR1和PDGFRB相互作用,促进系膜细胞的增殖和基质生成(图4 C、D)。PDGFRB是参与系膜增殖和肾纤维化的基因,也在成纤维细胞中表达(图4E)。
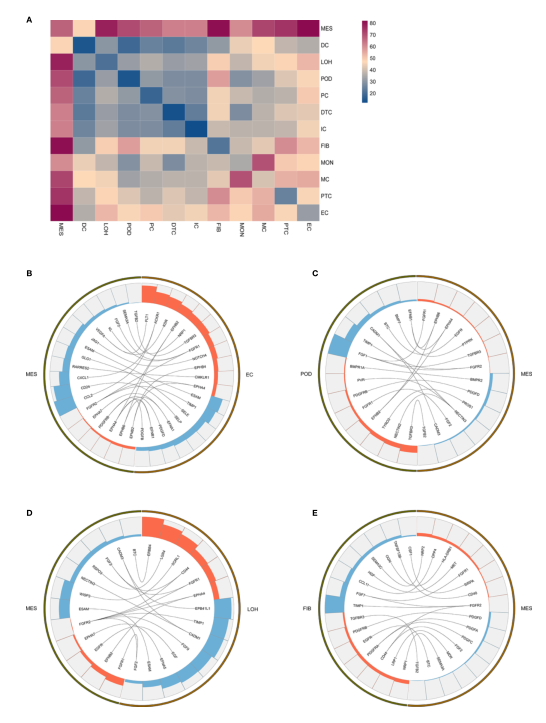
图4 IgAN患者肾脏不同细胞类型之间的配体-受体相互作用
05. 伴有显性蛋白尿的IgAN患者与伴有微量蛋白尿的IgAN患者肾脏DEGs及通路分析
IgAN患者根据蛋白尿水平不同分为微量蛋白尿和显性蛋白尿两组,通过比较两组之间的基因表达谱,发现微量蛋白尿组肾脏基因表达谱与显性蛋白尿组不同。在系膜细胞中的DEGs,与微量蛋白尿相比,显性蛋白尿的IgAN中参与补体激活和替代途径的基因富集(图5A)。伴有显性蛋白尿的IgAN内皮细胞细胞外基质结合和细胞-底物粘附连接相关基因增加(图5B)。此外,在伴有显性蛋白尿的IgAN受试者的近曲小管细胞中,参与许多通路(包括白细胞跨内皮迁移、趋化因子信号和I型干扰素信号通路)的基因增加(图5 C、D)。髓袢细胞中参与ECM受体相互作用、干扰素介导的信号和中性粒细胞活化的基因升高(图5E、F)。相应地,主细胞中参与粒细胞活化和p38MAPK级联的基因升高(图5G)。与微量蛋白尿组相比,在伴有显性蛋白尿的IgAN中,闰细胞参与干扰素-γ介导的信号通路和T细胞共刺激的基因增加(图5H)。
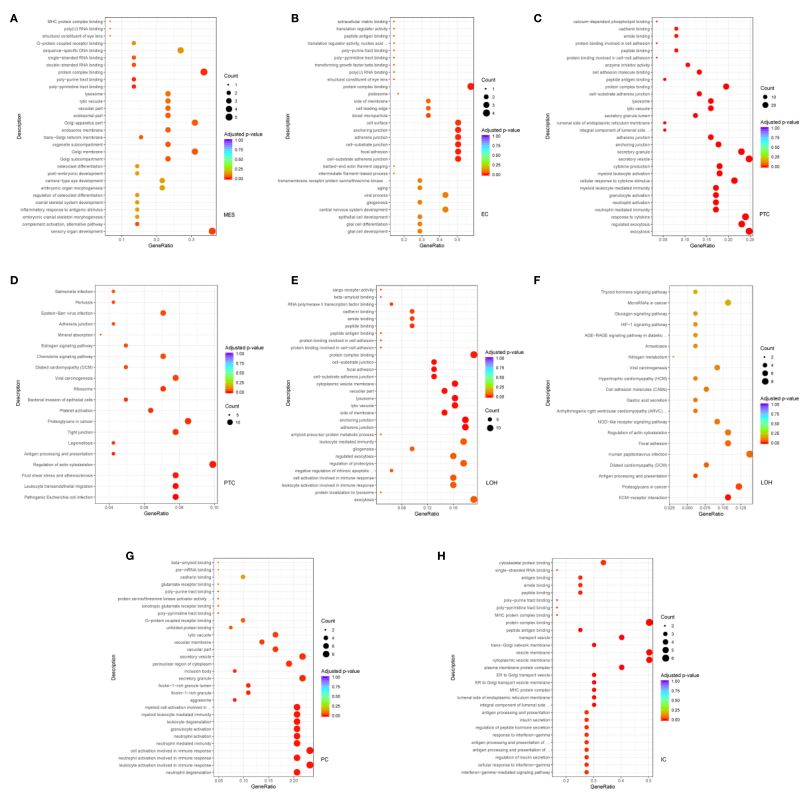
图5 与微量蛋白尿相比,显性蛋白尿的IgAN患者肾脏中参与生物学过程和细胞间信号传导的差异表达基因
结 论
本研究利用单细胞转录组揭示了IgA肾病患者的不同基因表达特征、潜在的配体-受体作用、信号通路转导,为探索IgA肾病的发病机制和治疗靶点提供了新的思路。
参 考 文 献
Rong Tang, Ting Meng,Wei Lin, et al., A Partial Picture of the Single-Cell Transcriptomics of Human IgA Nephropathy. Frontiers in Immunology (2021).








