项目文章 | 湘雅医院罗湘杭教授团队在《Cell Metabolism》发表免疫调控骨衰老的原创性成果
发布时间:2021-10-08 11:26:03
9月10日,中南大学湘雅医院内分泌科主任、内分泌研究中心主任罗湘杭教授团队在代谢研究领域顶级期刊《Cell Metabolism》(IF= 27.287)在线发表了题为“Senescent immune cells release grancalcin to promote skeletal aging”免疫调控骨衰老的原创性研究成果。中南大学湘雅医院内分泌科李长俊教授为第一作者,罗湘杭教授为通讯作者。文章利用新格元独家单细胞数据库SynEcoSys®进行单细胞公共数据的挖掘分析,通过scRNA-seq数据挖掘进一步解析了免疫调节骨衰老的细胞亚群及分子机制。
骨骼退行性疾病(如骨质疏松症)主要表现为骨量减少伴随骨髓腔脂肪堆积,目前这种失衡的具体机制尚不清楚。研究团队发现免疫衰老与骨骼退行性病变密切相关,衰老骨髓微环境中存在一群由颗粒钙蛋白(Grancalcin, GCA)阳性的巨噬细胞和中性粒细胞等构成的促炎-促衰老的免疫细胞亚群,分泌GCA促进骨衰老,巨噬细胞和中性粒细胞GCA基因敲除延缓小鼠骨衰老。并筛选出GCA的功能性受体Plxnb2,GCA通过结合Plxnb2抑制骨髓间充质基质细胞的成骨、促进成脂;进一步筛选出针对GCA的中和抗体(GCA-NAb),结果表明GCA-NAb能显著改善小鼠骨衰老表型。
骨髓中的GCA诱导骨衰老
为了确定骨髓中影响骨龄的关键衰老相关分泌表型(SASP)因子,利用质谱分析年轻(3月龄)和老年(24月龄)大鼠骨髓上清液,寻找到由中性粒细胞和单核巨噬细胞分泌的GCA,其在老年大鼠骨髓中的表达明显高于年轻大鼠,该现象在小鼠身上同样具有;接下来在小鼠骨髓内注射人RGCA或PBS来测试GCA对骨老化的影响,一系列的检测结果(RGCA组小鼠中骨小梁体积、数量和厚度较低;且成骨细胞骨形成、破骨细胞骨吸收降低和骨髓脂肪堆积增加等)表明骨髓中GCA高表达可能通过降低骨转换和促进骨髓脂肪积累来破坏骨动态平衡。
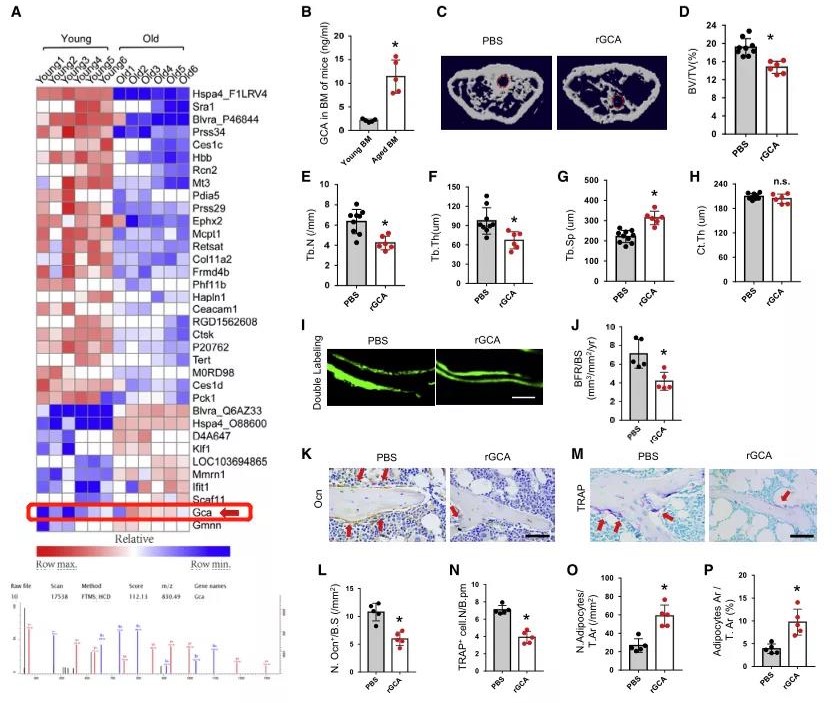
图1.骨髓中的GCA引起骨功能稳态失衡
衰老过程的骨髓积累促炎和衰老的免疫细胞并分泌大量的GCA
前期研究发现衰老骨髓中的GCA水平较高,但不清楚具体有哪些细胞都表达GCA。使用scRNA-seq数据集(来源(Ma et al., 2020)关于年轻和老年的大鼠多个组织中与衰老相关研究的文章)进行生信挖掘分析,发现年轻大鼠中GCA主要在免疫细胞表达,包括中性粒、巨噬、粒细胞-巨噬细胞前体(GMP)和B细胞,与以前的研究一致。老年大鼠中性粒和巨噬细胞(主要是M1样巨噬细胞)的GCA表达是年轻大鼠的10-15倍,而M2样巨噬、T、B和BMSCs的GCA表达没有显著差异。此外,老年大鼠骨髓中GCA+免疫细胞(包括中性粒、单核巨噬和M1样巨噬细胞)的数量和比例均高于年轻大鼠。对GCA+免疫细胞群进行功能富集分析,GO分析显示GCA+(包括巨噬和中性粒细胞)中上调的基因富集在脂多糖的反应、核分裂、染色体分离和GTPase活性中;KEGG分析表明GCA+免疫细胞中上调的基因富集在细胞周期、凋亡、p53信号通路、细胞衰老、IL-17信号通路和FoxO信号通路中,这些信号通路在炎症、衰老和肿瘤发生中起关键作用。
内毒素在衰老过程中诱导骨髓巨噬细胞活化并驱动GCA表达
进一步研究衰老过程中是什么驱使免疫细胞中GCA的表达。scRNA-seq数据前期发现GCA在中性粒和骨髓巨噬细胞中含量很高,破骨前细胞、破骨细胞中含量较低,由于GCA+中性粒细胞改变的途径较少,只有一条参与了炎症反应,因此对年轻和老年大鼠间数量和比例差异最大GCA+巨噬细胞进行下一步研究,对scRNA-seq数据库中巨噬细胞细分,发现18个亚群。第7、12和14簇在老年大鼠中含有最多的(骨髓巨噬细胞)BMMs;其包含老年大鼠的大部分GCA+BMMS,并分析第7、12和14簇中前20个差异表达基因;第7簇高表达炎症相关基因(例Cxcl2、CD14、Lilrb3a等),第12簇高表达衰老相关基因(例CDKN1A、RRM1、Smc2等),第14簇高表达癌基因(例Pececn1a、RRM1、Smc2等)。说明老年大鼠的骨髓分别含有促炎、衰老和肿瘤发生相关的骨髓巨噬细胞。由于衰老是一种典型的慢性炎症状态,上述结果表明GCA+免疫细胞是一种促炎亚型,研究炎症是否能诱导BMMS中GCA的表达。利用LPS刺激3月龄鼠的骨髓基质细胞实验发现LPS处理的骨髓基质细胞GCA表达较高;18月龄小鼠血清和骨髓上清液中的内毒素水平更高。
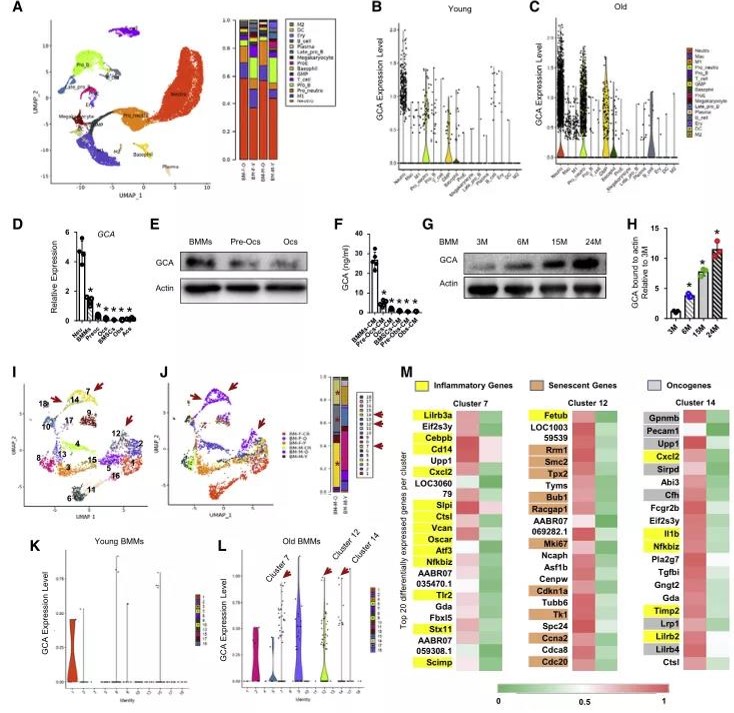
图2.衰老过程的骨髓积累促炎和衰老的免疫细胞并分泌GCA

图3. 骨髓中GCA+免疫细胞群的生信分析
接下来通过中性粒细胞和巨噬细胞GCA敲除的小鼠实验研究,发现实验组中表现出延迟的骨衰老。上述研究表明GCA对成骨、成脂和破骨细胞生成有影响。我们利用不同剂量的RGCA诱导BMSCs分化为成骨或脂肪细胞等实验及RNA-seq分析证明了GCA在促进脂肪生成的同时抑制成骨和破骨细胞生成。
为了从骨髓间充质干细胞中筛选潜在的GCA受体,对His标记的GCA孵育的BMSCs进行液相色谱-质谱(LC-MS/MS)分析。对5个候选蛋白Iqgap1、Itga11、plexin-B2(Plxnb2)、Ehd1、Lrp1进一步分析,结合RNA-seq数据将聚焦点集中Plxnb2上,接下来利用一系列的western blotting实验、siRNA干扰实验、定量磷酸蛋白质组和质谱分析等揭示Plxnb2是GCA的功能性受体,介导GCA抑制成骨和促进脂肪生成;RGCA只部分失活Plxnb2通路,如FAK(Tyr925)及其下游通路YAP和TAZ的磷酸化;下调Plxnb2可增强JAK1/3和STAT1的磷酸化。
最后通过体外细胞实验与小鼠模型体内实验表明GCA-NAb能显著改善小鼠骨衰老表型。
总 结
本次研究发现免疫调节骨衰老的细胞亚群及分子机制,提出了免疫调控骨衰老新理论,并筛选出针对关键免疫蛋白分子的中和抗体,为骨质疏松等年龄相关的疾病以及肿瘤发生、代谢紊乱和组织再生提供一种新的潜在治疗策略。
参 考 文 献
Senescent immune cells release grancalcin to promote skeletal aging
(https://doi.org/10.1016/j.cmet.2021.08.009)








