项目文章 | 单细胞转录组学揭示乳腺肿瘤进展过程中肿瘤干细胞样细胞的异质性和转录动态变化
发布时间:2021-10-28 17:59:11
乳腺癌干细胞样细胞(BCSCs)是一种罕见的肿瘤细胞亚群,具有很强的致瘤能力。一系列证据支持基底细胞癌是乳腺癌的起源。最近的研究表明,基底细胞干细胞在临床、分子和生物学上具有异质性。然而,越来越多的证据显示,基于BCSC的异质性被低估,这表明存在更多的BCSC亚群。为了研究乳腺癌肿瘤发生过程中不同细胞类型及其分子特征,复旦大学附属肿瘤医院柳素玲教授团队,陆军军医大学第一附属医院卞修武院士,联合新格元(南京)生物科技有限公司,利用单细胞转录组技术对MMTV-PyMT乳腺癌小鼠模型四个不同肿瘤进展阶段的上皮细胞和免疫细胞进行了研究,揭示了BCSCs在单细胞水平的转录和功能异质性,以及BCSCs与免疫细胞之间的相互作用。
研究结果
本研究利用新格元公司平台技术解离了W07(第7周),W09(第9周),W11(第11周)和W17(第17周)MMTV-PyMT小鼠模型乳腺样本,共获得31,778个单细胞,从增生到晚期乳腺癌阶段(癌前、癌早期和恶性阶段)。通过聚类得到的细胞类型有上皮细胞、免疫细胞和成纤维细胞。上皮细胞主要为基底上皮细胞和管腔上皮细胞,这与乳腺癌细胞特征一致。其中19599个管腔细胞聚集成6个独立的亚群(Lu1、Lu2、Lu3、Lu4、Lu5和Lu6)(图1b)。Lu2和Lu4是癌细胞,因为它们几乎是在17周晚期癌中唯一出现的,这与之前的报道一致,PyMT小鼠模型的特征与Luminal B分子亚型最为相似(图1c)。免疫细胞由T细胞亚群(包括T1和T2)、B细胞和髓细胞(包括Mye1和Mye2)组成(图1e)。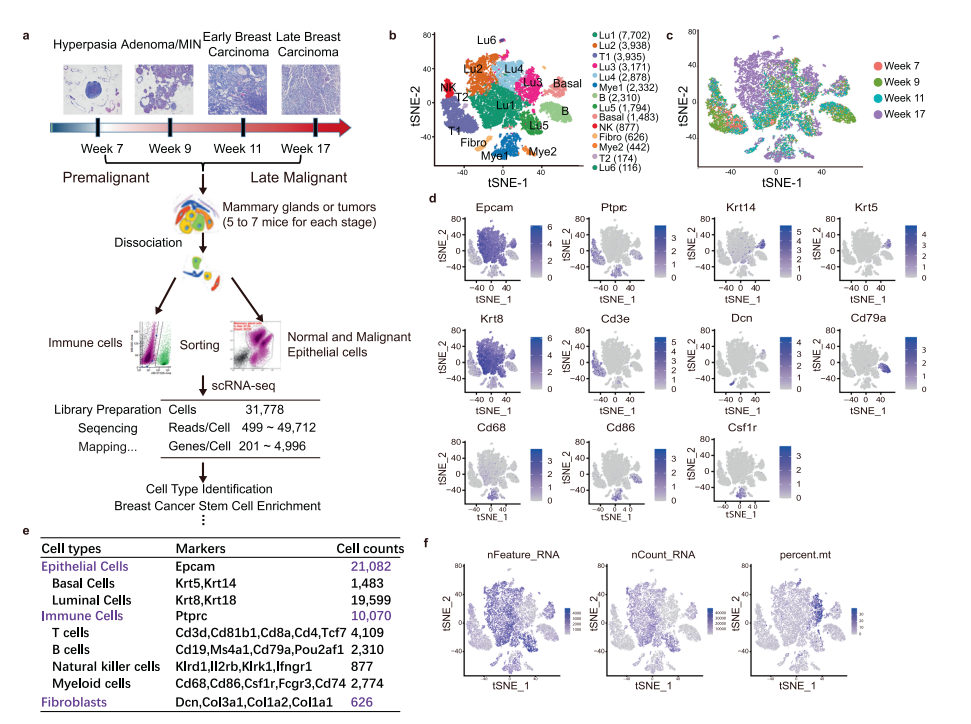
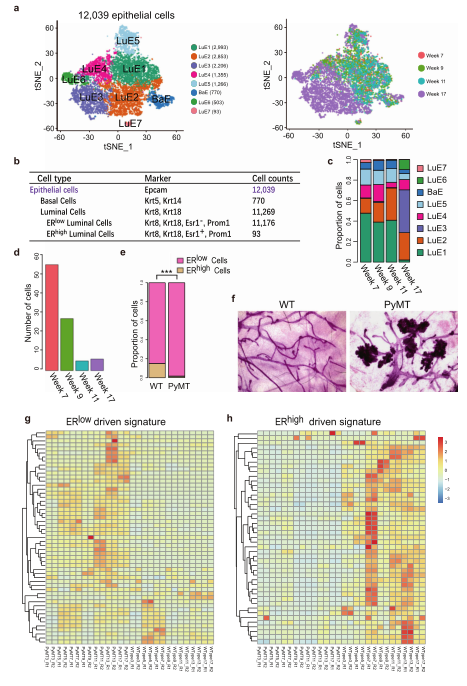
在MMTV-PyMT小鼠模型中,乳腺癌细胞来源于上皮细胞,但其来源于上皮细胞的哪个亚群以及肿瘤发生过程中的动态变化尚不清楚。因此,接下来对上皮细胞进行了重点研究,聚类分析共得到8个细胞群,主要包括7个管腔细胞LuE1, 2, 3, 4, 5, 6, 和7,和1个基底细胞簇BaE。17周时87.9%的细胞聚集在一起,形成LuE2、LuE3、LuE4和LuE6细胞簇。7,9和11周聚集在一起形成集群LuE1,LuE5, BaE, LuE7,可以看出17周的细胞与其他3个阶段形成明显差异。既往研究表明,管腔祖细胞可发育为ERlow和ERhigh管腔前体祖细胞,随后分化为肺泡腔和导管腔细胞。
接下来进一步研究细胞分布不平衡的原因,与FVB小鼠数据相比,MMTV-PyMT小鼠的ERlow细胞显著富集,而ERhigh细胞被耗尽(图2e)。因此,推测在肿瘤发生过程中,从管腔祖细胞到ERhigh管腔细胞的发育过程被阻断,MMTV-PyMT小鼠的癌细胞主要是ERlow细胞,来源于ERlow管腔祖细胞。进一步研究发现大多数ERlow信号特征在MMTV- PyMT乳腺组织中高表达,而大多数ERhigh信号特征在FVB的对应组织中高表达(图2g, h)。这与ERlow和ERhigh管腔细胞的比例分布不平衡一致。这些数据表明,ERlow细胞的增殖是MMTV-PyMT小鼠肿瘤细胞的基本来源。
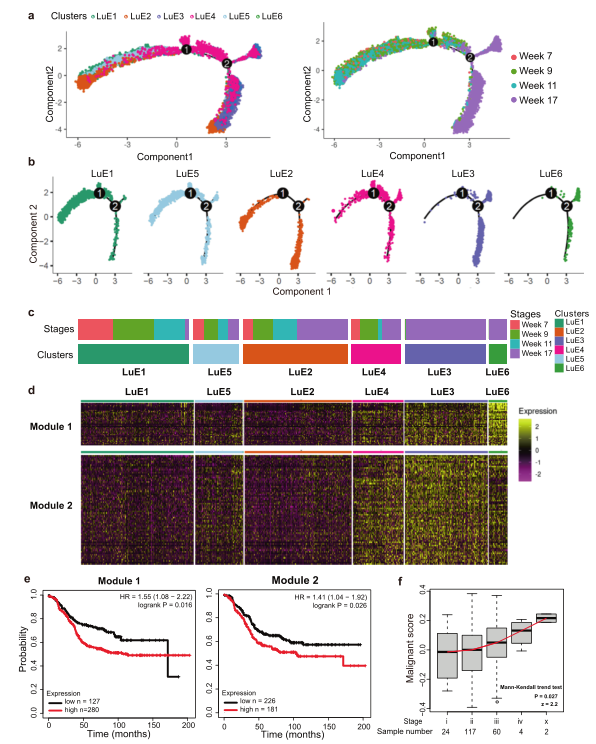
既然癌细胞来源于ERlow管腔细胞,那么这些上皮细胞在从增生到晚期癌症转变过程中如何发生变化的?为此,作者进行了拟时序分析,提示肿瘤细胞沿着LuE1、LuE5、LuE2、LuE4、LuE3和LuE6的轨迹发展。轨迹发展与17周的细胞类型百分比呈正相关。加权相关网络分析显示Luminal B乳腺癌患者的临床结局与两个基因模块存在显著相关性,且这些高表达基因的患者预后较差(图3e)。在这些基因中,有一些与肿瘤进展相关的基因,这些基因的表达在肿瘤进展中以相似的模式上调,进而合并为恶性基因,利用TCGA数据库分析发现,肿瘤级别越高,恶性基因评分显著性升高(P=0.027)(图3f)。
越来越多的证据表明,不同的实体瘤分级组织学特征,可能由不同的肿瘤干细胞样细胞(CSCs)亚群维持。接下来作者进一步描述了BCSCs的异质性。GSVA分析显示BCSC标记基因主要在LuE2上有更高的表达水平(图4a)。由于LuE2是4个肿瘤进展阶段的细胞混合物,可能同时存在正常细胞和肿瘤细胞。随着肿瘤进展,癌细胞中BCSCs的比例增加(图4e),并且与非BCSC簇相比,BCSC中上调的4个基因在MMTV-PyMT小鼠的CD24 + CD29 + 肿瘤细胞中显著上调。这与传统意义的BCSCs中一致。在肿瘤进展的最后阶段,所有干细胞样细胞中的BCSCs也富集(图4g)。
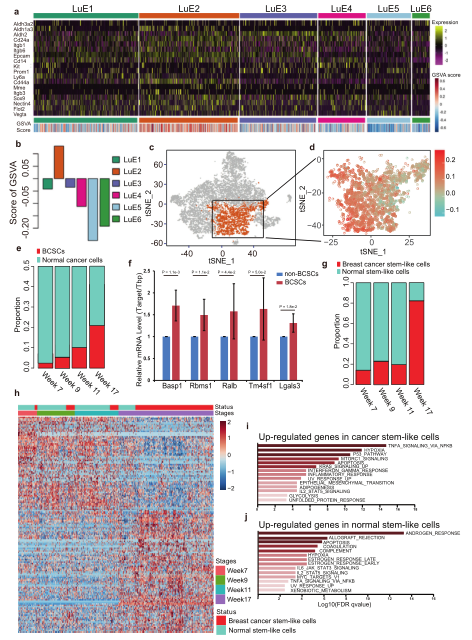
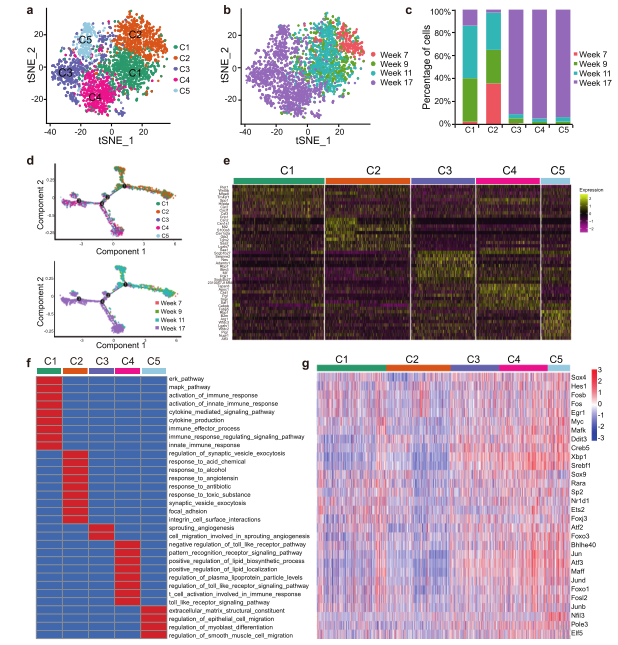
肿瘤细胞具有高度异质性,为了研究BSCSs的异质性,将LuE2分为五类C1-C5。发现在第7、9和11周为C1和C2亚簇,主要由正常的干细胞样细胞组成。而C3、C4和C5亚群几乎主要在第17周存在,主要由BCSCs组成(图5b, c)。单细胞轨迹分析提示从正常的干细胞样细胞簇到BCSC簇的可能分化。SCENIC分析发现了Sox4、Foxo3和Myc等多种转录因子在癌/正常干细胞样细胞中发挥作用,表明它们对BCSC异质性具有潜在的调控作用。
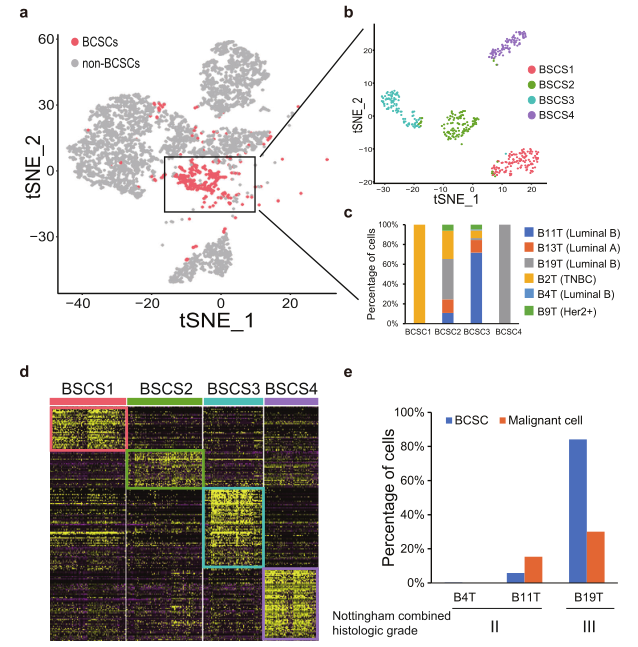
为了验证小鼠数据中观察到的BCSCs异质性,作者收集了6例乳腺癌患者的肿瘤样本,分别为Luminal A、Luminal B、TNBC和Her2+亚型,进行了单细胞分析。利用BCSC基因标志物对每个上皮细胞簇进行评分,鉴定出BCSC簇,并进一步将BCSC簇分为四个细胞群BCSC1、BCSC2、BCSC3和BCSC4(图6b)。BCSC1和BCSC4中几乎所有细胞分别来自B2T (TNBC)和B19T (Luminal B),每个BCSCs集群中的细胞表达一组特定的基因,反映了BCSCs的异质性(图6d)。进一步对三例Luminal B患者的BCSC和恶性程度进行评分, B4T/B11T患者中BCSC和恶性细胞的百分比很低/中等。相比之下,B19T患者的BCSCs和恶性细胞的百分比都很高,BCSCs和恶性细胞比例高的患者组织学评分越高,临床预后越差。
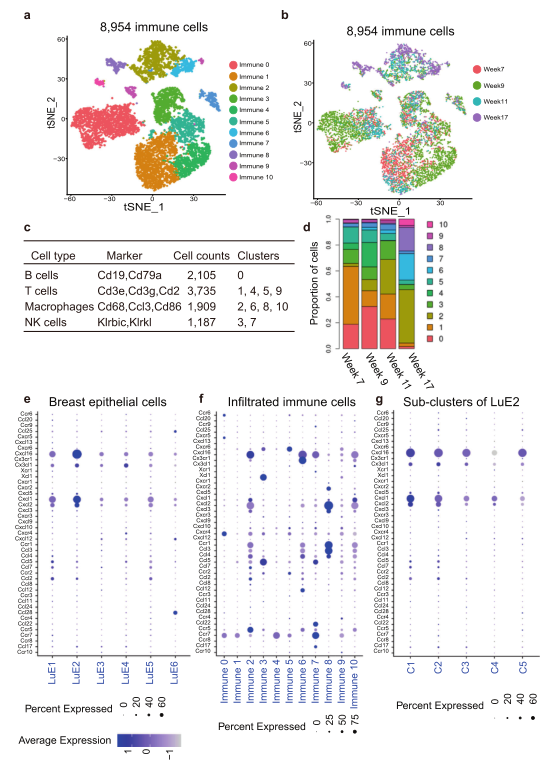
最后作者分析了BCSC和免疫细胞之间的相互作用关系,发现肿瘤干细胞样细胞簇LuE2分泌特异性细胞因子Cxcl16和Cxcl1。BCSCs在5个亚簇中分泌不同水平的细胞因子,并通过免疫细胞上的相应受体发挥作用,促进肿瘤进展;同时,揭示了BCSC群体的动态变化,其中免疫细胞类型T、B和NK细胞的比例随肿瘤进展而下降,巨噬细胞的比例增加,可能与BCSCs的存活有关。
结 论
本文利用乳腺癌小鼠模型MMTV-PyMT,构建了来自肿瘤进展四个不同阶段(增生、腺瘤/MIN、早期癌和晚期癌)的单细胞图谱。研究发现ERlow上皮细胞类型引起肿瘤,ERhigh上皮细胞的分化被阻断。此外,还发现在ERlow上皮细胞中存在干细胞样细胞簇,可区分为正常和肿瘤干细胞样细胞,并在恶性转变过程中分析了从正常干细胞样细胞到肿瘤干细胞样细胞的分子差异。最后,还发现BCSCs和免疫细胞存在细胞因子及其相应细胞因子受体的特异性表达模式,为阐明BCSC异质性和乳腺肿瘤进展过程中的免疫细胞重塑提供了有用的资源,并在单细胞水平上揭示了进展过程中的转录动力学。
参 考 文 献
Jiang G, Tu J, Zhou L, et al. Single-cell transcriptomics reveal the heterogeneity and dynamic of cancer stem-like cells during breast tumor progression. Cell Death Dis. 2021 Oct 21;12(11):979.








