项目文章|局部微波消融对乳腺癌患者外周免疫反应的影响
发布时间:2022-04-25 13:27:23
近日,南京医科大学第一附属医院乳腺外科王水教授团队在国际知名期刊《Advanced Science》(IF=16.806)在线发表了题为“Landscape of the Peripheral Immune Response Induced by Local Microwave Ablation in Patients with Breast Cancer”的研究论文。该研究阐明了MWA(微波消融)诱导的全身免疫反应的全局特征,并为识别潜在靶点以改善免疫反应铺平了道路。
新格元在该研究中承担了单细胞转录组测序、分析等工作,利用新格元自主研发的Singleron Matrix®自动化单细胞测序文库构建系统完成文库构建,CeleScope™生信分析软件及SynEcoSys®单细胞数据库完成专业的生物信息挖掘和精确的细胞类型注释。
研究背景
由于筛查技术的发展,更多的早期乳腺癌患者被诊断出来。由于全身治疗的进步,这些患者的生存率明显提高。然而,仍有部分患者出现转移性疾病,尤其是三阴性乳腺癌(TNBC),仍有必要进一步提高早期乳腺癌的生存率。微创疗法,包括射频消融(RFA)、微波消融(MWA)、冷冻疗法、高强度聚焦超声和激光疗法等,已被尝试用于治疗早期乳腺癌。先前研究表明消融治疗乳腺癌完全消融率很高,部分研究报道了其良好的长期疗效。
此外,实体瘤热消融后的免疫反应已在临床前和临床研究中报道。原位肿瘤消融可以产生抗原,并且这些肿瘤特异性抗原由树突状细胞(DC)和巨噬细胞呈递给淋巴细胞。在RFA治疗实体瘤后,大多数报道发现适应性免疫反应较弱。作为一种有效的局部治疗方法,消融治疗可能是抗肿瘤免疫的触发因素,其与免疫疗法的结合可能是治疗早期乳腺癌的一种有前景的策略。
鉴于其本身的优势,MWA已被报道用于治疗早期乳腺癌,具有很高的完全消融率。有趣的是,与手术诱导的全身炎症和免疫抑制微环境不同,MWA治疗乳腺癌会诱导Th1型免疫反应和激活NK细胞。但是,目前热消融诱导免疫反应的全貌尚未被报道。
单细胞RNA测序(scRNA-seq)允许以前所未有的方式全面分析免疫系统,为免疫治疗提供潜在靶点。为了寻找MWA诱导的免疫反应在早期乳腺癌治疗中的关键细胞亚群和潜在机制,作者应用scRNA-seq全面表征了6名患者MWA前后外周血单个核细胞(PBMC)的免疫反应。
研究结果
1.单细胞实验设计及大群分群结果
作者收集了6名早期乳腺癌患者MWA治疗前后一周的外周血,并进行了scRNA-seq。在这6名患者中,3名为ER+/HER2-亚型,2名为HER2+,1名为TNBC。最终,获得了82,473个细胞的转录组谱。
作者对细胞进行分群后共发现3种细胞大群:T&NK cells、B cells以及Myeloid cells(图一A)。MWA后患者外周血NK细胞和T细胞比例增加,髓系细胞比例降低,B细胞水平较MWA前稳定(图1B)。重要的是,大多数患者表现出由MWA诱导的相同变化规律(图1B),包括3例luminal病例和1例HER2阳性病例,NK和T细胞比例增加。
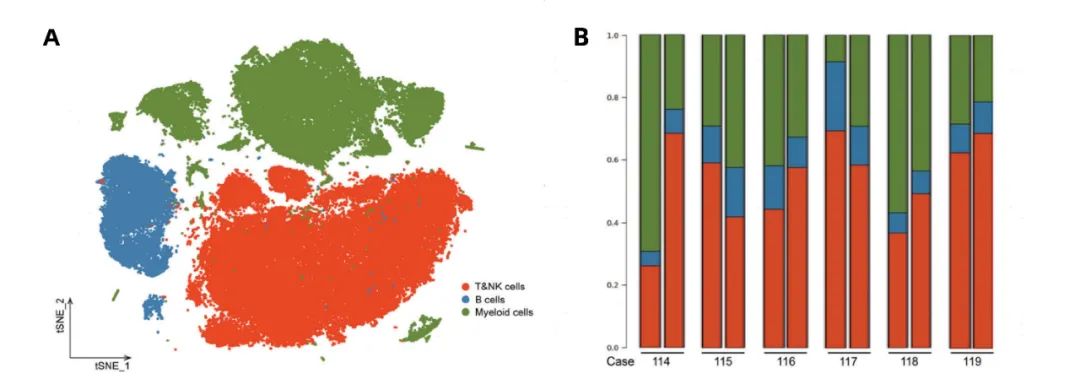
图1
2.MWA诱导活化外周NK细胞
因为先天免疫是抵御癌症的第一道防线,NK细胞是先天免疫系统的效应淋巴细胞,提供针对癌症的瞬时保护。所以作者首先对T&NK细胞进行了更全面的研究,对T&NK细胞进行了亚群细分后共得到了8个亚群,其中包括3个NK细胞簇和5个T细胞簇(图2A)。
对于NK细胞,确定了3个簇,包括GZMB+NK细胞(NK_c1)、KIR2DL1+NK细胞(NK_c2)和XCL2+NK细胞(NK_c3)。
NK_c1以GZMB、GNLY、PRF1、KLRD1、SPON2和FCER1G的高表达为特征,表明具有高细胞毒活性。NK_c2特异性表达杀伤细胞免疫球蛋白样受体KIRs,包括KIR2DL1、KIR2DS4和KIR3DL1。而NK_c3特异表达XCL2和XCL1。MWA后,患者GZMB+NK细胞的比例增加,但未观察到显著差异(图2B)。
与MWA前相比,GO富集分析表明,MWA后的XCL2+NK细胞特异性富集在细胞因子产生、淋巴细胞分化和T细胞活化等通路(图2C),表明MWA诱导了XCL2+NK细胞更强的趋化因子功能。
此外,MWA后的GZMB+NK细胞中毒性相关基因(IFITM1、MYOM2、JUN、IFITM3、CCL4和RBM25)表达上调,表明MWA诱导了GZMB+NK细胞更高的细胞毒活性(图2D)。
为了进一步探究NK细胞的细胞毒性功能在MWA前后的差异,作者进行了细胞毒性基因集合的AUC打分分析。作者发现MWA后NK细胞的细胞毒功能明显高于MWA前(图2E),尤其是GZMB+NK细胞和KIR2DL1+NK细胞。

图2
3.MWA激活外周CD8+T细胞
T细胞共鉴定出5个簇,包括CCR7+CD4+T细胞(CD4_c1)、CD82+CD4+T细胞(CD4_c2)、CAMK4+CD4+T细胞(CD4_c3)、GZMK+CD8+T细胞(CD8_c1)和GZMH+CD8+T细胞(CD8_c2)(图2A)。
CD8+T淋巴细胞是细胞介导的抗肿瘤免疫反应中最有效的杀手。为了确定MWA诱导的T细胞反应,作者比较了MWA前后的外周CD8+T细胞反应。MWA后,患者GZMK+CD8+T细胞和GZMH+CD8+T细胞的比例增加,但并未达到显著。
差异基因分析发现:对于GZMK+CD8+T细胞簇,MWA诱导CCL4、TXNIP、PRDM1、IFITM1、LYAR和SRP72的上调,表明其趋化因子活性增加(图3A)。而GZMH+CD8+T细胞中治疗后诱导了细胞毒基因的上调,包括IFITM1、TRGC2、GZMB、CCL4、IFITM3、RBM25、GZMH和NKG7等基因。对MWA前后的T细胞进行基因集AUC打分分析发现:MWA后CD8+T细胞的Naive评分明显低于MWA前,激活评分显著增加,主要在GZMH+CD8+T细胞中(图3B)。重要的是,两个CD8+T细胞簇的细胞毒功能显著高于治疗之前(图3C)。这些结果表明,早期乳腺癌的MWA增强了外周CD8+T细胞的细胞毒活性和趋化因子功能。
之前的研究报道:共抑制分子PD-1在T细胞激活后被诱导。因此,MWA诱导的活化CD8+T细胞可能会表现出抑制特性。于是,作者进一步探究了MWA前后CD8+T细胞的抑制特性的差异。MWA后,几个抑制基因的mRNA水平似乎在两个CD8+T细胞簇中都增加了,尤其是对于PDCD1(图4A)。为了进一步确定CD8+T细胞的抑制表型,通过AUC分析后发现,在MWA之后,CD8+T细胞的抑制特征表达略微显著增加,在GZMK+CD8+T细胞中有显著差异(图3D)。
以前的研究表明,CD8+T细胞显示出从早期效应“过渡”到终末分化、功能失调的T细胞状态的持续进展,并且这种功能失调的终末CD8+T细胞还表现出高耗竭的标志物和受损的IFN-γ分泌功能。在本研究中,作者发现MWA后两个CD8+T细胞簇中IFNG的平均mRNA表达水平增加(图4A),MWA后CD8+T细胞中的IFNG+CD8+T细胞的百分比比较与MWA前并没有显著差异(图3E)。上述结果表明,由乳腺癌MWA激活的外周CD8+T细胞显示出增加的抑制特征,但没有更多的功能障碍,增加的抑制特性并不代表耗尽的表型。
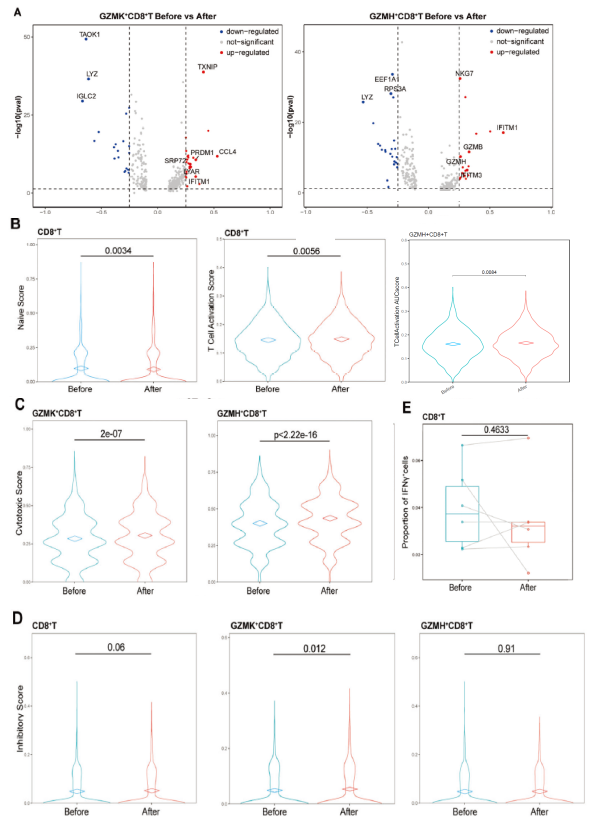
图3
4.MWA后外周CD4+T细胞的增强共刺激特征
适应性免疫反应需要CD4+T细胞的参与。先前的研究表明早期CD4+T细胞活化是由热消融诱导的。为了充分研究MWA诱导的CD4+T细胞反应,鉴定了三个CD4+T细胞簇。CD4_c1细胞特异性表达幼稚标记基因,例如CCR7和LEF1。CD4_c2以共刺激分子ICOS、CD82以及抑制凋亡基因BIRC3的高表达为特征,被命名为CD82+CD4+T细胞,在之前的研究中也称为LTB+CD4+T细胞。CD4_c3中CCR7和TCF7高表达,也特异表达RCAN3和CAMK4,两者都参与钙依赖性信号通路,其可能在T细胞共刺激中很重要。MWA后,患者CD82+CD4+T细胞的比例增加,但没有显著差异(图2B)。
早期T细胞活化需要由T细胞受体(TCR)介导的抗原特异性信号以及额外的共刺激信号。共刺激基因ICOS、SLAMF1和TNFRSF25在CD4+T细胞中表达,并且这些基因的水平在MWA后增加(图4A)。为了进一步研究MWA后CD4+T细胞的转录状态,作者进行AUC分析后发现:CD4+与MWA之前相比,MWA后外周血中的T细胞显示出共刺激特征的表达增加,主要在CD82+CD4+T细胞和CCR7+CD4+T细胞中(图4B)。负共刺激分子CTLA-4在CD82+CD4+T细胞中高表达,MWA后表达水平降低(图4A)。这些结果表明,乳腺癌的MWA诱导了CD4+T细胞的共刺激特征增加,特别是在CD82+CD4+T细胞中。

图4
5.MWA后外周血T细胞克隆性扩增
MWA可能产生肿瘤抗原,从而增加T细胞TCR多样性。因此作者从7名患者MWA前后的外周T细胞中分离的RNA进行Bulk TCR测序进行验证。计算外周血中每个个体T细胞克隆的治疗前/治疗后丰度变化。在这7例样本中,在阈值设置为≥1的情况下,有6例在MWA后出现T细胞的扩增,在阈值设置为10、100或1000的情况下,也观察到了类似的结果(图5A)。
作者比较了乳腺癌MWA前和MWA后的外周TCR多样性。在这7例患者中,通过rarefaction分析,6例患者MWA后的估计多样性高于MWA前(图5B)。
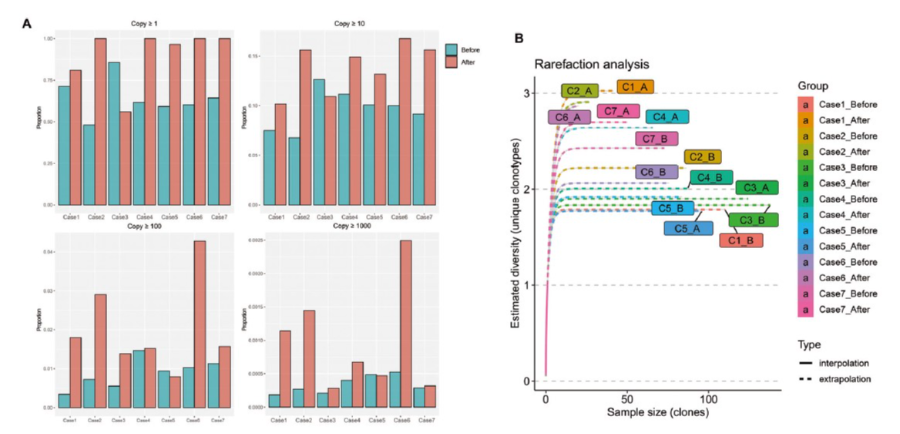
图5
6.髓系细胞亚群中抗原呈递活性弱增强
原位肿瘤消融可以产生肿瘤抗原,这些抗原由APC,特别是专业APC,包括DC和巨噬细胞呈递给T细胞。为了确定哪种类型的APC在MWA诱导的免疫反应中起核心作用,作者确定了外周单核细胞和DC细胞转录特征的变化。
重新聚集髓系细胞并确定了12种不同的细胞类型(图6A):三个经典单核细胞簇(M1-3)、两个非经典单核细胞簇(M4、M5)、血小板(M6)、DC(M7)、pDC(M8)、嗜碱性粒细胞(M9)和三个中性粒细胞簇(M10、M11、M12)。与MWA前相比,所有单核细胞簇的比例均有所下降,但无显著差异,而MWA后两个DC簇的比例均稳定(图6B)。
中性粒细胞是血液中主要的白细胞,是宿主抵抗病原体的第一道防线,在本研究中,中性粒细胞被MWA激活。进一步分析发现,单核细胞和DC高表达与适应性免疫反应途径相关的基因(图6C)。在这些单核细胞和DC簇中,没有抗原呈递相关通路被乳腺癌的MWA激活。只有一种主要的组织相容性复合物(MHC)-II分子HLA-DRB5在四个单核细胞簇(M1、M2、M4和M5)和DC中MWA后显著增加,可能表明MHC-II抗原呈递的活性弱增强由MWA引起(图6D)。

图6
7.B细胞亚群中激活的抗原受体介导的信号通路
B细胞除了具有产生抗体的功能外,还可以进行抗原呈递,将抗原呈递给CD4+T细胞。作者猜测B细胞可能是主要的APC,启动由MWA诱导的CD4+T细胞反应。
B细分一共细分了5个群:TCL1A+B细胞(B1);CLECL1+B细胞(B2);浆细胞(B3);CD14+B细胞(B4);和IL4R+B细胞(B5)(图7A)。
与MWA前相比,MWA后除CD14+B细胞比例降低外,每个B细胞簇的比例保持稳定(图7B)。GO富集分析表明MWA后的TCL1A+B细胞和CLECL1+B细胞特异性富集了B细胞激活通路、抗原受体介导的信号通路和免疫反应激活细胞表面受体信号通路(图7C,D)。此外,MWA之后,与淋巴细胞增殖、单核细胞增殖、白细胞增殖和淋巴细胞活化途径相关的通路也在B1簇中富集(图7C)。
此外,MWA后观察到MHC-II(B1簇中的HLA-DQA2、HLA-DRB6、HLA-DQA1和HLA-DMB;B2簇中的HLA-DRB1和HLA-DRB6)的表达显著增加(图7E)。然后通过计算抗原加工和呈递分数发现:MWA后TCL1A+B细胞和CLECL1+B细胞抗原呈递评分较MWA前明显增加(图7E),说明MWA诱导的B1和B2中MHC-II抗原呈递能力增强簇,但不在其他B细胞簇中。此外,MWA后外周血中的浆细胞显示与抗体产生相关的基因表达增加,表明浆细胞显示MWA诱导的抗体产生能力也有所增加。所有这些结果表明,B细胞被乳腺癌的MWA激活,具有激活的抗原受体介导的信号通路。
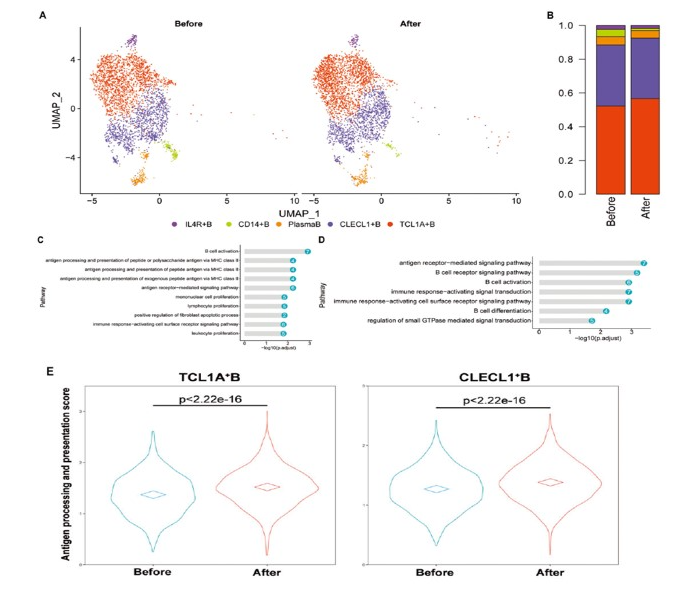
图7
8.细胞间通讯有助于CD4+T细胞免疫反应
为了探究细胞间的相互左右,作者进行了互作分析后发现:与MWA之前相比,MWA后外周血中CD4+T细胞与B细胞或CD4+T细胞之间的相互作用对更多(图8A)。具体而言,观察到CD4+T细胞与B细胞或CD4+T细胞之间的粘附作用互作对SELL-SELLPG和细胞毒性相关互作对KLRB1-CLEC2D增强(图8B)。
此外,还发现MWA可增强CD4+T细胞和B细胞之间与抗原受体信号传导相关的互作对,比如:PTPRC-CD22(图8B)。
DC是最有效的专业APC,在MHCI类和II类分子的情况下将抗原呈递给CD8+和CD4+T细胞。在这里,发现MWA后外周血中DC和T细胞之间的相互作用比MWA前更多(图8A)。具体而言,观察到MWA诱导的外周血中DC和CD4+T细胞之间增强的LTBR-LTB、LGALS9-SORL1和ICAM1-SPN互作对(图8C)。此外,MWA后发现DCs和CD8+T细胞之间的TNFRSF1B-GRN、ICAM1-ITGAL、ICAM1-aLb2复合物和ICAM1-SPN相互作用增强(图8C)。
最重要的是,发现MWA诱导了B细胞和CD4+T细胞之间增强的相互作用,这被另一种方法CellChat验证,表明B细胞是启动CD4+T细胞的重要APC。MWA诱导的免疫反应。

图8
9.消融后免疫反应特征的验证
为了确认scRNA-seq结果,作者对25名患者的PBMC,通过流式细胞术富集了相关的T和NK细胞进行了分析验证。MWA后CD8+T细胞和NK细胞的外周频率没有明显高于MWA前,而MWA后CD4+T细胞的频率显著增加(p=0.030,图9A)。然后,进一步对共刺激CD4+T细胞亚群进行了验证(图9B,C),MWA后CD82+CD4+T细胞的频率增加,但差异略显著(p=0.068)。重要的是,MWA后ICOS+CD4+T细胞的外周频率显著高于MWA前(p=0.026)。PD-1是肿瘤相关抗原特异性T细胞的标志物。PD-1+CD8+T细胞的频率在MWA后呈增加趋势,无显著差异。
不同亚型的免疫细胞协同形成抗肿瘤免疫反应。根据上述结果,确定了不同免疫细胞之间的关系(图9D)。CD4+T细胞水平升高与CD8+T细胞水平呈正相关,但与NK细胞水平呈负相关。此外,ICOS+CD4+T细胞水平升高与PD-1+CD8+T细胞水平呈正相关(图9E),表明CD4和CD8+T细胞免疫反应可能与MWA诱导的抗原释放有关。有趣的是,CD82+CD4+T细胞水平升高与ICOS+CD4+T细胞水平呈正相关(图9F),表明CD82可能是CD4+T细胞的另一个共刺激标志物。
10.免疫检查点抑制剂协同激活消融后的T细胞
MWA诱导的CD4+T细胞的共刺激特征显著增加,并且CTLA-4在本研究中在外周CD4+T细胞中高表达。CTLA-4阻断可以为共刺激通路提供额外的信号。将MWA前后7名患者的PBMC用于进一步实验验证。体外实验表明,MWA后KN044(CTLA-4抑制剂)培养的PBMCs中ICOS+CD4+T细胞的比例显著高于MWA前的PBMC(p=0.021,图9G)。此外,该组显示出最高比例的ICOS+CD8+T细胞,与MWA之前的PBMC相比有显著差异(p=0.026,图9G)。
此外,乳腺癌MWA诱导的活化CD8+T细胞的抑制特征(包括PD-1和其他耗尽基因)增加。作为一种共抑制分子,PD-1的阻断可导致T细胞功能重振和有效的抗肿瘤反应。作者发现,与MWA之前的PBMC相比,在MWA之后,camrelizumab(PD-1抑制剂)培养的PBMC显示出更高比例的CD8+T细胞(p=0.018,图9H)。重要的是,与MWA前的PBMC相比,在MWA后camrelizumab培养的PBMC中观察到活化的CD69+CD8+T细胞的百分比显著更高(p=0.001,图9H)。以上结果表明MWA后的外周T细胞在体外被免疫检查点抑制剂协同激活。
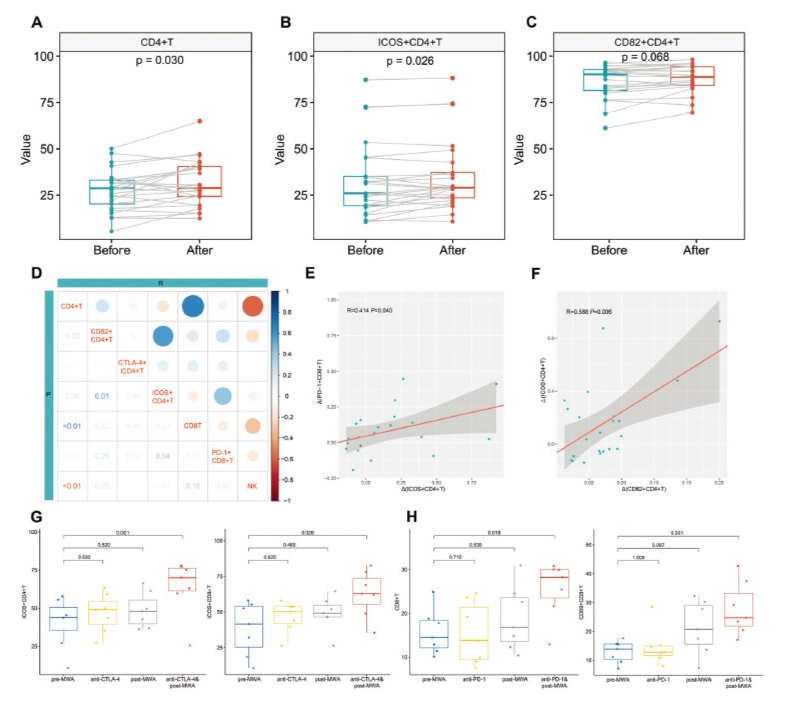
图9
结论
该研究提供了MWA诱导的全身免疫反应的全局特征,并报告了相应的分子特征。此外,作者发现B细胞是参与MWA诱导的免疫反应的重要APC。最重要的是,目前的研究为识别潜在靶标以改善MWA对乳腺癌的免疫反应铺平了道路。
参考文献
Zhou W, Yu M, Mao X, Pan H, Tang X, Wang J, Che N, Xie H, Ling L, Zhao Y, Liu X, Wang C, Zhang K, Qiu W, Ding Q, Wang S. Landscape of the Peripheral Immune Response Induced by Local Microwave Ablation in Patients with Breast Cancer. Adv Sci (Weinh). 2022 Apr 11:e2200033. doi: 10.1002/advs.202200033. Epub ahead of print. PMID: 35403824.








