项目文章 || 纵向分析揭示了感染SARS-CoV-2的恒河猴肺和肠道组织中不同的免疫反应景观
发布时间:2022-06-15 10:07:28
SARS-CoV-2已在全球迅速传播,全球确诊病例数超过5亿,累计死亡人数达到620万。疫苗的快速发展有助于减少重症COVID-19病例的数量,但仍然缺乏针对COVID-19患者的特异性抗病毒治疗和有效控制病毒传播,尤其是当我们面临越来越多由SARS-CoV-2变体引起的突破性感染波时。在这种情况下,有必要进一步探索病毒感染模式并系统地提高我们对宿主免疫反应机制的理解,以有效控制这一流行病。
为此,中国医学科学院医学生物研究所刘龙丁老师课题组以恒河猴为研究对象,在感染后3、7和10天纵向收集了恒河猴的小肠和肺组织,利用新格元GEXSCOPE®单细胞转录组建库试剂盒进行单细胞转录组测序,并由新格元提供生信分析支持,生成了组织对SARS-CoV-2感染的反应概况。
GEXSCOPE®单细胞转录组建库试剂盒可完成从样本保存(仅限Tissue Kit)、单细胞制备(仅限Tissue Kit)、单细胞分选至测序文库构建全部流程。GEXSCOPE®单细胞转录组建库试剂盒包括组织保存液(仅限Tissue Kit),组织解离液(仅限Tissue Kit),微流控微孔芯片,分子标签磁珠,扩增试剂及文库构建试剂。本产品可高效无偏好性地完成反转录、cDNA扩增及文库构建,显著提高测序文库产物得率及同等测序深度下的基因检出率,从而完成对数百至数万个细胞中的mRNA进行测序。手工版试剂盒无需仪器辅助,手工即可完成单细胞文库构建全流程,使用灵活,操作简单,可在P3实验室完成单细胞实验,助力老师们病毒感染相关的研究。
主要结果
1)应对SARS-CoV-2感染期间肺和肠道中的不同单细胞图谱
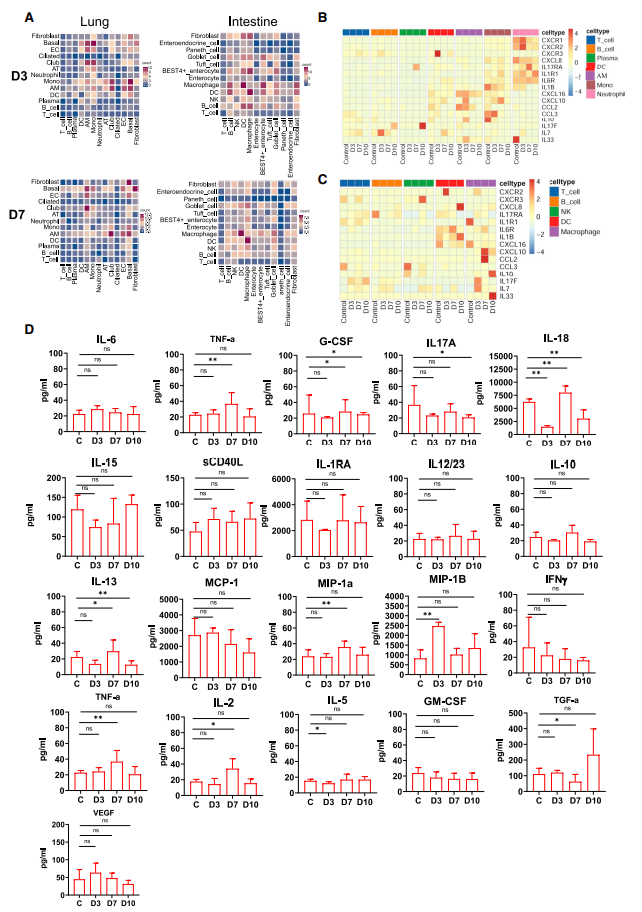
肺组织中获得了32504个细胞,分为13个细胞群(图1B)。肠道组织中获得了76549个细胞,分为12个细胞群(图1G)。主要细胞类型有T细胞、B细胞、单核细胞/巨噬细胞、树突细胞 (DC)、自然杀伤 (NK) 细胞和组织细胞。
在肺组织中,肺泡巨噬细胞 (AM) 数量在3 dpi时显著减少,表明肺中的AMs促进了SARS-CoV-2感染。从3到10 dpi,肺中肺泡上皮细胞 (ATs) 和内皮细胞 (ECs) 的纵向增加,可能有助于肺泡或间质病变的进展,并伴有中性粒细胞和单核细胞浸润。相比之下,肠上皮细胞 (IEC) 在3 dpi时减少,但在7和10 dpi时迅速恢复,表明病毒感染对绒毛上皮细胞有轻微影响。除巨噬细胞外,从3 dpi到10 dpi,肠道组织中NK细胞和DCs减少。与对照组相比,感染期间肺组织中T细胞和B细胞的比例持续增加,而肠组织中T和B细胞的比例在3-7 dpi时增加,随后在10 dpi时逐渐减少。


2)肠道组织中的T细胞表明在SARS-CoV-2感染的早期和中期阶段激活了抗病毒免疫反应
肺组织中的T细胞分为三个亚群:效应T细胞(Teff)、幼稚T细胞或中枢记忆T细胞(Naïve T or Tcm)和组织驻留记忆T细胞(Trm)。感染SARS-CoV-2后,肺组织中Trm细胞的比例仅在10 dpi时略有增加,Tcm在中期(7 dpi)和晚期(10 dpi)增加,而Teff减少。表明它们参与促进炎症。
肠组织中的T细胞包括Naïve T or Tcm,CD8 Teff和滤泡辅助性T细胞(Tfh)。在SARS-CoV-2感染的早期和中期观察到肠道中Naïve T or Tcm和Tfh细胞活化,可能与肠道相关淋巴组织 (GALT) 或肠道区域淋巴结的组织有关。表明T细胞在3-7 dpi时被激活并在10 dpi时被抑制。

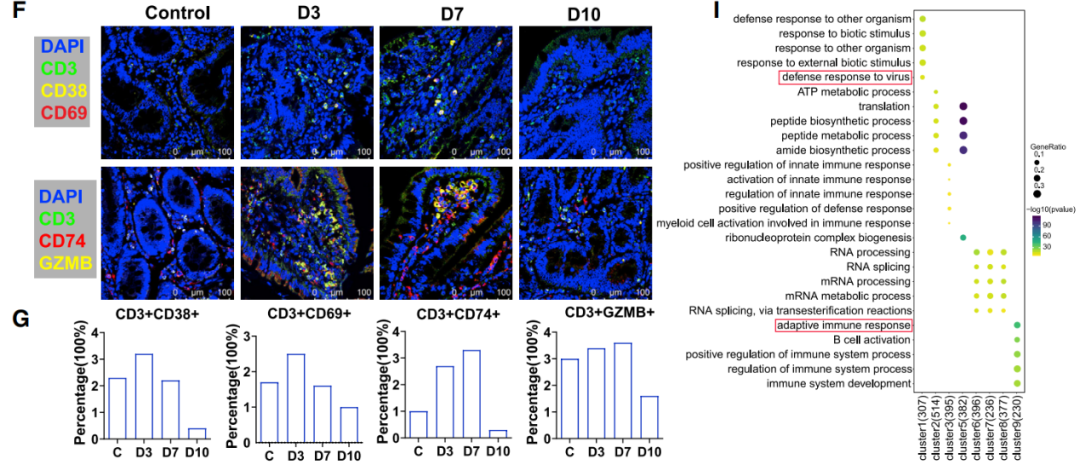

3)SARS-CoV-2感染导致B细胞和Paneth细胞在肠道内积聚,这与炎症反应减弱和组织损伤有关
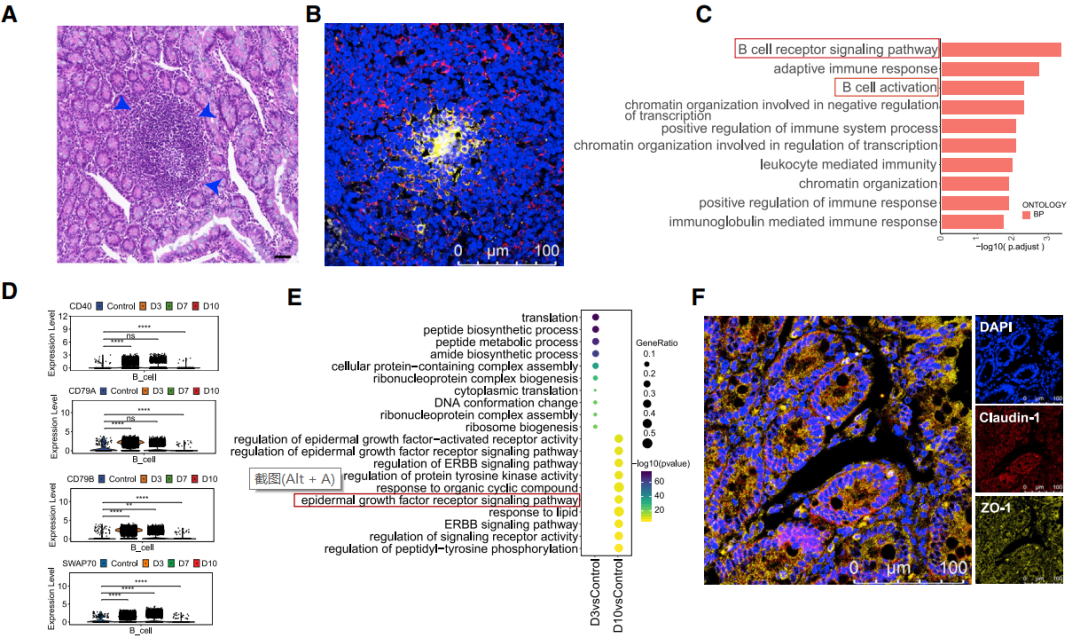
“B细胞受体信号通路”和“B细胞活化”通路在3 dpi时在肠道组织的B细胞中富集。代表性B细胞活化相关基因CD40、CD79A、CD79B和SWA70的表达水平在3-7 dpi时增加,“表皮生长因子受体信号相关通路”在10 dpi时在肠上皮细胞中富集。免疫荧光分析显示紧密连接(TJ)相关蛋白,包括ZO-1和claudin-1在10 dpi时高表达,表明肠上皮屏障修复发生在感染的最后阶段。Paneth细胞在7-10 dpi增加,主要的炎症基因包括IL1B、IL6、CXCL10、IL10和NLRP3在3 dpi和7 dpi时在来自肠道的Paneth细胞中被激活,在10 dpi时没有被激活。结果表明,Paneth细胞和B细胞在肠上皮的正常损伤修复机制和肠道炎症发挥重要作用。
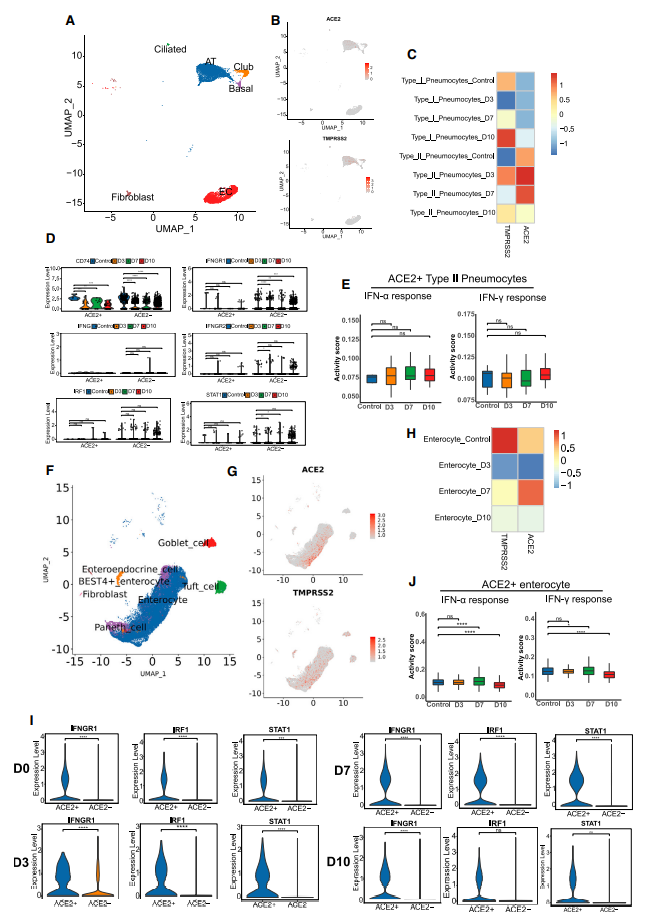
4)ACE2和TMPRSS2在肠上皮细胞中富集,其中IFN相关基因被激活
除免疫细胞外,组织细胞在SARS-CoV-2感染后的免疫反应中也发挥着重要作用。ACE2和TMPRSS2主要在II型ATs中表达,ACE2的表达在3-7 dpi达到峰值。与CD74、IFNG、IFNGR1、IFNGR2、STAT1和IRF1被调节为IFN-γ反应基因的其他II型ATs相比,ACE2+II型ATs仅显示CD74活化,表明肺中有限的IFN-γ抗病毒免疫反应。
与肺组织相反,ACE2和TMPRSS2基因在多种肠组织细胞中广泛表达,包括肠细胞、簇细胞、杯状细胞、潘氏细胞、BEST4+肠细胞和肠内分泌细胞。ACE2表达从3到7 dpi呈上升趋势,而TMPRSS2水平在感染期间下降。肠细胞的IFN-γ相关基因,包括IFNGR1、STAT1和IRF1,在3-7 dpi时在ACE2+肠细胞中被激活,这表明对IFN-γ的免疫反应在感染早期和中期被激活。IFN-α和IFN-γ诱导的基因模块在ACE2+肠细胞中均在7 dpi时显著上调,在10 dpi时显著下调。因此,ACE2+肠细胞是SARS-CoV-2的主要靶标。最后阶段对IFN途径的抑制可能有助于解释晚期肠道病毒脱落的症状。
5)肺和肠组织中炎症分子的特征
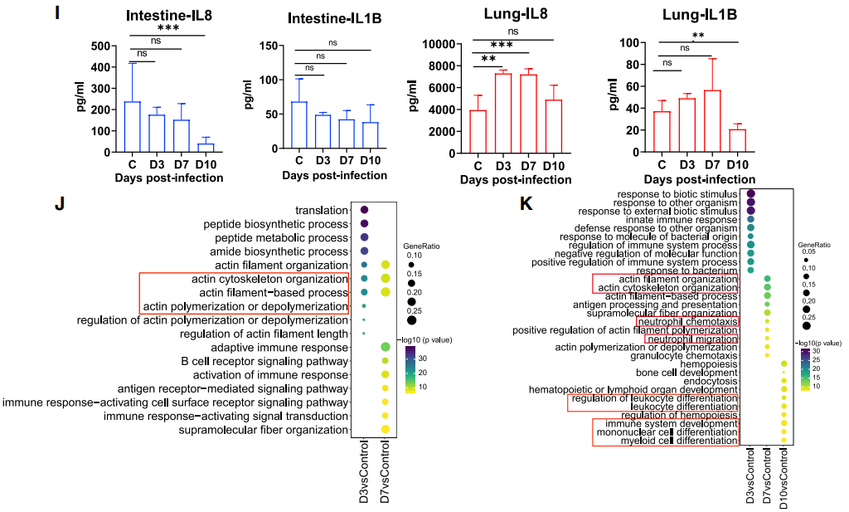
AMs在整个感染期间(3-10 dpi)表现出与ECs和AT细胞的强烈相互作用,表明这些细胞之间的相互作用与抗病毒免疫反应有关。在肠道内3和7 dpi时巨噬细胞与DC强烈相互作用。比较了趋化因子和细胞因子在肺和肠中的表达。在肺中,编码趋化因子和炎性细胞因子的基因从3到10 dpi上调。CXCR1、CXCR2、IL17RA、ILR1和IL6R等基因主要在肺中性粒细胞上观察到。此外,CXCL10和CXCL16主要在3-7 dpi的AMs和单核细胞中表达。
在肠中炎症因子基因主要来自肠内的DC、巨噬细胞和成纤维细胞。细胞因子流式珠测定表明,促炎细胞因子(IL6、TNF-α、G-CSF、IL17A、IL18、IL15、sCD40 L、IL1RA和IL12/23)、抗炎因子(IL10)、趋化因子(IL13、MCP-1 [CCL2]、MIP-1a[CCL3]和MIP-1B[CCL4])和适应性免疫反应细胞因子(IFN-γ、TNF-α、IL-2、IL-5、GM-CSF)和与肠上皮和内皮稳态相关的细胞因子(VEGF,TGF-a)在感染末期(10 dpi)显著降低或无明显变化。如上所述,肠黏膜在感染晚期表现出较少的炎症状态。
结论
1、肺和肠道在COVID-19中表现出不同的免疫反应景观;
2、肠上皮细胞在感染的早期降低;
3、B细胞和Paneth细胞的聚集与炎症抑制有关;
4、肠道黏膜免疫抑制与肠道病毒脱落相关;
参考文献
Zheng H, Chen Y, Li J, Li H, Zhao X, Li J, Yang F, Li Y, Liu C, Qin L, Zuo Y, Zhang Q, He Z, Shi H, Li Q, Liu L. Longitudinal analyses reveal distinct immune response landscapes in lung and intestinal tissues from SARS-CoV-2-infected rhesus macaques. Cell Rep. 2022 May 24;39(8):110864. doi: 10.1016/j.celrep.2022.110864. Epub 2022 May 8. PMID: 35594870; PMCID: PMC9080054.








