项目文章 | 单细胞测序揭示人类胎儿脊柱发育景观
发布时间:2022-08-09 11:26:32
发表期刊:iScience
发表单位:深圳市人民医院戴勇教授团队
用到的分析方法:单细胞转录组(GEXSCOPE®)测序、单细胞ATAC测序以及生信分析等
2022年6月,深圳市人民医院戴勇教授团队在期刊iScience发表了题目为“Integrated single-cell analyses decode the developmental landscape of the human fetal spine”的研究成果,该研究对妊娠8~17周(w)的流产胎儿脊柱样本进行单细胞转录和单细胞ATAC测序,系统剖析了人类胎儿脊柱的细胞特征和分子调控,并揭示胎儿脊柱发育早期的转录调控。
新格元在该研究中承担了单细胞转录组(GEXSCOPE®)测序、单细胞ATAC测序以及生信分析等工作,利用新格元自主研发的Singleron Matrix®自动化单细胞文库构建系统完成文库构建,CeleScope®生信分析软件进行质控并生成表达矩阵,并通过SynEcoSys®单细胞数据库完成精准的细胞注释和专业的生物信息挖掘。

图1 研究思路
研究背景
脊柱在支撑体重以及身体和大脑之间传递神经元件等方面发挥着重要作用,脊柱早期发育的缺陷可能导致神经管缺陷和椎骨肋骨的畸形。人体脊柱起源于妊娠第3w和第4w,此时囊胚发育成原肠胚,由外胚层、中胚层和内胚层组成,虽然已有研究对中胚层祖细胞和神经外胚层祖细胞的分化和发育提供了见解,但是仍然缺乏对妊娠早期和中期细胞类型及其发育特征的详细了解,特别是关于成纤维细胞、软骨细胞和神经元的异质性及其免疫环境。
研究结果
1、人类胎儿脊柱细胞图谱
作者收集了8w、10w、11w和17w流产胎儿的脊柱样本进行scRNA-seq,同时对8w、10w和17w的样本进行scATAC-seq。使用scRNA-seq捕获了16746个细胞并鉴定了26种细胞亚群,包括造血谱系细胞、祖细胞、神经细胞、成骨细胞和基质细胞。使用scATAC-seq捕获了4848个细胞并鉴定了18种细胞亚群,总体而言scRNA-seq和scATAC-seq鉴定的细胞类型是一致的。
妊娠第4w时由神经外胚层祖细胞组成的神经管发育,从中胚层细胞衍生的纤维环出现,形成椎体、韧带和终板。作者在妊娠8w时观察到神经细胞和成纤维细胞的存在,且成纤维细胞是胎儿脊柱的主要细胞类型,与前人研究中成纤维细胞在促进成骨中的作用吻合。
在妊娠3w~4w时髓核从脊索发育而来,后续每一个椎骨都将在第9w和第14w之间开始骨化,本研究结果表明第10w和11w软骨细胞比例非常高,与前人文献研究结果一致。在第17w时造血谱系细胞开始占优势,与文献中造血细胞分别在11w和第20w产生并增殖结果一致。值得一提的是,在妊娠第8w检测到巨噬细胞,巨噬细胞属于造血细胞,这一结果表明早期巨噬细胞是从肝脏等器官迁移而不是从骨髓迁移的。
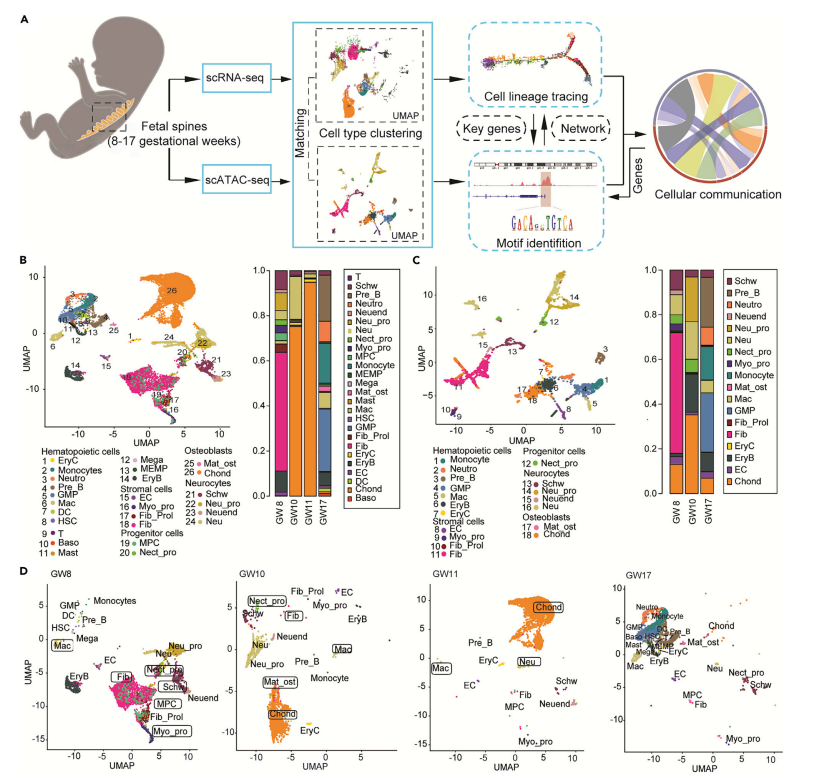
图2 胎儿脊柱细胞图谱
2、成纤维细胞异质性和发育谱系
为了阐明成纤维细胞的异质性,作者将成纤维细胞再进行无监督分群,分为13个亚群。通过亚群特异性表达的基因进行命名,如2群命名为PAX1+HOXA7+成纤维细胞,4群命名为HIST1H1A+COL2A1–成纤维细胞,12群命名为EPYC+HAPLN1+成纤维细胞,9群命名为NEB+PAX7+成纤维细胞。通过GSVA分析发现9群富含肌肉器官发育的基因,2群和12群富含软骨细胞分化途径相关的基因,4群可能在核染色体分离中活跃并高表达FBXO5和NUSAP1,以上结果证明不同成纤维细胞亚群在骨骼形成和脊髓保护上具有不同的作用。
为了深入了解成纤维细胞的发育过程,作者对成纤维细胞亚群进行轨迹分析。前人研究认为成纤维细胞是由中胚层祖细胞(MPC)发育而来,所以作者将MPC与成纤维细胞亚群一起进行slingshot轨迹分析,轨迹表明MPC可能分化为HIST1H1A+COL2A1–成纤维细胞(4群),并进一步扩展到具有多个发育分支的其他亚群。IFI44L+OGN–成纤维细胞(7群)、LAMA2+CYP1B1–成纤维细胞(10群)、EPYC+HAPLN1–成纤维细胞(12群)和DLK1+APOA1–成纤维细胞(13群)位于轨迹末端,因此推测成纤维细胞4群分化潜能更高。为了验证此假设,作者对成纤维细胞亚群进行SLICE熵的干性评分,与轨迹分析结果一致,成纤维细胞4群熵的干性评分比轨迹末端的成纤维细胞12、13群更高。值得注意的是,轨迹分析显示脊髓成纤维细胞在第8w时就完成了分化。
为进一步探索驱动HIST1H1A+COL2A1–成纤维细胞(4群)分化成其他成纤维细胞亚群的关键基因,作者将各成纤维细胞亚群的基因取交集,挑选随轨迹分化表达发生变化的基因,发现第8w时TUBB基因在HIST1H1A+COL2A1–成纤维细胞(4群)中高度表达。众所周知,成纤维细胞中TUBB编码β-微管蛋白,并在发育中的CNS中广泛表达,所以推测TUBB可能是驱动胎儿脊柱HIST1H1A+COL2A1–成纤维细胞(4群)发育的基因。另外作者还在TUBB中发现了一个可访问的转录起始位点(TSS)区域,通过scATAC-seq分析发现该区域可与转录因子HOXA10结合。
前人研究表明HOX家族中的转录因子在分化中起重要作用,如本研究结果所示,HOXA10及其靶基因TUBB在HIST1H1A+COL2A1–成纤维细胞中高度表达。这一结果表明TUBB可能是促进HIST1H1A+COL2A1–成纤维细胞(4群)分化为UBE2C+DLGAP5–成纤维细胞(5群)的关键基因。通过FN1和COLIA1免疫荧光染色,证明了成纤维细胞在第8w时存在,并且成纤维细胞分布在脊髓周围,说明成纤维细胞对脊髓具有保护作用。

图3 成纤维细胞异质性分析及发育谱系
3、软骨细胞异质性和发育追踪
软骨细胞是脊柱的重要组成部分,有助于支撑体重。为了研究软骨细胞异质性,作者将软骨细胞进一步细分为12个亚群。通过亚群特异性表达的基因进行命名,如1群命名为TAOK1+HBB-软骨细胞,5群命名为ASPN+KI67-软骨细胞,第10w大部分软骨细胞为软骨细胞1群和5群。第11w大部分软骨细胞为HSPA1A+CXCL3-软骨细胞(2群)和MTTV+LGALS1-软骨细胞(3群)。通过功能富集分析发现软骨细胞分化通路主要在软骨细胞5群中富集,且高表达COL12A1和COL6A1。参与骨化和骨矿化以及软骨内骨形态发生的基因在MEF2C+COMP+软骨细胞(7群)中富集,以上结果揭示了软骨细胞的异质性。
软骨细胞和成纤维细胞都是从中胚层祖细胞发育而来的,且成纤维细胞可分化为软骨细胞,因此作者将中胚层祖细胞、成纤维细胞亚群以及软骨细胞亚群放在一起进行轨迹分析。从轨迹中发现EPYC+HAPLN1–成纤维细胞(12群)可能是分化成软骨细胞的关键细胞,此外参与软骨分化的基因MATN4、ACAN、COL2A1、COL11A1和SOX9在EPYC+HAPLN1–成纤维细胞(12群)中富集。ASPN+KI67-软骨细胞(5群)是位于软骨细胞分化轨迹的起始,MTTV+LGALS1-软骨细胞(3群)、MEF2C+COMP+软骨细胞(7群)位于软骨分化轨迹的末端。通过SLICE熵的干性分析证明了软骨细胞5群分化潜能高于软骨细胞3群。通过EPYC和HAPLN1免疫荧光染色,验证了EPYC+HAPLN1–成纤维细胞(12群)的存在。EPYC、HAPLN1、SOX9和MANT4的进一步共定位说明EPYC+HAPLN1+成纤维细胞(12群)可能通过高表达SOX9和MANT4分化为软骨细胞。值得注意的是,scRNA-seq第8w时几乎没有捕获到软骨细胞,但是对第8w的脊柱进行免疫荧光染色能发现软骨细胞,可能的原因是由于样本异质性,用于免疫荧光染色的脊柱比scRNA-seq的脊柱更老。此外,第8w脊柱中软骨细胞比例较低也可能导致scRNA-seq没有检测到软骨细胞。
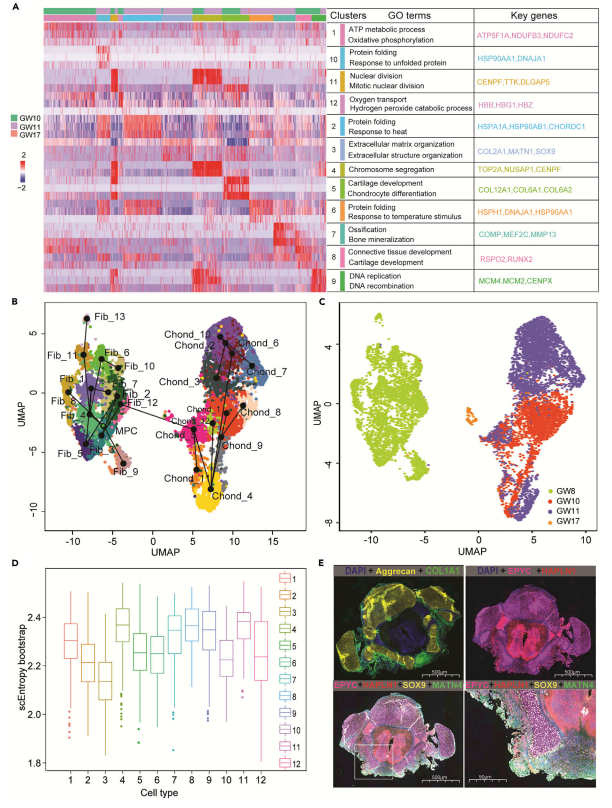
图4 软骨细胞异质性分析及发育追踪
4、探寻“神经外胚层祖细胞—神经内分泌细胞—神经元”新轨迹
本研究共检测到5种神经细胞,为了解析它们在发育过程中的关系,将神经细胞进行拟时序分析,共发现2个轨迹。在妊娠第8w和第11w时,从神经外胚层祖细胞分化为神经祖细胞再发育成神经元细胞。在第8w~17w时,神经外胚层祖细胞向雪旺细胞发育。前人研究表明,几乎所有的内分泌细胞都来源于内胚层和神经外胚层,作者研究结果证明,脊髓神经内分泌细胞来源于妊娠早期的神经外胚层细胞,并且还观察到神经内分泌细胞可以根据轨迹分化成神经元。
为了进一步解释“神经外胚层祖细胞—神经内分泌细胞—神经元”这一潜在的新轨迹,作者从文献中筛选到与促进神经外胚层祖细胞分化为神经元细胞相关的重要基因,并最终锁定了SOX3、THF和GPM6A。SOX3是一种保守的转录因子,可标记人类胚胎干细胞衍生的和小鼠新生儿和成年神经祖细胞的特定阶段,并参与神经干细胞的维持,作者在轨迹中发现了27个上调的SOX3基因,并发现14个基因包括TUBA1C、SLC2A1和RGMA,它们在神经外胚层祖细胞分化中是保守的。SOX3上调的HOXB-AS3和LBR仅参与“神经外胚层祖细胞—神经内分泌细胞—神经元”的轨迹,提示它们可能是促进神经外胚层祖细胞向神经内分泌细胞选择性分化的关键基因。此外,神经内分泌细胞中的TH可能是一种协同基因,通过富集转录因子Islet1(ISL1)的上调促进神经外胚层祖细胞最终分化为神经元。据报道,ISL1在连接感觉和脊髓基因调控程序的感觉神经元发育中发挥了核心作用。Cicero分析显示TH调控序列的活性较高。此外,GPM6A可能是一个重要的靶基因,它通过富集的转录因子PBX3上调帮助神经内分泌细胞分化成神经元。已知PBX3可增加HOX蛋白的DNA结合/转录活性并调节参与发育的基因。此外,本文scATAC-seq数据也证实了PBX3结合位点的开放性。有趣的是,根据Cicero分析结果发现源自神经祖细胞的神经元的分化可能是由ENO2驱动的,它高度活跃并参与神经分化。
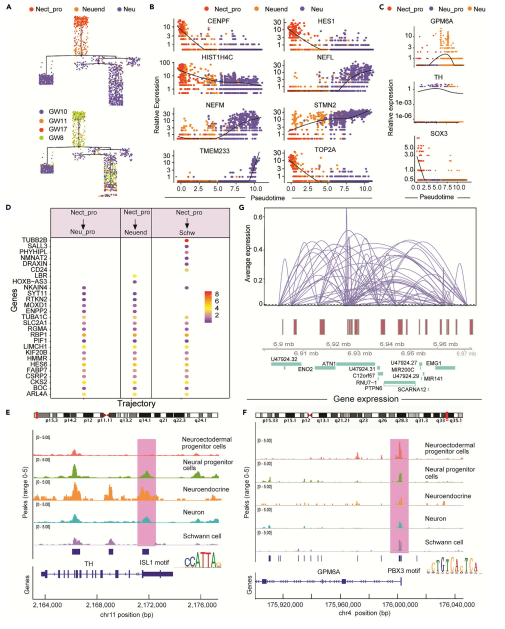
图5 神经细胞发育追踪
5、刻画神经元细胞发育谱系
为了研究神经元异质性,作者对984个神经元细胞进行无监督分群,共分为9个亚群。通过GSVA分析发现不同亚群功能的异质性,PMEL+PAPPA2+神经元(7群)、NR2F1+NR2F2+神经元(8群)和LIX1+SLIT3+神经元(9群)富集到神经元投射和分化命运的通路。众所周知,NR2F1缺陷是导致Bosch-Boonstra视神经萎缩综合征(BBOAS)的原因,说明神经元8群在神经发育中起着至关重要的作用。MAB21L2+TAOK1+神经元(1群)和ASS1+HES6+神经元(6群)参与分解代谢过程,包括蛋白质定位和氧转运。TAOK1与神经元成熟相关,表明神经元1群对神经元成熟至关重要。NPPA+CST3+神经元(2群)、NEUROD6+LHX1+神经元(5群)、PCP4+BCAS1+神经元(3群)和TMEM233+PIEZO2+神经元(4群)参与神经元分化和胚胎器官形态发生。据报道,NEUROD6在小鼠新生儿期诱导神经元终末分化,本研究再次证明了NEUROD6在胚胎脊髓形态发生中起诱导神经元分化的作用。
神经元可能源自神经内分泌细胞以及神经祖细胞,所以作者将这2种细胞与神经元细胞亚群一起进行轨迹分析,分析发现PMEL+PAPPA2+神经元(7群)、NR2F1+NR2F2+神经元(8群)和LIX1+SLIT3+神经元(9群)来源于妊娠8w的神经祖细胞,而其他神经元来自分化后期(8-17w)的神经内分泌细胞。先前的一项研究在小鼠脊髓上进行了scRNA-seq,显示运动神经元(MN)是早期发育阶段(E9.5和E10.5)最突出的神经元类别,因此我们推出妊娠第8w的大部分神经元是MN。MAB21L2+TAOK1+神经元(1群)位于分化轨迹末端,SLICE熵的干性分析验证表明神经元1群干性较低。通过对脊柱切片中的NEFM和CD56进行免疫荧光分析,证实了神经元从组织中心到周围区域的分布以进行信号传导。
MEIS2是脑室下区(SVZ)嗅球神经源系统中进行神经元分化的先决条件。研究结果表示,MEIS2在神经外胚层祖细胞发育成神经元细胞的过程中被上调,且在PMEL+PAPPA2+神经元(7群)、NR2F1+NR2F2+神经元(8群)和LIX1+SLIT3+神经元(9群)中显著高表达,相反,我们没有观察到MEIS2在ASS1+HES6+神经元(6群)、NEUROD6+LHX1+神经元(5群)、MAB21L2+TAOK1+神经元(1群)、NPPA+CST3+神经元(2群)、PCP4+BCAS1+神经元(3群)和TMEM233+PIEZO2+神经元(4群)中显著表达。因此,我们推测MEIS2可能是驱动脊髓神经祖细胞选择性分化为神经元的重要转录因子。此外,它还可能导致在孕早期形成PMEL+PAPPA2+神经元(7群)、NR2F1+NR2F2+神经元(8群)和LIX1+SLIT3+神经元(9群),调节多巴胺能神经元的分化。scATAC-seq数据显示MEIS2的结合位点是开放的。此外,scRNA-seq分析结果显示LIX1中有35个靶基因如SLIT3可由MEIS2调节的神经元显著上调。据报道靶基因ANXA2、ME1和UCHL1在神经元分化中起重要作用。作者发现ANXA2、ME1和UCHL1在LIX1+SLIT3+神经元(9群)中被MEIS2上调,表明ANXA2、ME1和UCHL1在与MEIS2结合后可能有助于脊柱中PMEL+PAPPA2+神经元(7群)的形成。免疫荧光分析显示CD56、ME1和UCHL1共定位,表明ME1和UCHL1与早期神经元发育高度相关。
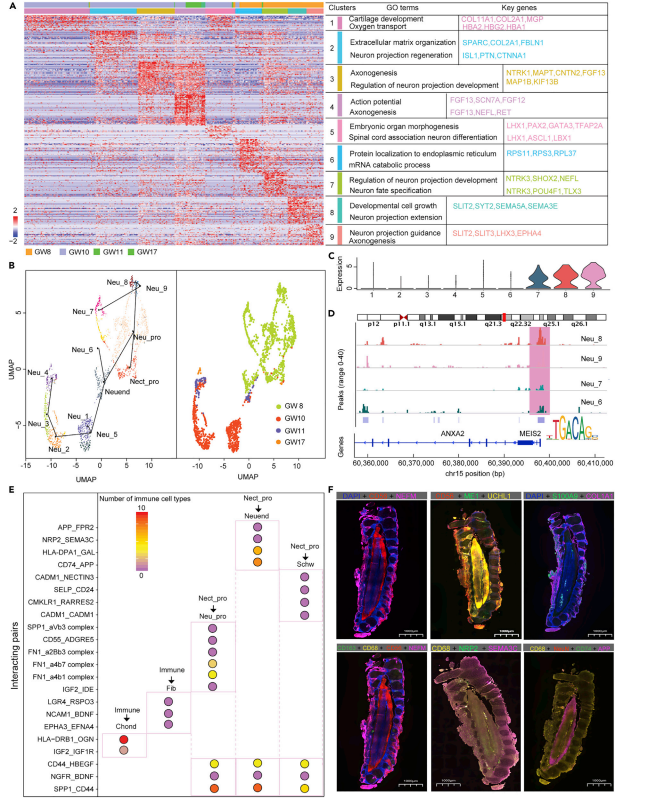
图6 神经元细胞异质性分析及发育谱系
6、胎儿脊柱免疫微环境与细胞间相互作用
脊柱发育过程中的免疫微环境较为复杂,本研究发现妊娠17w时免疫细胞相较于其他时间占比较高,粒细胞-单核细胞祖细胞、前体B细胞和单核细胞分别占总细胞的27.54%、20.46%和17.62%。粒细胞-单核细胞祖细胞是最主要的细胞群,与先前小鼠中的研究结果一致,粒细胞-单核细胞祖细胞可促进免疫细胞分化和增殖。在妊娠第8w时观察到巨噬细胞,其数量随胚胎发育逐渐减少,17w时开始增殖,表明免疫微环境是在妊娠早期形成的,有循环的免疫细胞。
免疫细胞与非免疫细胞交流是发挥生物活性所必需的,所以作者通过Cellphone DB分析细胞间的相互作用。共获得66个受体-配体对,主要在5个主要分化轨迹中发挥作用。SPP1_CD44在妊娠第11w和第17w时表现出高强度互作,且在所有三个神经外胚层祖细胞分化过程中都存在,表明其作为神经外胚层祖细胞分化的典型标志物起作用。在免疫细胞和成纤维细胞亚群之间观察到EPHA3_EFNA4和LGR4_RSPO3互作,都与小鼠肌肉干细胞形成和hASC分化相关,这些互作可能是成纤维细胞分化的关键。此外,作者对脊柱切片S100A9和COLIA1的免疫荧光分析证实了粒细胞-单核细胞祖细胞与成纤维细胞的潜在相互作用。IGF2_IGF1R可能对维持软骨细胞存活至关重要,因为IGF1和IGF2的自分泌刺激在体外介导软骨细胞存活。在神经外胚层祖细胞分化过程中NR2F1+NR2F2+神经元(8群)的SEMA3C与巨噬细胞中的NRP2相互作用,由于NRP2_SEMA3C可以促进树突状细胞迁移,所以作者推测该相互作用可驱动循环巨噬细胞在妊娠早期诱导脊髓神经元生长。同时CD68、CD163、NEFM、CD56、SEMA3C和NRP2的免疫荧光分析显示SEMA3C和NRP2共存,表明巨噬细胞可能通过NRP2_SEMA3C相互作用促进早期神经元生长。从第8w到第17w,巨噬细胞与神经元之间的CD74_APP相互作用也增加,仅参与“神经外胚层祖细胞—神经内分泌细胞—神经元”轨迹发育。据报道CD74和APP之间的相互作用可能是巨噬细胞驱动神经元亚群发育和多样化的一种方式。免疫荧光分析证实了CD68、NeuN、CD74和APP在脊柱切片上的共定位,表明CD74与APP存在潜在的相互作用。在“神经外胚层祖细胞-雪旺细胞”轨迹的过程中,SELP_CD24相互作用似乎在雪旺细胞的激活中起作用。CADM1_NECTIN3可能有助于雪旺细胞与巨核细胞的附着。众所周知在免疫环境形成中起关键作用的CMKLR1_RARRES2的相互作用也在作者研究中也观察到。综上所述,免疫细胞在脊柱神经细胞的发生和分化中起重要作用。
结论
本研究整合了人类胎儿脊柱发育不同发育阶段scRNA-seq和scATAC-seq数据,以单细胞分辨率解码了妊娠早期和中期人类脊柱发育的蓝图,为未来脊柱相关疾病的研究打下了夯实的基础。
参考文献
Integrated single-cell analyses decode the developmental landscape of the human fetal spine. iScience.2022








