项目文章 | 新格元助力揭示肺癌混合磨玻璃结节不同成分的肿瘤微环境特征
发布时间:2022-08-15 15:26:38
湘雅二医院胸外科主任喻风雷主任课题组于近期在《Frontiers in Immunology》发表的“Single-Cell RNA Sequencing Unravels Distinct Tumor Microenvironment of Different Components of Lung Adenocarcinoma Featured as Mixed Ground-Glass Opacity”文章。
早期肺腺癌(LUAD)的放射学特征之一是肺磨玻璃样阴影(GGO),根据是否存在实性成分(S),GGO分为纯GGO(pGGO)和混合GGO(mGGO),前者由磨玻璃(GG)成分组成,后者包含GG成分又包含S成分。现在普遍认为,mGGO比pGGO为特征的肺癌更可能引起疾病进展,另外S成分比例增加会导致预后不良,加上GGO对PD-1/PD-L1治疗的反应有限,意味着GGO和晚期肺癌之间的免疫微环境不同。本文通过解析mGGO中S和GG成分之间的不同微环境模式,为浸润前(GG)与浸润性病灶(S)之间的转化过程提供了关键分子机制。
【用到的技术与数据库】:
新格元组织保存液、新格元组织解离试剂、GEXSCOPE单细胞建库试剂盒、SynEcoSys数据库、CeleScope生信软件
【用到的单细胞分析】:
数据质控、降维聚类、细胞类型注释、差异基因与功能富集分析、inferCNV分析、cNMF分析、拟时轨迹分析、RNA速率分析、熵的干性分析、细胞通讯分析
研究思路
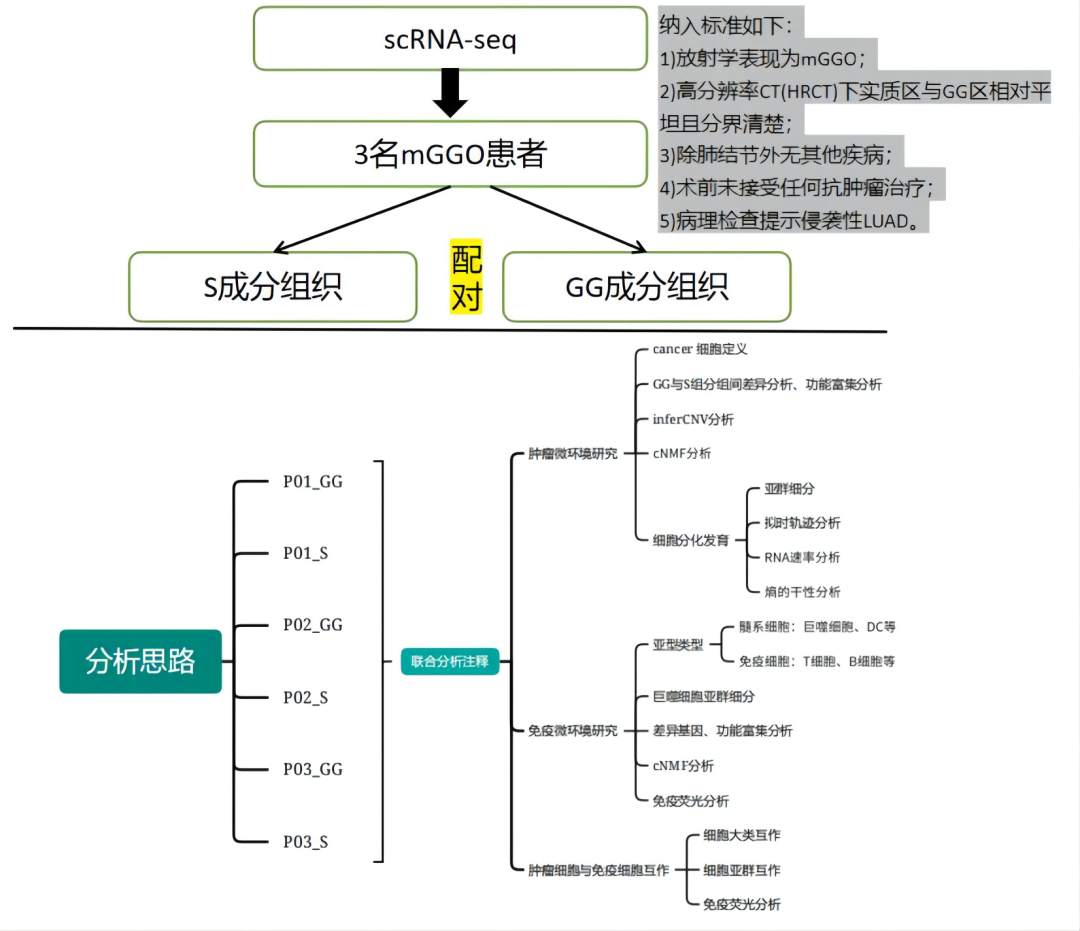
研究结果
1、GG与S成分的单细胞测序景观
从三名被诊断为侵袭性腺癌(IAC)患者身上分离的共获得19,391个细胞(GG组分8,635个,S组分10,392个),所有细胞分成9种主要细胞类型,分别为癌细胞、巨噬细胞、树突状细胞(DC)、T、B、浆、肥大、club细胞和纤毛细胞。还发现一个标记为增殖性髓系细胞,它由巨噬和DC组成,其中S组分的比例略高于GG;mGGO中最丰富的细胞是巨噬和癌细胞,分别占GG和S成分样本的近50%,这一点经免疫荧光染色进行了证实,说明可能这两种细胞的活动是解开mGGO发展机制的关键;同时证实DC是第三种主要的细胞类型。淋巴细胞在所有样本中的比例约为5%,以CD8+T和浆细胞为主,表明激活了获得性免疫反应。另外在S组分中,上皮细胞类型主要由癌细胞组成,而在GG组分中保留一定数量的正常club细胞和纤毛细胞。
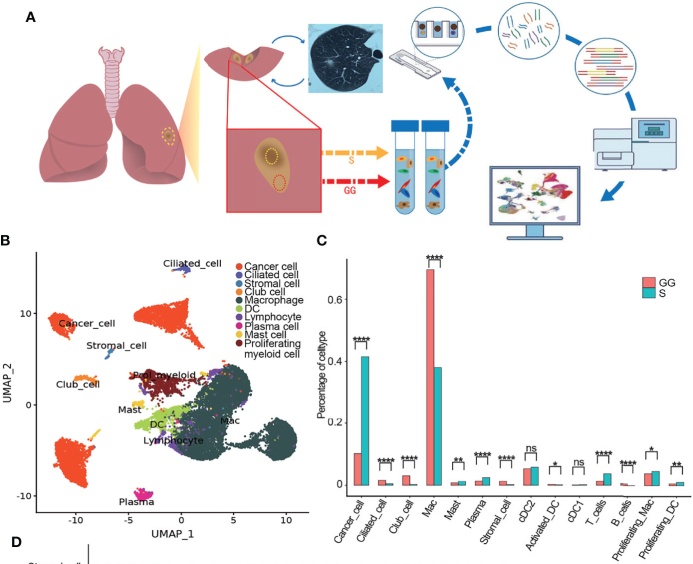
图1.mGGO的整体细胞图谱景观
2、癌细胞的相关特征
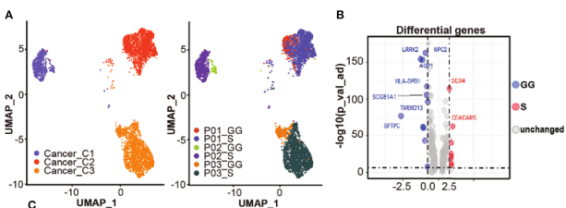
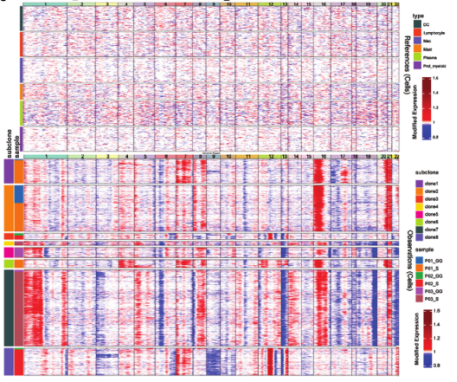
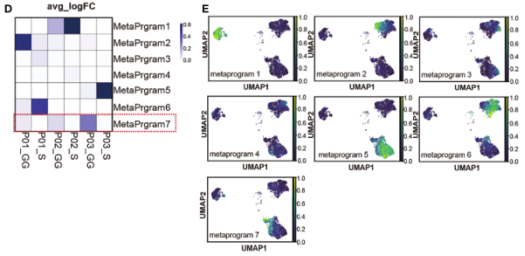
图2.不同成分癌细胞相关的转录组特征
通过LUAD和肺泡上皮细胞的典型标志物(如SFTPB、SFTPC、EpCAM等)鉴定癌细胞,总共4,905个癌细胞分成3群,几乎全部由单一患者来源的癌细胞组成,提示癌细胞的个体异质性大于不同成分间异质性。与GG成分的癌细胞相比,S成分的癌细胞上调SOX4和CEACAM5的表达,下调促炎因子如SCGB1A1和SFTPC的表达,同时上调白细胞介素性途径、受体酪氨酸激酶(RTK)信号、VEGFR2介导的增殖调节信号和干扰素β信号通路,下调干扰素-γ信号途径、表面活性物质代谢和溶酶体相关途径。CNV分析将癌细胞分为8个亚克隆,患者之间未发现共同的癌细胞亚克隆,但其中克隆1、2、3和8由相同患者的不同成分的癌细胞共享。为从不同的样本中获得癌细胞的转录特征,进行cNMF分析并鉴定7个癌细胞的Meta-Program。Meta-Program 7在GG间观察到不同的模式,其编码表面活性物质相关蛋白基因(SFTPA1、SFTPA2等)、细胞黏附因子、溶酶体稳态相关基因以及调节细胞生长周期或细胞凋亡的因子,同时表达细胞外基质受体蛋白的基因,如整合素超家族成员包括ITGB6和ITGA2等,表明它可能通过介导免疫调节剂的信号和调节与胶原纤维的结合和黏附来影响肿瘤的进展。总之S样本的癌细胞异质性更强,表现出更明显的肿瘤生物标志物表达。GG样本中的癌细胞高度表达表面活性物质相关蛋白,并表现出压力相关的特征。
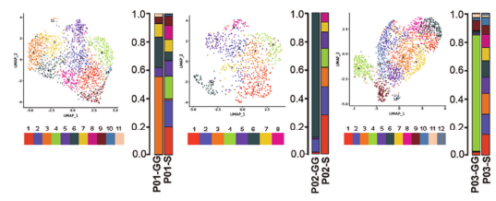
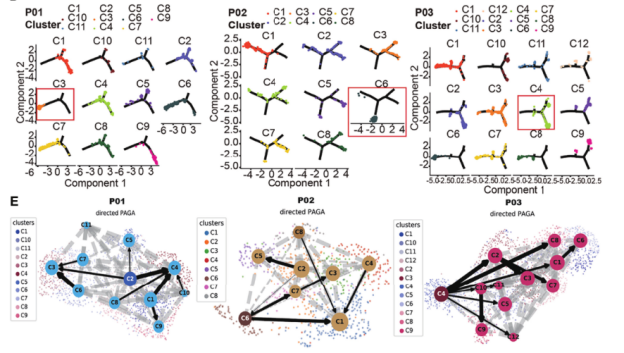
图3.mGGO癌细胞的起源
由于CNVs中mGGO不同成分之间的癌细胞在每个患者有相似的基因组重排,因此接下来探究S和GG组分间是否存在发育关系。首先分析个体的癌细胞发现每个患者在GG成分中都有一个占优势的癌细胞亚簇(P01-C3, P02C6和P03-C4);S组分中癌细胞表现为多亚簇的混合组成,与LUAD的病理特征相一致。接下来进行轨迹分析,GG组分中癌细胞的优势亚簇一般位于轨迹的一端,S组分中癌细胞的分布较为分散,说明GG组分中的大部分癌细胞处于进化过程的相似状态,S组分中的癌细胞则沿轨迹分散,呈现分支进化结构。还通过RNA速率分析每个患者癌细胞的发育轨迹,从而推断出处于初始状态的癌细胞亚簇。发现3例患者中有2例(P02和P03)的初始状态癌细胞亚簇为GG组分的优势亚簇,患者P01的GG组分中的优势癌细胞亚簇(P01-c2)为第二初始状态。加上促肿瘤基因HMGB3和IGFBP2在P01C2中高表达,提示恶性肿瘤细胞存在低分化亚群;另外S组分中癌细胞的干性略高于GG组分。综上结果表明癌细胞既可以来源于GG灶癌细胞,也可以来源于实性灶癌细胞。
3、巨噬细胞相关特征
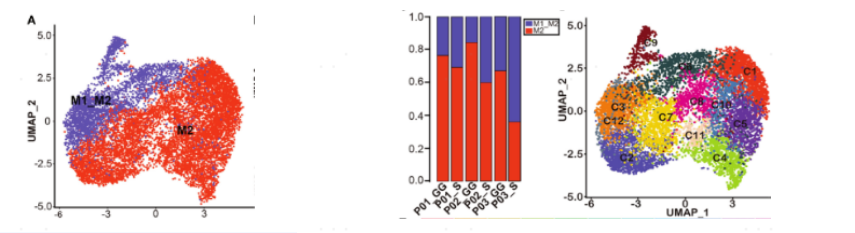
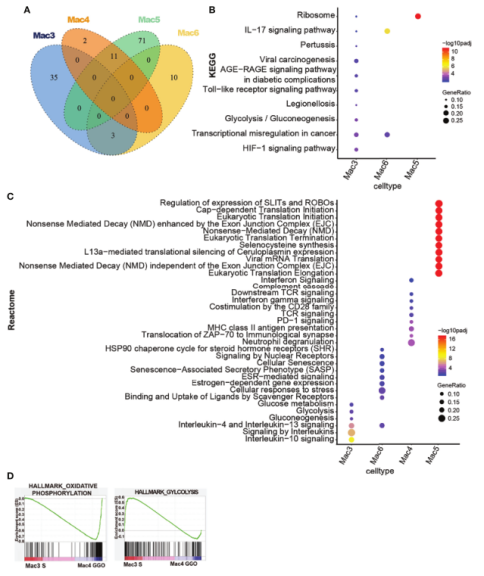
图4.mGGO不同组分中巨噬细胞的多样性
3.1 mGGO中不同成分巨噬细胞的多样性
巨噬细胞细分时主要为M1_M2、M2巨噬细胞,S组分中M1_M2巨噬细胞比例较高。基于无监督聚类的结果产生12个亚簇,发现S和GG组分中分别富集了不同的亚群,如S和GG中分别富集了Mac3-SPP1hi和mac4-LYZhi-SPNlo。巨噬细胞的转录特征分析发现不同群上调不同的基因,如Mac3-SPP1hi的特征是CCL3、CCL4、CXCL2和CXCL8的高表达,表明其对炎症细胞的化学吸引和招募具有积极的功能。这些结果描述了不同mGGO成分中巨噬细胞亚簇的不同分布特征。
进一步的功能富集分析发现,如Mac3、Mac6组与Mac4、Mac5组间无共享的通路,两组在组内都上调少数共同的通路。Mac3中,IL-4、IL-10、IL-13信号通路及肿瘤相关转录因子异常显著升高,IL-17、Hif-1a通路、葡萄糖代谢通路上调。虽然Mac3细胞糖代谢水平上调,但Mac4细胞氧化磷酸化相关基因的表达水平高于Mac3细胞,这些基因分别主要来源于GG和S样品。正常细胞增殖的代谢需求与癌细胞不同,表明在肺癌发生的早期阶段,葡萄糖的摄取和利用可能发生了变化。

图5.GG组分和S组分巨噬细胞的不同特征
3.2 S成分中的巨噬细胞上调NF-kB相关信号
巨噬细胞的cNMF聚类分析,Meta-Program 7基因特征主要由热休克蛋白家族基因、GPCR信号通路相关基因、炎性细胞因子基因和肿瘤抑制基因组成,同时NFkB抑制因子如NFkBIA和NFkBIZ也包括其中;GSEA发现这些途径都富含在S的Mac3巨噬细胞中,可能S组分Mac3巨噬细胞中的NFkB抑制因子是由NFkB过度激活引起的负反馈调节。另外巨噬细胞极化方向的重要调节因子,与AP-1和Bcl-2相关的基因也表达在Meta-Program 7中,这些特征表明巨噬细胞的非典型极化特征与Meta-Program的上调有关,特别是在mGGO的S成分中。
4、细胞相互通讯分析
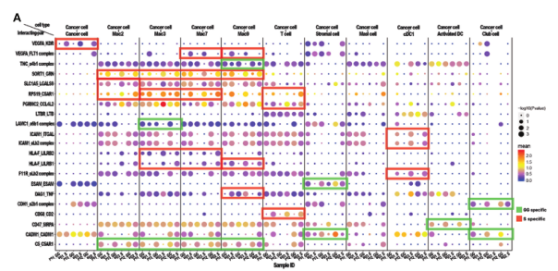
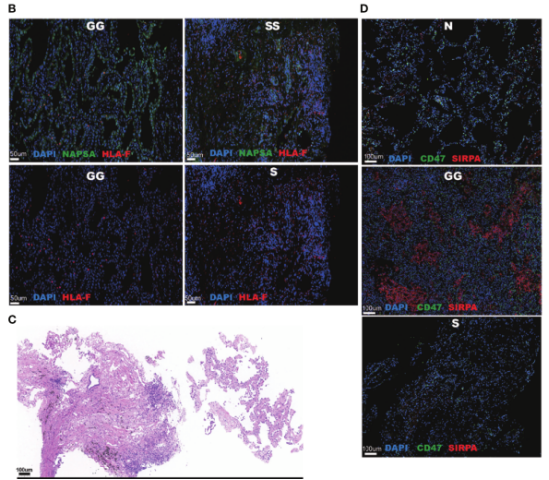
图6.与癌细胞相关的相互作用表明不同的mGGO成分具有不同的肿瘤发展模式
4.1 肿瘤细胞相关相互作用提示mGGO不同成分的肿瘤发展模式不同
CellphoneDB研究不同mGGO组分中的癌细胞特异性相互作用。S组分富含与血管生成相关的相互作用,VEGFA和Flt1(编码VEGFR1)分别在癌细胞和巨噬细胞中高表达。同时S组分在癌细胞中上调HLA-F,且与巨噬细胞中LILRB1/LILRB2的上调有关。与GG组分的癌细胞相比,S组分的癌细胞与DC显示出更显著的潜在相互作用,主要是通过ICAM1和F11R等黏附分子;CD58与T细胞受体CD2相互作用的黏附分子在癌细胞中高表达,表明S组分具有较高的免疫原性,激活了T细胞的细胞毒作用。S组分巨噬细胞中高表达的肿瘤坏死因子与癌细胞中DAG1的上调有关,DAG1调节细胞的生长和凋亡。综上,癌细胞和免疫细胞之间的相互作用在S组分中显示出一个复杂的调控网络,包括免疫抑制相互作用(HLA-F_LILRB1/LilrB2和RPS19_C5AR1)、免疫激活相互作用(DAG1_TNF和CD58_CD2)。此外,免疫细胞,特别是巨噬细胞,更有可能通过高度特异的相互作用对,如SORT1_GRN和PGRMC2_CCL4L2,促进S成分癌症的发展。GG成分中的癌细胞主要通过ESAM、CADM1、CDH1和LAMC等黏附分子以及免疫逃逸因子CD47与基质细胞、club细胞和巨噬细胞相互作用。综上,表明癌症与不同成分的免疫细胞之间具有不同相互作用。
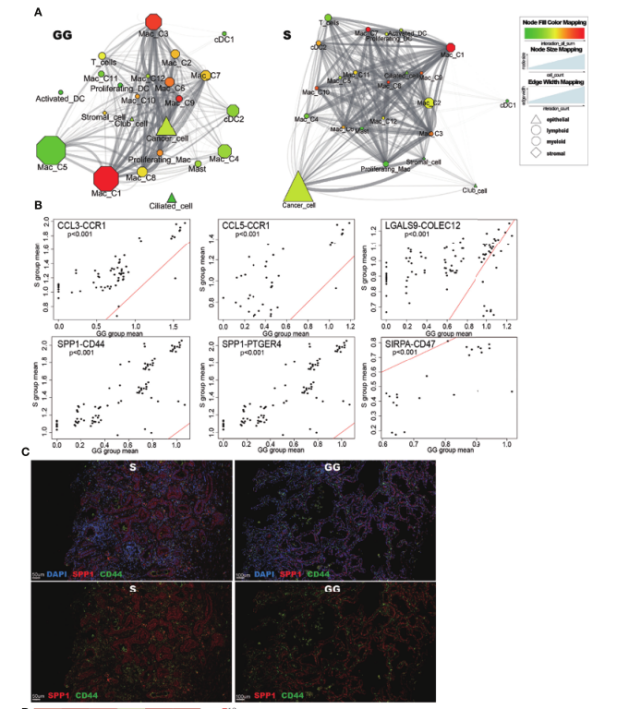
图7.GG组分和S组分之间不同的细胞-细胞相互作用模型
进一步证明不同成分间细胞相互作用在不用细胞亚群上具有不同的表现,结果发现巨噬细胞亚群的分布不仅在功能上不同,在S和GG组分间的细胞相互作用中也不同。富含S组分的MAC3和MAC6比MAC4和MAC5表现出更强的相互作用,这可能与MAC3和MAC6功能更多样化有关。
S和GG组分之间CCL3_CCR1和CCL5_CCR1相互作用的不同表达水平,表明S和GG组分在免疫抑制微环境和炎症特征方面存在差异;SPP1_CD44在S组特异性表达,提示该互作可能在实性成分的侵袭性中扮演重要角色;CD47_SIRPA在GG组特异性表达,提示磨玻璃成分可能存在更多的免疫逃逸现象,这可以部分解释免疫疗法在GGO病例中效果不佳的现象。总之,与GG成分相比,S成分表现出更多与炎症相关的肿瘤特征,其中巨噬细胞起着关键作用。
结论
在这项研究中,对mGGO的S成分和GG成分进行了宏观解剖,并对来自3名mGGO患者的6对成分进行了单细胞测序分析。总共分析了19,391个单细胞图谱,并对每个患者的数据进行了独立分析以获得共同的变化。S组分以癌细胞为主,GG组分以巨噬细胞为主。S组分中的癌细胞表现出相对恶性的表型,并通过复杂的细胞相互作用网络监测周围的肿瘤微环境(TME)。S组分富含SPP1hi巨噬细胞,并表现出更强的趋化活性,而GG组分的巨噬细胞则表现出较高的应激诱导状态的活性抗菌过程。综上所述,该研究揭示了mGGO中细胞成分和不同组分之间转录特征的变化。
参考文献
Yu He, Fenglei Yu, Yi Tian, et al.Single-Cell RNA Sequencing Unravels Distinct Tumor Microenvironment of Different Components of Lung Adenocarcinoma Featured as Mixed Ground-Glass Opacity.Front.Immunol.,06 July 2022.https://doi.org/10.3389/fimmu.2022.903513








