脓毒症因其高发病率和高死亡率而成为全球公共卫生关注点,2017年全球估计有4890万例脓毒症病例和1100万例脓毒症相关死亡。以往的研究表明了STING在先天免疫中发挥着重要作用,但导致严重脓毒症的确切机制却不甚明确。2022年7月,南京医科大学研究者在Cell Death & Disease上发表了题目为“The interaction between STING and NCOA4 exacerbates lethal sepsis by orchestrating ferroptosis and inflammatory responses in macrophages”的研究,通过对STING(stimulator of interferon genes)和NCOA4(Nuclear receptor coactivator 4)相互作用调节先天免疫反应的相关机制,为脓毒症的相关研究提供了新思路。
研究思路
本文通过单细胞转录组测序,找到了在STING敲除脓毒症模式小鼠中,变化最为明显的细胞为巨噬细胞。在进一步的研究中,作者对STING敲除小鼠和野生型小鼠巨噬细胞的差异基因进行通路富集分析,发现了与铁死亡相关通路的高度富集,进而确定了进一步深入研究的方向,通过一系列质谱分析实验和细胞实验最终明确了STING诱导铁死亡的分子机制和生物过程,并给出了针对该途径改善脓毒症的新思路。
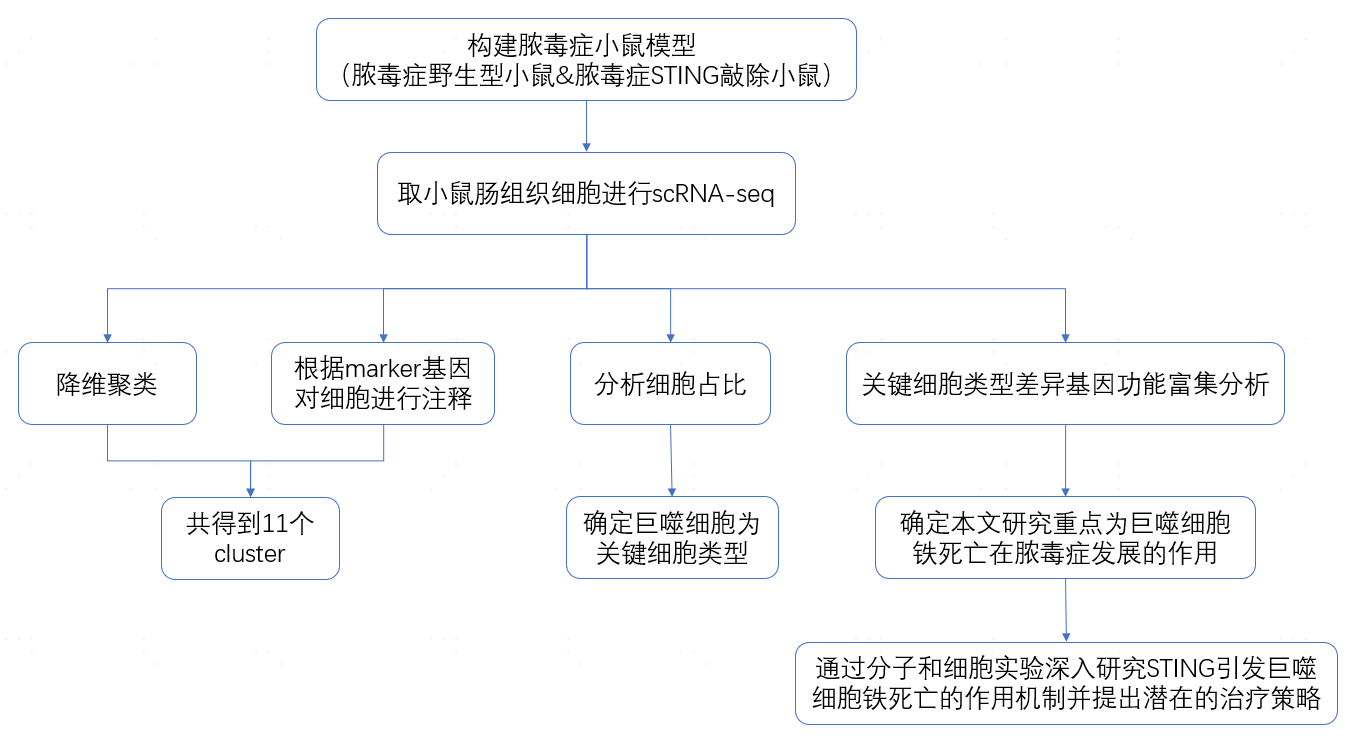
研究流程
研究结果
1、STING的表达会导致巨噬细胞脂质过氧化引发脓毒症死亡
为确定脓毒症期间,STING活化直接影响的细胞类型,作者构建了由盲肠结扎和穿刺诱导(CLP)的脓毒症小鼠模型,通过对来自CLP野生型(WT)和STING敲除(STING1-/-)的小鼠肠组织细胞进行scRNA-seq,总共获得62,307个细胞,降维聚类后得到11个cluster,根据不同细胞的marker基因,对这些cluster进行了注释(图1A-B)。
通过对各细胞类型在不同组别中的占比分析发现,CLP-STING1-/-小鼠的免疫细胞比例高于WT小鼠,其中以巨噬细胞的减少最为显著(图1C)。进一步发现,虽然CLP-WT小鼠中M1M2型巨噬细胞占比减少,但在STING1-/-小鼠中并没有明显变化(图1E)。为了研究STING在巨噬细胞中的作用,作者分别对小鼠巨噬细胞或肠上皮细胞中的STING基因进行敲除,结果表明介导脓毒症死亡中起到关键作用的是巨噬细胞中的STING。
为了探索脓毒症细胞死亡的潜在机制,作者筛选出一个包含625种针对脂质过氧化、自噬、细胞死亡、线粒体代谢等氧化还原相关途径的化合物库,并选择抑制STING诱导脂质ROS产生的前十种化合物,测试它们在STING激活后抑制细胞死亡的能力(图1J-L),最终发现,巨噬细胞特异性STING是导致脂质过氧化依赖性细胞死亡的原因。
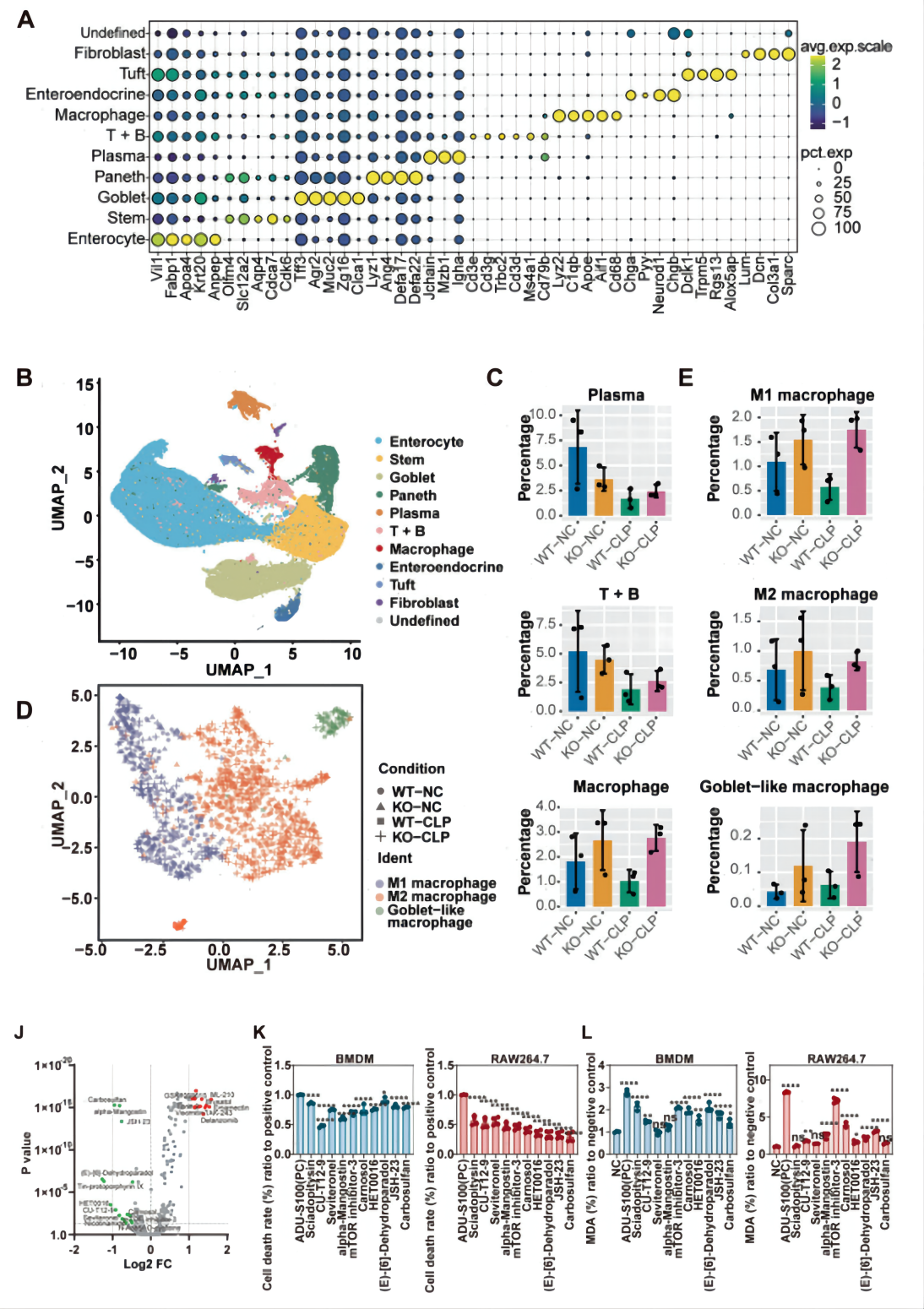
图1 STING导致巨噬细胞脂质过氧化和细胞死亡
2、巨噬细胞中STING的特异性激活在致死性脓毒症中诱导铁死亡损伤发挥关键作用
研究团队通过基因集变异分析(GSVA)WT和STING1-/-小鼠在scRNA-seq中获得的所有巨噬细胞簇,发现CLP-STING1-/-小鼠的巨噬细胞簇中富集于铁死亡相关通路(图2A)。随后作者将铁死亡相关基因分成六个组,包括增加细胞内铁、促进铁死亡、增加脂质氧化/过氧化、抑制氧化、抑制铁死亡或减少细胞内铁,最终通过GSVA分析认定STING在疾病进程中会通过增加细胞内铁水平从而促进铁死亡(图2B)。
基于以上发现,作者建立了对照实验组,通过铁死亡抑制剂liproxstatin-1(LIP-1)和铁死亡诱导剂RSL3处理严重的脓毒症小鼠模型(图2C),发现与未处理的对照组相比,RSL3预处理显著增加了死亡率,而LIP-1处理降低了脓毒症小鼠的死亡率(图2D)。在蛋白质印迹和免疫组织化学的分析验证后,确定了铁死亡和STING激活是脓毒症的共同特征。
为了进一步研究STING的激活与铁死亡之间的关系,作者从蛋白层面(SDS-PAGE)评估了STING的激活和铁死亡相关蛋白变化(图2J-K),结果显示STING激活是铁死亡开始的先决条件。
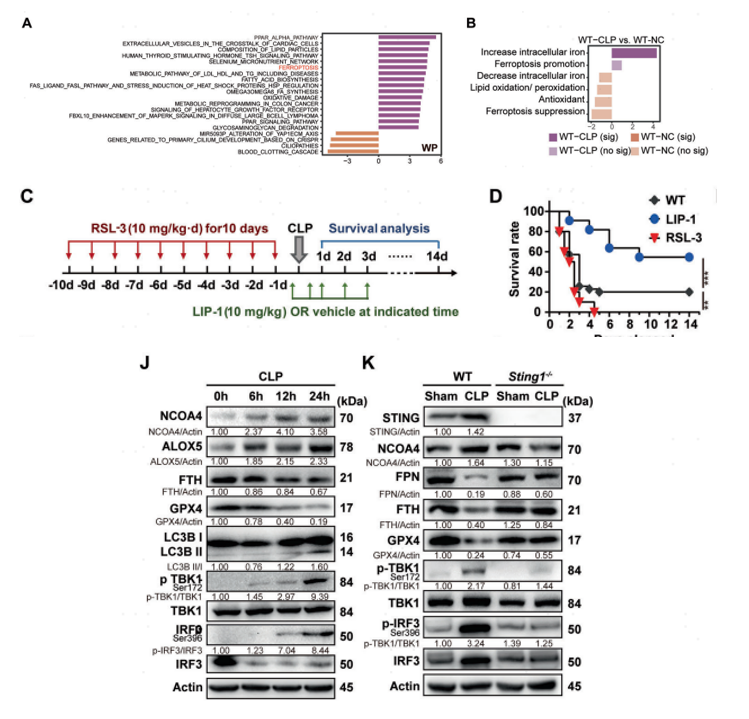
图2 STING介导的巨噬细胞铁蛋白酶增多在致死性脓毒症中起着至关重要的作用
3、STING诱导的铁死亡依赖于NCOA4介导的铁蛋白吞噬
为了评估在STING激活的条件下胞内游离铁离子在引发铁死亡中的作用,作者通过一系列细胞实验发现STING的激动剂CDA和DMXAA可以增加细胞质游离铁的水平(图3A),进一步实验发现,STING激活后细胞内游离铁的积累与NCOA4介导的铁蛋白吞噬作用触发巨噬细胞铁死亡(图3B),且并不依赖于STING通路的下游TBK1信号通路的参与(图3G-J)。
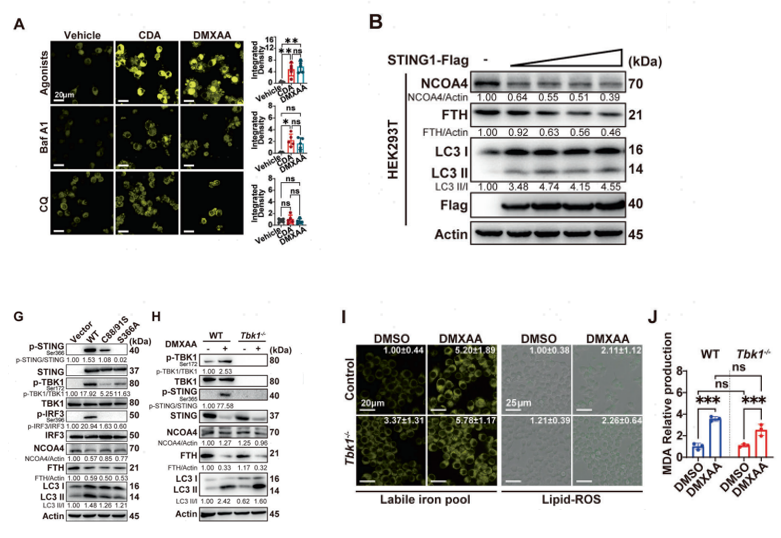
图3 STING通过NCOA4介导的铁蛋白吞噬导致铁死亡
4、确定STING相关的CDN结合域以及NCOA4的卷曲螺旋域是形成复合物所必需的
STING蛋白的结构主要包含氮端跨膜(TM)结构域和由三个结构域共同组成的碳端胞质结构域:二聚化结构域(DD)、CDN结合结构域(CBD)和胞质末端尾(CTT)结构域(图4C)。NCOA4存在为多个剪接变体,其中最常见的是NCOA4α和NCOA4β。这些亚型共享氮端卷曲螺旋(CC)域和一小部分碳端。为了进一步探索STING调节NCOA4介导的铁蛋白吞噬的具体作用机制,作者构建了含有STING和NCOA4不同结构域的氨基酸片段,经过免疫共沉淀的测定发现STING的CBD在与NCOA4的CC片段形成复合物,在诱导铁蛋白吞噬中起着重要作用(图4D-E)。
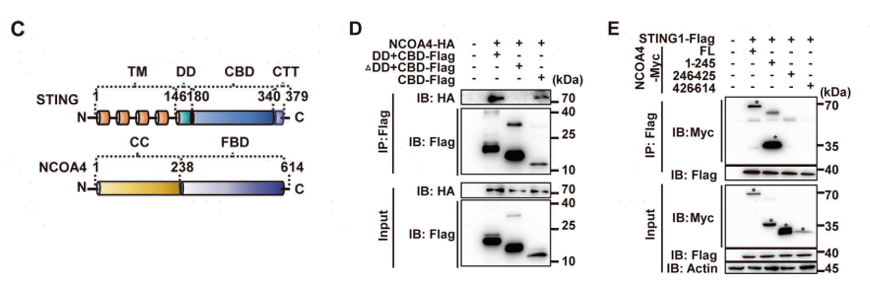
图4 STING的CDN结合结构域与NCOA4的CC结构域相互作用
5、NCOA4与STING相互作用诱导STING二聚化并降低NCOA4核定位
STING和NCOA4之间相互作用具有哪些特殊的生物学功能和效应呢?为了回答这个问题,作者对CLP-STING1-/-小鼠巨噬细胞中所有的差异基因进行GSVA分析,发现了过氧化物酶体增殖物激活受体α(PPARα)途径最为富集,该途径与脂质合成/代谢和炎症调节途径密切相关(图5A)。由于NCOA4最初被发现是多种核受体的共激活剂(图5B),基于此,作者推测STING1-NCOA4复合物的形成降低了NCOA4的核定位,并通过NCOA4的细胞质滞留破坏了其共激活因子功能。结合对NCOA4转录调控因子(TFs)基因集进行功能富集(GSEA)以及比对这些转录因子调控的下游基因表达情况,作者发现与CLP-STING1-/-小鼠相比,PPAR和AR靶基因的表达显著增加(图5C)。随后作者团队用细胞组分的免疫印迹和免疫荧光分析验证了STING与NCOA4的物理相互作用,改变了NCOA4的核定位并调节PPARα在转录活性中的作用(图5D-E)。
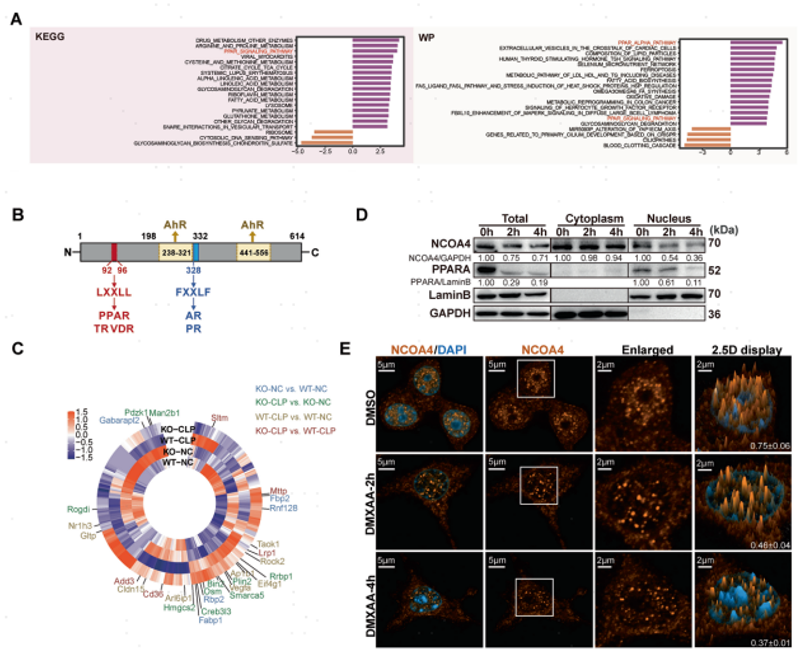
图5 NCOA4与STING结合以维持STING活化并减少核定位
6、HET0016可通过阻止STING诱导的铁死亡进程来预防败血症
文章最后,作者验证了STING介导的铁死亡在重症脓毒症发病过程中的作用机制。通过评估作者早前研究中的28名脓毒症患者和6名健康受试者样本,发现血浆中的MDA水平与疾病严重程度(图6A-B)、炎症水平与肠屏障损伤呈正相关的生物标志物,发现脓毒症患者在疾病进程中伴有铁死亡的发生(图6D)。
那么,铁死亡抑制剂可否作为一种治疗策略呢?早前获批的DFO作为铁螯合剂,尽管在一定程度上可以减轻重型地中海贫血和镰状细胞患者的铁负担,但会造成对心血管和呼吸道的副作用,作者根据以往研究和之前筛选化合物的结果选择了三个不同的化合物靶点:JSH-23(一种特定的NF-κB p65通路抑制剂)、HET0016(一种选择性20-HETE合酶抑制剂)和鼠尾草酚(一种Nrf2激活剂),通过对CLP小鼠注射并观察小鼠存活情况,发现HET0016有效提高了CLP小鼠的存活率(图6E)。后续对使用HET0016治疗的脓毒症患者PBMC的研究显示,该药物可有效减少STING的激活(图6F),并有效抑制炎性因子的产生(图6G)及MDA水平(图6H)。经过单细胞数据与一系列的验证工作,作者认为HET0016可以通过减轻STING通路激活和抑制随后的铁死亡来治疗脓毒症。
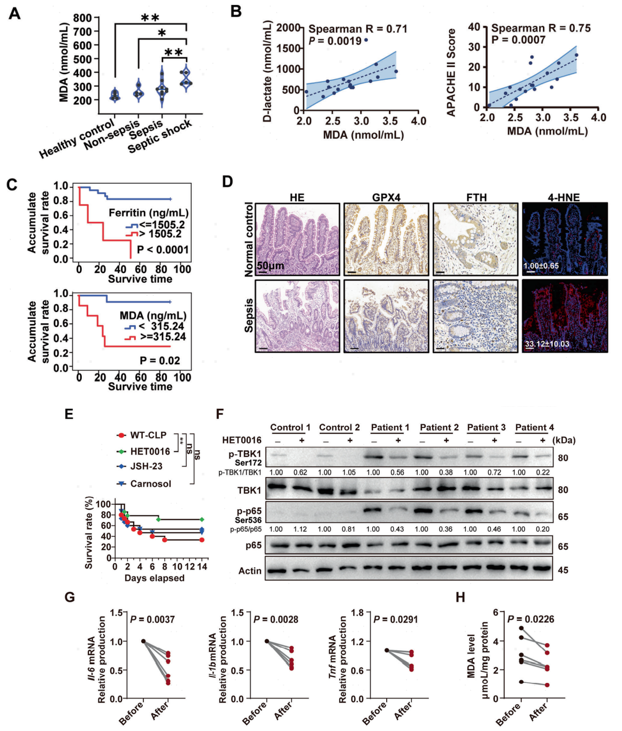
图6 HET0016作为脂质过氧化抑制可防止脓毒症
结论
1. 巨噬细胞特异性STING是导致脂质过氧化依赖性细胞死亡的原因;
2. STING激活是铁死亡开始的先决条件,在疾病进程中STING会通过增加细胞内铁水平从而促进铁死亡;
3. STING激活后细胞内游离铁的积累与NCOA4介导的铁蛋白吞噬作用触发巨噬细胞铁死亡;
4. STING的CBD在与NCOA4的CC片段形成复合物,在诱导铁蛋白吞噬中起着重要作用;
5. NCOA4增强了STING二聚化并促进了STING下游信号传导,而STING激活降低了NCOA4作为核共激活剂影响PPAR下游基因的表达;
6. HET0016可以有效抑制STING诱导的铁死亡。
参考文献
Wu J, Liu Q, Zhang X, Tan M, Li X, Liu P, Wu L, Jiao F, Lin Z, Wu X, Wang X, Zhao Y, Ren J. The interaction between STING and NCOA4 exacerbates lethal sepsis by orchestrating ferroptosis and inflammatory responses in macrophages. Cell Death Dis. 2022 Jul 28;13(7):653. doi: 10.1038/s41419-022-05115-x. PMID: 35902564; PMCID: PMC9334269.








