新格元Accura cell中低通量单细胞转录组测序,领航单细胞测序新赛道
发布时间:2022-09-30 15:46:53
单细胞测序技术在临床科研中带来了革命性进展,多次问鼎生命科学顶刊封面与年度技术榜单。海量单细胞测序技术捕获的是3’mRNA或5’mRNA,对细胞输入量也有一定要求,针对某些特殊或者细胞量少的单细胞测序场景需要中低通量的解决方案。中低通量单细胞转录组测序技术解决了因细胞数少而无法进行高通量测序的难题,且可覆盖全长转录本,除分析不同细胞间差异基因表达之外,还能深入检测到细胞内融合基因,可变剪切,基因位点突变等生物信息。
“欲穷千里目,更上一层楼。”
新格元现推出Accura cell中低通量单细胞转录组测序技术,联合现有的GEXSCOPE®海量单细胞转录组测序技术,实现高中低通量单细胞转录组测序全面覆盖。
一、新格元Accura cell中低通量单细胞转录组测序实验流程及原理
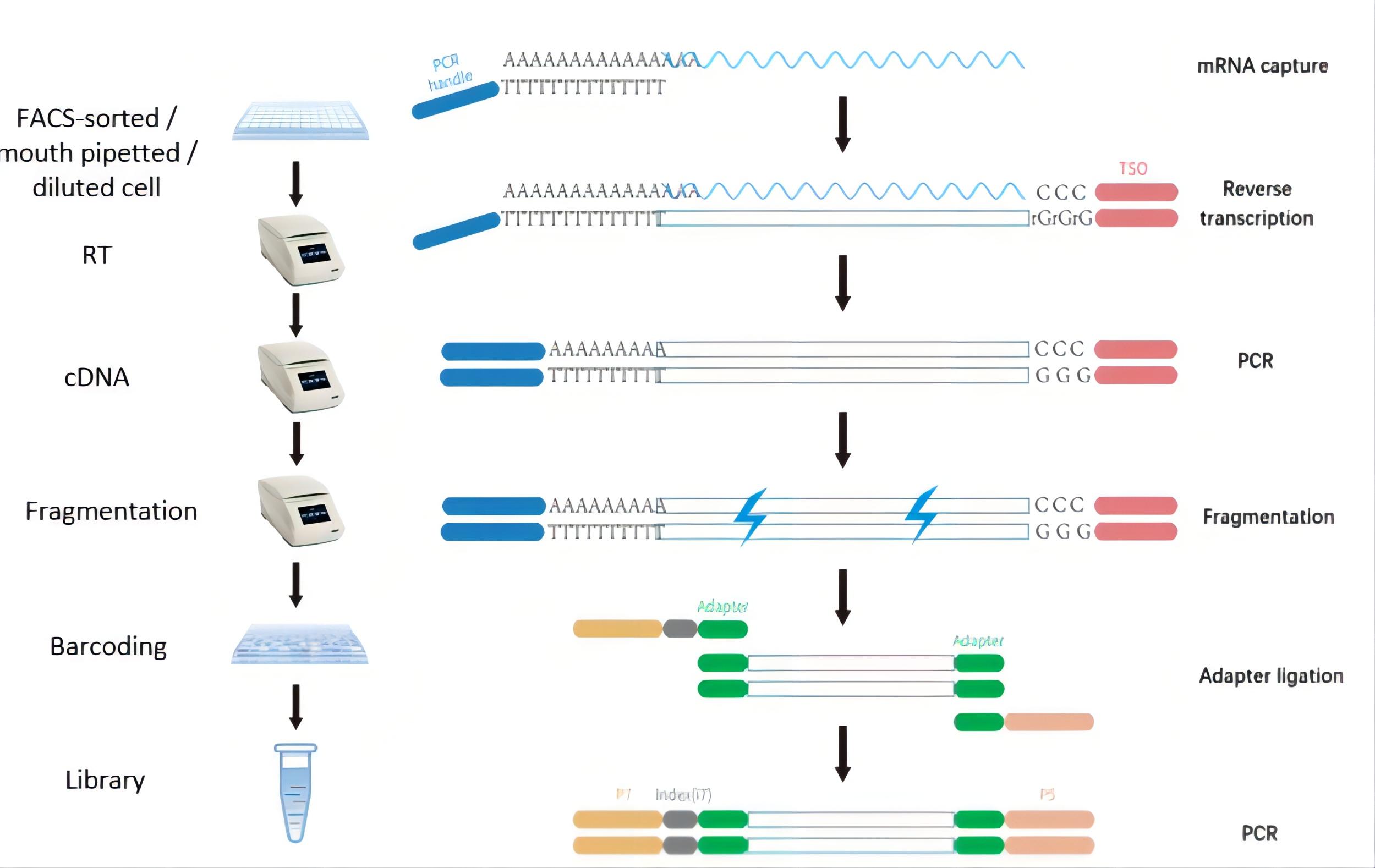
(1)样本准备:从组织分离单细胞,要求是新鲜的组织,无冷冻、固定等处理。保证细胞活性和形态完整,不要损伤细胞;
(2)裂解液分装:在96孔板中依次加入细胞裂解液、Oligo dT;
(3)单细胞分离与mRNA捕获:将单个细胞依次加入到96孔板中,完成细胞裂解,mRNA捕获过程;
(4)反转录:反转录混合液,将mRNA反转录成cDNA;
(5)扩增:将反转录后的cDNA扩增成cDNA产物;
(6)打断:将cDNA产物片段化;
(7)末端修复加A加接头,接头序列中Adapter包含barcode序列,作为区分每孔的cell barcode;
(8)PCR扩增构建测序文库,并加上P5、P7和index;
(9)上机测序;
(10)数据分析。
二、新格元Accura cell中低通量单细胞转录组测序技术的性能特征及优势
(1)模板起始量低:单个/少量稀有细胞;低输入量的RNA;
(2)转录本覆盖度高:测序结果获得全长转录本信息,无3’和5’偏好性,产物完整度高;
(3)检测灵敏度高:大幅度增加了低表达基因的检出量;
(4)用于检测可变剪切,在转录本层面进行SNP和突变分析,助力新的生物标志物鉴定以及新疗法的开发。
三、应用场景
针对少量分选的细胞,通过该技术扩增出每个单细胞全长转录本,从而获得基因表达及VDJ的数据,分析不同克隆型免疫细胞的特异性表达情况。
研究案例:非小细胞肺癌PD-1阻断过程中外周血T细胞克隆动态变化
研究背景:了解免疫检查点阻断(ICB)后T细胞的功能状态和克隆动态,对于改进治疗策略具有重要意义。
实验设计:对非小细胞肺癌(NSCLC)患者在程序性细胞死亡蛋白1(PD-1)阻断前后分选外周T细胞进行低通量单细胞RNA测序分析。
主要结果:研究发现肿瘤相关的CD4+T细胞克隆比CD8+T细胞克隆具有更高的细胞毒活性。同时检测到一个显著富集的与肿瘤相关的CD4+T细胞克隆在进展后丰度显著降低。此外检测了25个基因(CXCR4、DUSP2和ZFP36等)在疾病进展过程中显著上调或下调。这些分析提供了对非小细胞肺癌PD-1阻断期间外周T细胞克隆动态的洞察。
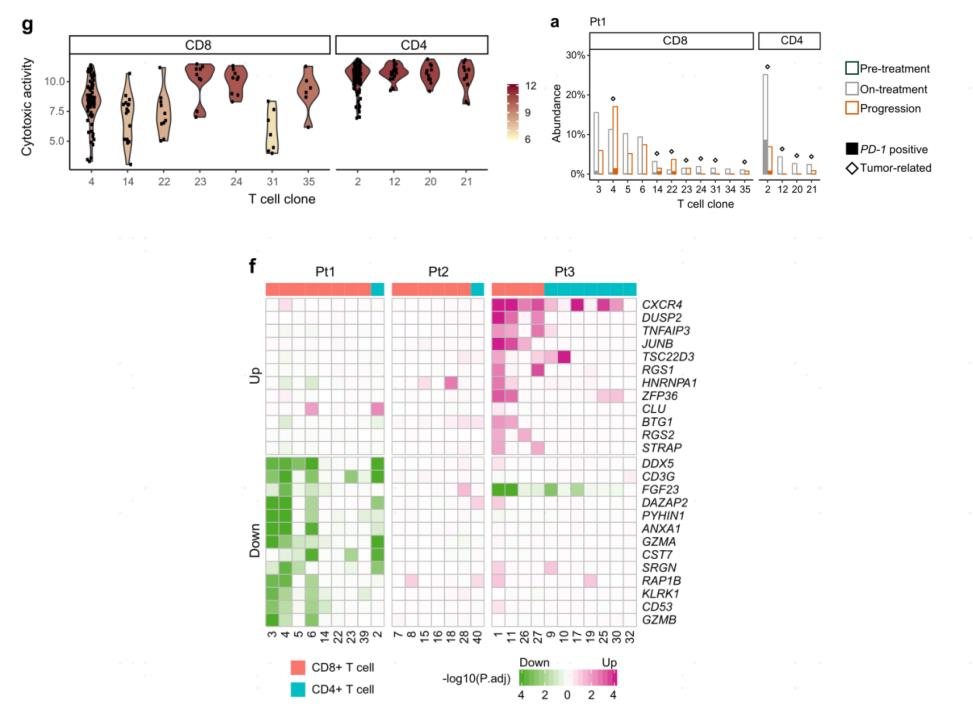
Zhang F, Bai H, Gao R et al. Dynamics of peripheral T cell clones during PD-1 blockade in non-small cell lung cancer. Cancer Immunol Immunother. 2020 Dec;69(12):2599-2611.
在肿瘤发展的过程中,对恶化前后的肿瘤细胞进行低通量单细胞转录组测序,可获得异质性肿瘤细胞亚群及重要标志物,此外可获得恶变前后可变剪切的区别,异常可变剪切发生的基因集可能在肿瘤发展中起着关键作用。
研究案例:低通量单细胞分析揭示肿瘤内的异质性,挖掘肿瘤细胞潜在生物标志物
研究背景:人们对肝细胞癌复杂的基因表达谱知之甚少,单细胞转录组测序可在单细胞水平探索肝细胞癌遗传特征。
实验设计:使用低通量单细胞转录组测序方法对人肝癌肿瘤和癌旁组织中共405个细胞进行了单细胞基因表达分析。
研究方法:作者在肝细胞癌和癌旁组织中鉴定出7个异质性亚群,包括5个肝癌细胞亚群和1个肝细胞亚群。研究发现MLX类相互作用蛋白(MLXIPL)沿肝癌细胞亚群发育轨迹上调表达,且在肝癌组织表达显著高于癌旁。此外,生存预后分析发现MLXIPL与肝癌的低生存率相关。该研究工作确定了肝癌亚群的异质性,并提示MLXIPL可能是一种潜在肝癌治疗靶点。
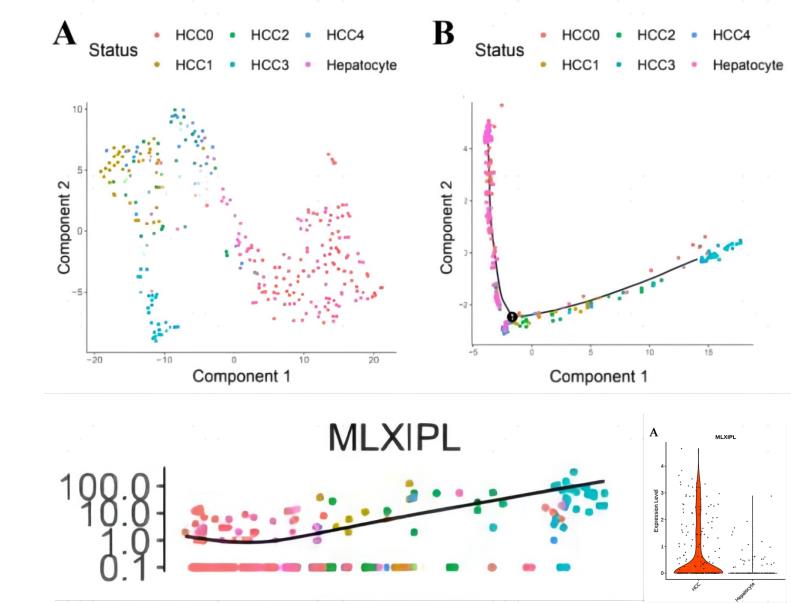
Dong X, Wang F, Liu C, et al. Single-cell analysis reveals the intra-tumor heterogeneity and identifies MLXIPL as a biomarker in the cellular trajectory of hepatocellular carcinoma. Cell Death Discov. 2021 Jan 18;7(1):14.
低通量单细胞测序可与高通量单细胞测序平台联合,弥补其对于单个细胞基因表达测定信息不全的缺陷,实现了对特定细胞的更高精准度的转录本覆盖,进而可以绘制精细的单细胞表达图谱。
研究案例一:低通量单细胞测序分析单细胞可变剪切解析疾病进展机制
研究背景:再生障碍性贫血(AA)是一种骨髓衰竭症,约15%的患者会发展为恶性血液肿瘤如MDS和AML,再障患者骨髓残留的HSPC数量极少,解析骨髓损伤后HSPC相关细胞及分子机制存在较大挑战。
研究方法:从15名健康供体和15名AA患者骨髓及PBMC中分选出CD34+ HSPC进行单细胞3’端转录组测序;并对AA患者骨髓中的HSPC进行低通量单细胞全长转录组测序与MDS数据联合分析。
研究结论:HSC细胞中异常可变剪切介导的DNA损伤修复信号改变是AA恶化为MDS的关键因素之一。
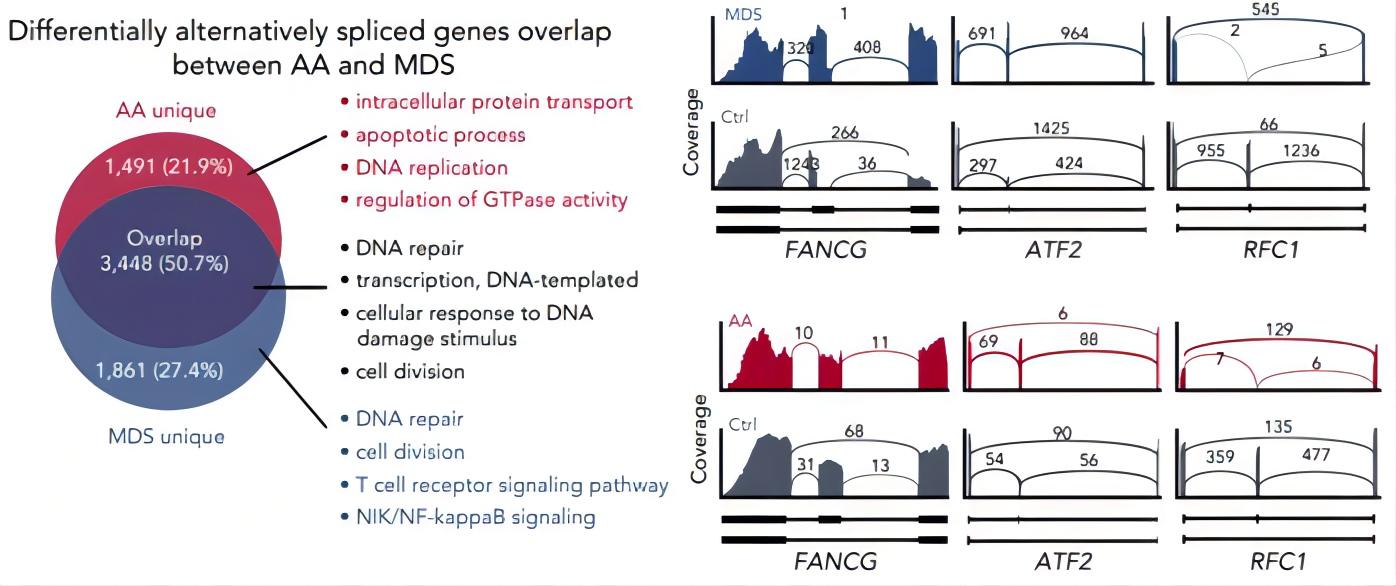
Zhu C, Lian Y, Wang C, et al. Single-cell transcriptomics dissects hematopoietic cell destruction and T-cell engagement in aplastic anemia. Blood. 2021;138(1):23-33.
研究案例二:低通量单细胞RNA测序鉴定出新的细胞亚群
研究背景:肝细胞癌(HCC)的免疫微环境复杂,对其中的巨噬细胞(TAM)和树突细胞(DC)知之甚少;肿瘤在转移的过程中会涉及肿瘤、癌旁、肝淋巴结(LNs)、腹水和血液等免疫相关位点,追踪免疫细胞在这些部位的组成是非常有必要的。
研究方法:结合低通量单细胞测序和10x 3’端高通量单细胞转录组测序,分析HCC患者的肿瘤、癌旁、肝淋巴结和腹水中的CD45细胞,分析了免疫细胞动态迁移和状态转化的特征。
研究结论:两种scRNA-seq平台联合揭示了HCC的高分辨率动态免疫图谱,低通量单细胞测序鉴定出10x 3’端高通量测序未检测出的新的细胞亚群LAMP3+DC。
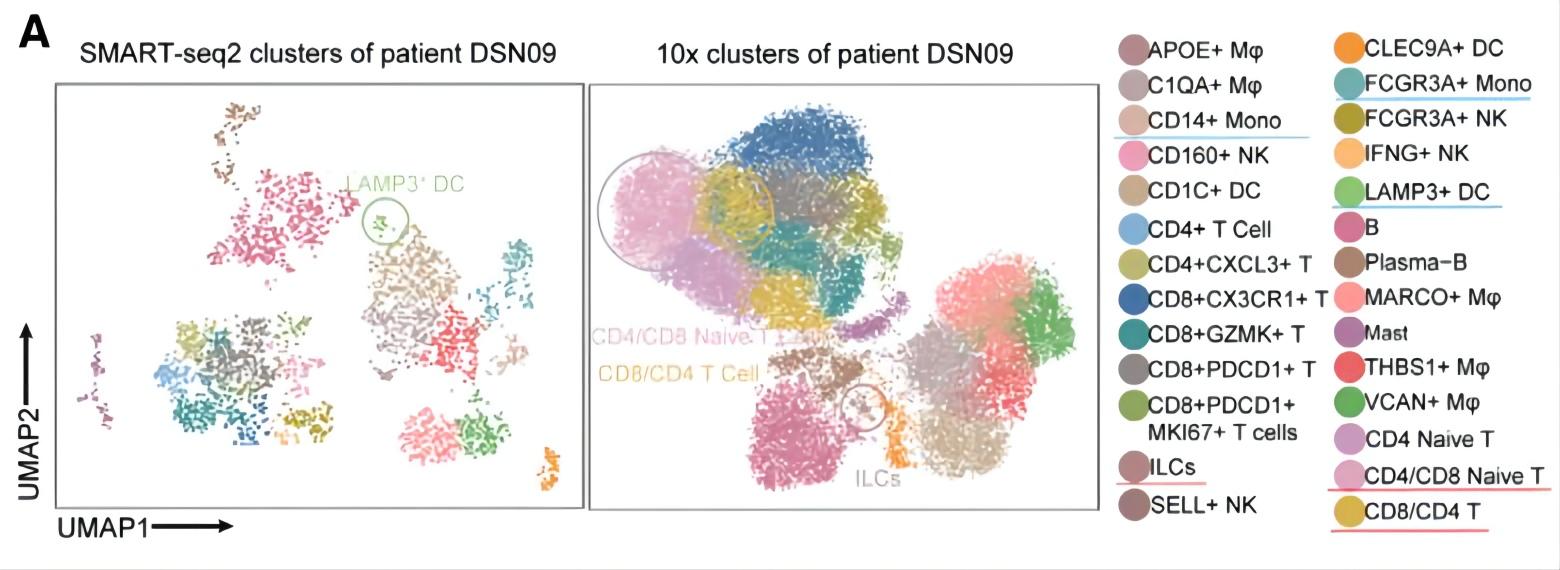
Zhang Q, He Y, Luo N, et al. Landscape and Dynamics of Single Immune Cells in Hepatocellular Carcinoma. Cell. 2019;179(4):829-845.e20.
早期胚胎发育形成的细胞数量极其有限,低通量单细胞测序技术可以借助有限的细胞分析胚胎发育过程中不同阶段的基因表达差异,构建发育谱系。
研究背景:由于缺乏特定的标记,在性别决定之前性腺细胞谱系的建立知之甚少,卵巢发育过程中体细胞谱系特征有待研究。
实验设计:作者结合流式分选和低通量单细胞建库,在Tg(Nr5a1-GFP)转基因小鼠性腺分化的6个时期(E10.5,E11.5,E12.5,E13.5,E16.5,and post-natalday6)分选了663个细胞进行低通量单细胞转录组测序。
研究结论:在性别决定过程中,根据细胞分群聚类以及拟时序分析结果,鉴定出了卵巢Nr5a1-GFP+体细胞亚群中同时产生颗粒前细胞和潜在类固醇生成前体细胞的早期祖细胞群体,描绘了发育过程中的基因转录变化。为进一步研究卵巢发育的分子和细胞程序提供了重要的单细胞分辨率资源。
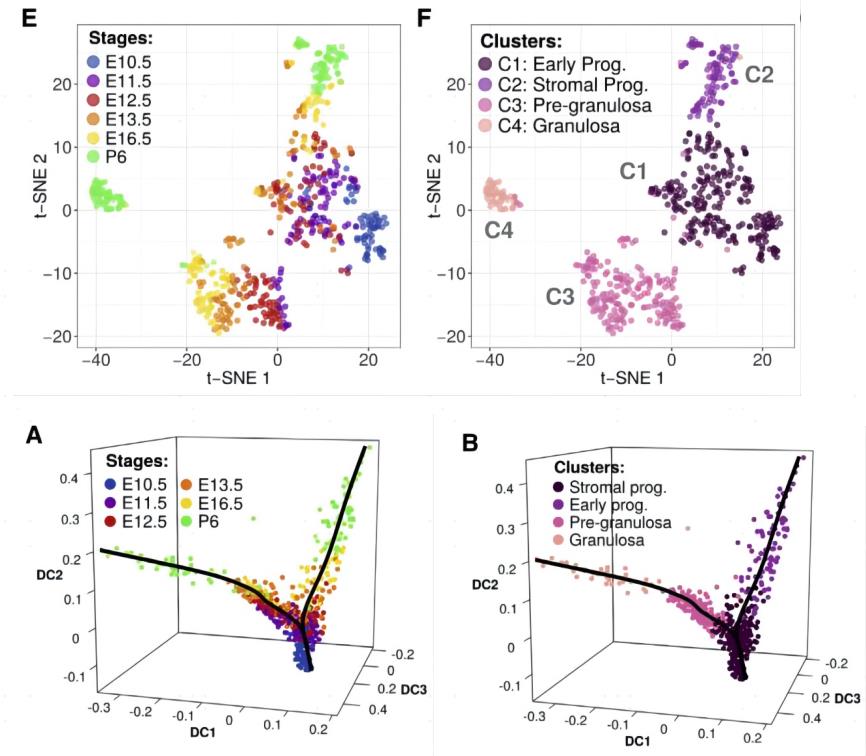
Stévant I, Kühne F, Greenfield A, et al. Dissecting Cell Lineage Specification and Sex Fate Determination in Gonadal Somatic Cells Using Single-Cell Transcriptomics. Cell Rep. 2019 Mar 19;26(12):3272-3283.e3.
新格元推出Accura cell中低通量单细胞转录组测序技术,既是单细胞测序技术创新发展的内在趋势,也是新格元一站式单细胞解决方案的又一次拓展。天下武功,唯快不破。新格元秉持“格物致知,识微通元”的创新理念,致力于发展简便可靠的单细胞多组学技术,使之成为可及的新一代细胞和分子临床研究与检测手段,让单细胞组学以更高精确度、更高灵敏度和更高分辨率服务于临床科研、精准医疗、药物开发及健康管理等领域。








