牙髓在牙齿功能的长期维持中起着至关重要的作用。然而,牙髓再生的机制以及牙齿干细胞在发育和再生中的作用尚未完全阐明。随着单细胞测序技术在牙科研究中的应用,人牙髓细胞的景观已经被初步勾勒。然而,牙髓细胞,特别是牙髓干细胞在不同空间和时间水平上的细胞异质性尚不清楚。
研究思路
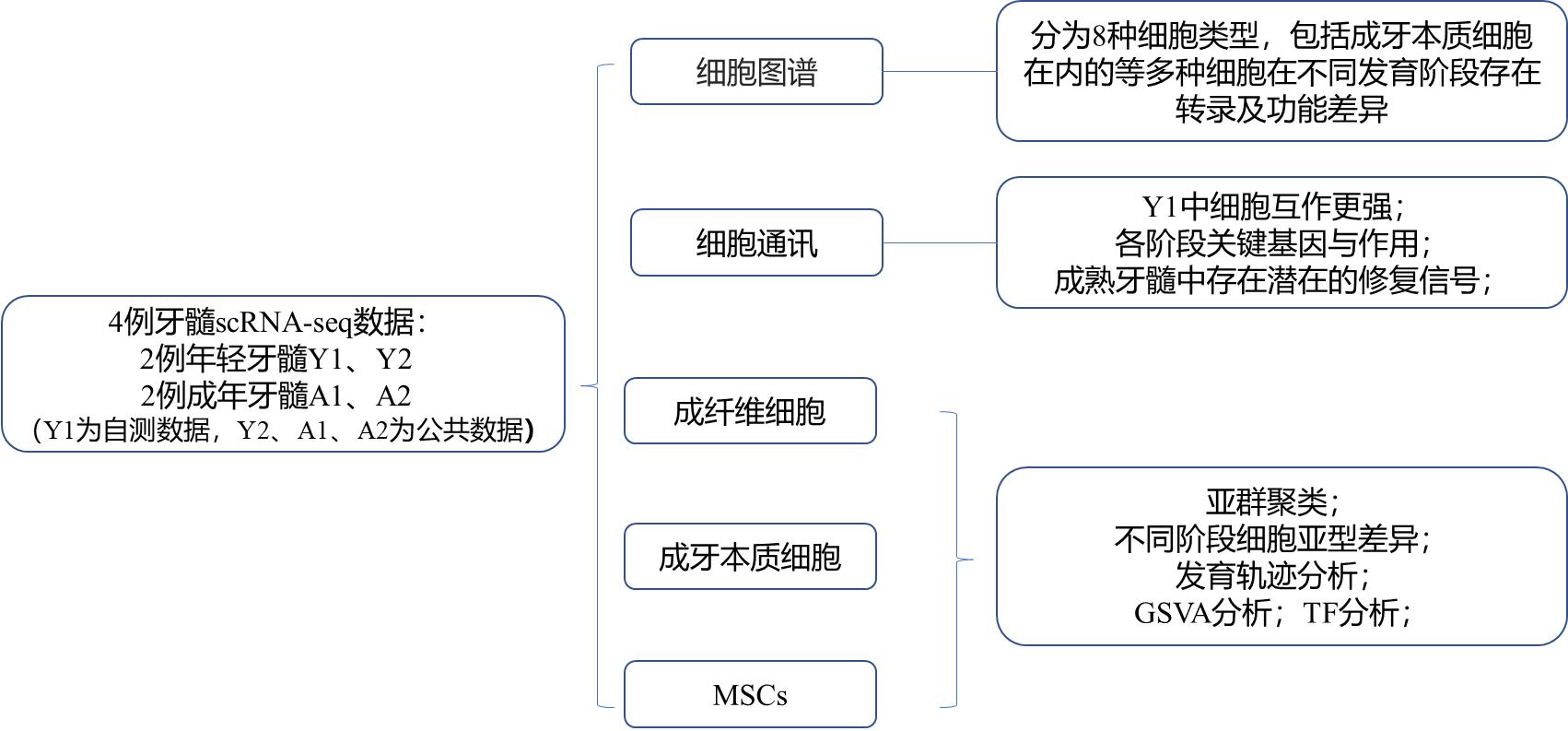
研究结果
1. 人牙髓细胞图谱
本文分析了4例处于不同发育时期的牙髓数据(共46428个单细胞数据),其中Y1样本处于牙根发育Nolla 6-7期,Y2相比Y1较晚,为Nolla 8期,A1/A2则来自于成熟牙髓。通过细胞聚类与注释,共得到包括成纤维细胞、成牙本质细胞、MSCs、MPs、淋巴细胞、EC等在内的8种细胞类型。在细胞类型方面,各样本无差异,成纤维细胞和EC是每个样品中的主要细胞群。但Y1中有更多的MP及淋巴细胞,通过免疫组化验证MP的marker基因CD163在年轻牙髓中表达。A1中EC和胶质细胞更多,而A2中则为MSCs和EC占比较大。
作为牙髓中的特殊细胞类型,成牙本质细胞只占一小部分。由于对人成牙本质细胞的特异基因表达模式尚不清楚,因此本文对成牙本质细胞进行了深入研究。对成牙本质细胞的表达特征进行了分析,发现其高表达编码离子通道蛋白和离子结合蛋白的基因,如SLC12A2和SPOK3,以及神经发育相关基因,如ST8SIA1和MAP1B。免疫组化表明SLC12A2和ST8SIA1在多阶段的成牙本质细胞中都有表达。

图1 人牙髓细胞图谱景观
2. 样本间的转录差异及细胞间通讯
文章中比较了4例样本间的转录表达差异,并进行了功能富集分析。Y1中的差异基因更多富集在核糖体相关功能以及参与翻译起始、蛋白质定位和细胞靶向,另外还有一些与免疫系统相关的功能,如趋化因子活性或MHC II受体活性,表明胶原蛋白/蛋白质形成和免疫系统建立发生在发育早期的牙髓组织中。Y2的特异性基因则参与细胞外结构组织、成骨细胞分化和成骨过程,表明Y2中细胞发生了进一步分化。同时鉴定了Y2中结合和粘附的分子功能相关的基因功能。对于A1和A2,DEG富集到细胞基质粘附,细胞-细胞连接,线粒体呼吸和NADH脱氢酶等功能,表征细胞的代谢活动。
之后使用了Cellphone DB来探究牙髓内细胞间通信和特定细胞间的相互作用。发现在Y1中细胞相互作用更加频繁,如EC、成纤维细胞、MSCs。在Y2、A1和A2中,只有EC与其他细胞类型保持高的通讯水平。对受配体对进行分析,鉴定了在发育的各个阶段都存在的重要基因,如NOTCH和BMP,VWF和VEGF,CCL和CXCL。Y1中OSM和EDA的通讯表明了早期矿化的可能途径。Y2中EC和神经胶质细胞通过FGF1和FGF2与其他细胞类型相互作用,表明FGF1和FGF2可能更多地参与根尖牙乳头的发育。RSPO2在A1中以及THY1在A2中的表达和通讯信号,提示了成熟牙髓中潜在的修复途径。
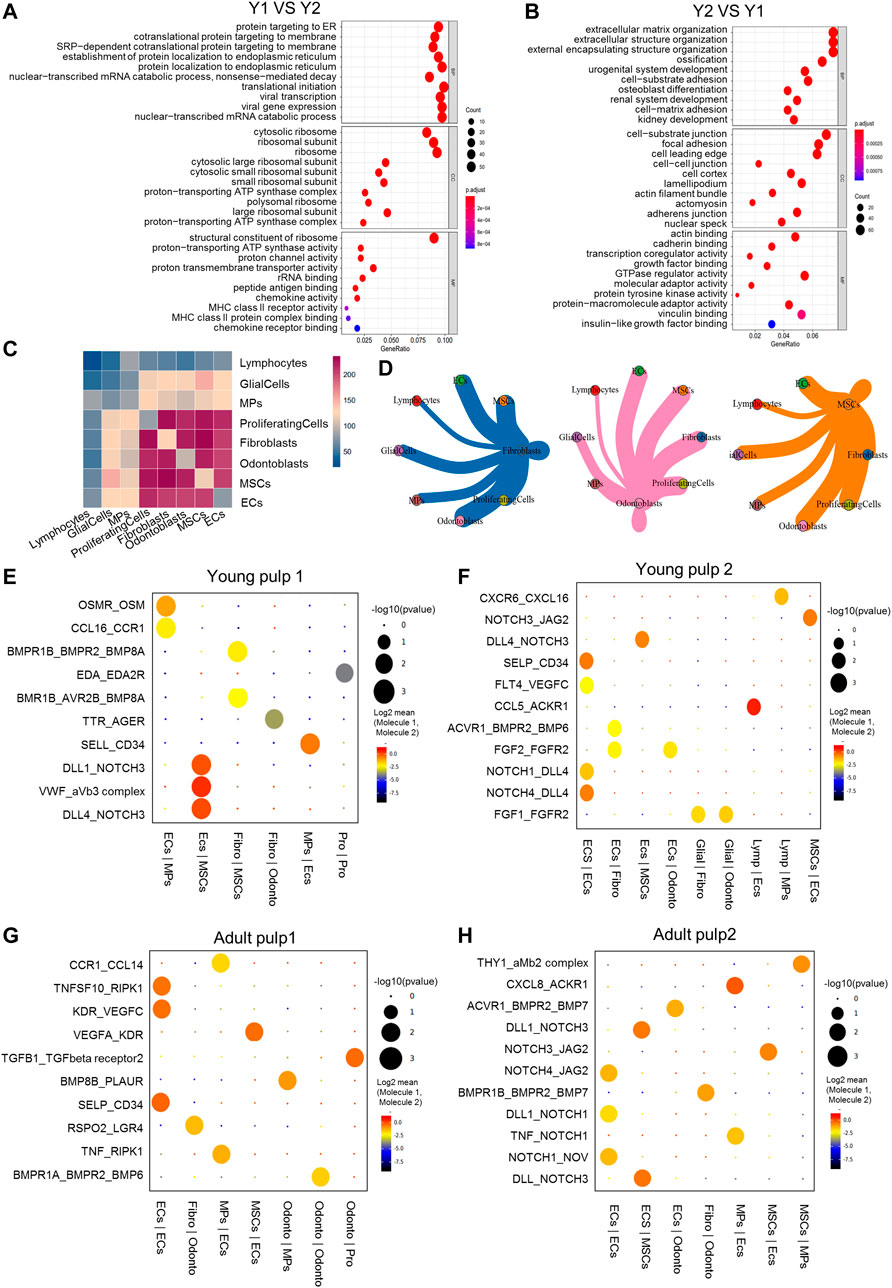
图2 牙髓细胞间的转录差异及细胞间通讯
3. 成纤维细胞亚群特征
成纤维细胞为牙髓内主要的细胞类型,对其进行聚类,分为了5个亚群(C1-C5)。C1细胞几乎全部来自于Y1,表达MIA、RPL17、EEF1G等基因。另外发现,CD24(根尖牙乳头干细胞的特异性基因)在C1、C2和C4中表达。免疫组化染色结果显示CD24仅在发育早期的牙乳头中表达。C2、C3则主要来自除Y1的其他样本,高表达IGFBP5、EFNB2、POSTN基因,这些基因与牙髓的血管生成或牙本质生成有关,表明其可能在人牙髓晚期发育阶段发挥作用。在C5中发现DAPL1等细胞死亡相关基因表达,表明C5中的细胞可能存在潜在损伤。
之后进行了拟时序及GSVA分析,来探究成纤维细胞发育路径及亚群间的功能差异。拟时序分析表明,Y1(C1)作为分化起始时,其他样品来源细胞位于分支末端,但对于亚群C2-C5并无明确的分化排序,另外表征了随发育表达改变的基因。GSVA发现C2-C4表现出“突触”和“神经肽受体活性”相关信息。C1则可能与蛋白质合成、组装功能相关。C5则更多参与调亡过程。
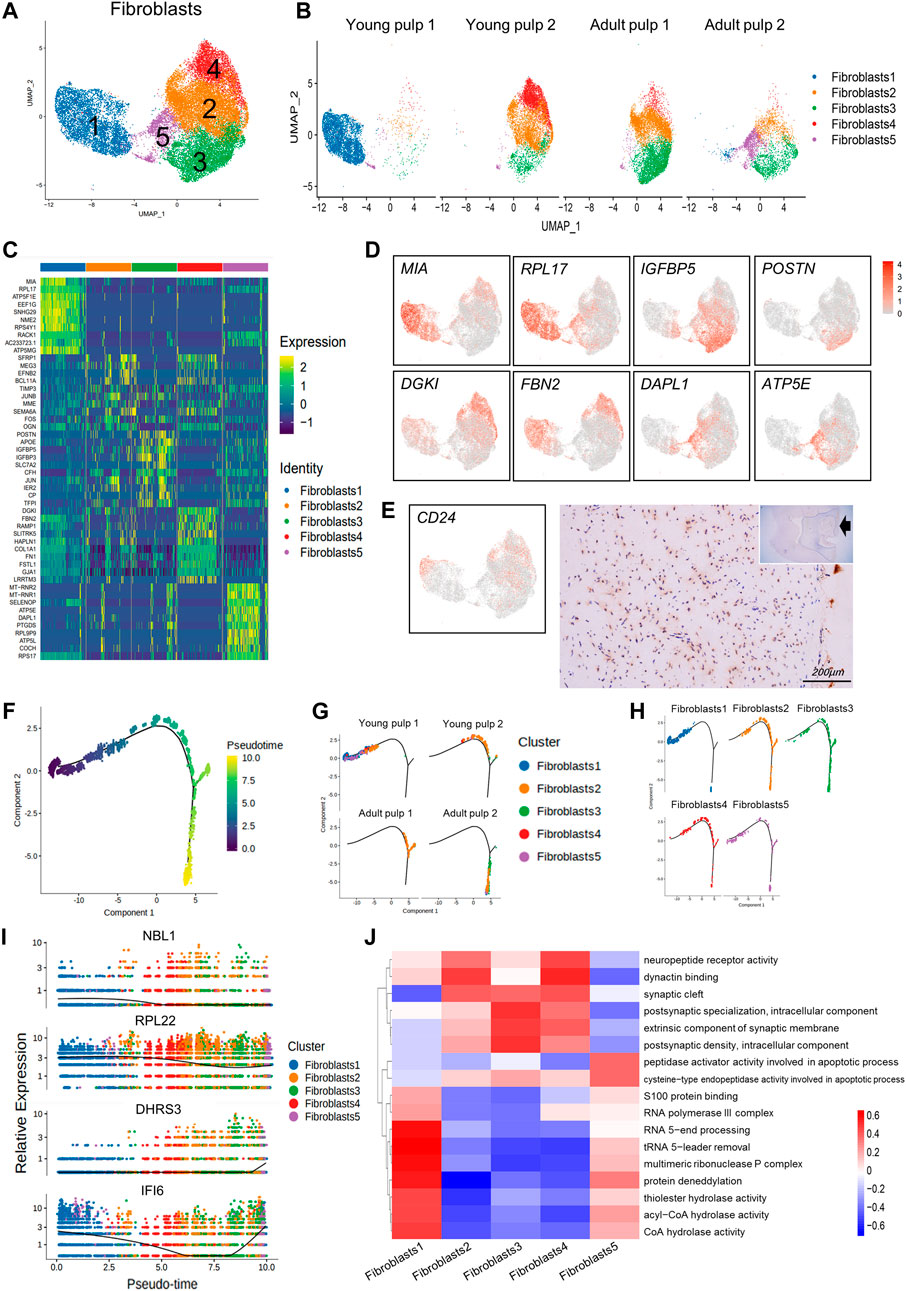
图3 成纤维细胞亚群特征
4. 成牙本质细胞的亚群特征
通过marker基因鉴别出成牙本质细胞并分为4个亚群。其中C1、C2主要来自A1。C3主要来自于Y1和Y2,并高表达PTN,其可能与牙本质早期矿化相关。C4主要来自A2,显示免疫球蛋白kappa(IGKC)基因的较高表达,与成纤维细胞C5表观相似,这表明该簇中的成牙本质细胞也可能受到潜在的损害。拟时序分析结果显示,C3位于分化起点位置,同时Y1来源细胞早于Y2。随着拟时间变化进展,基因S100A6和CLU的表达增加,COL1A2和PTN表达下降。功能分析发现,诸如“质子通道活性”,“受体结合调节”,“胶原结合”和“参与异型细胞-细胞粘附的蛋白质结合”等途径在C3中高度表达,表明年轻的成牙本质细胞可能在各种信号通路的粘附和相互作用中活跃。“调节T细胞介导的细胞毒性”和“参与伤口愈合的血管生成”途径的路径富集结果表明,主要来自于A2的C4可能处于损伤状态。之后使用SCENIC来识别在成牙本质细胞亚群中发挥关键作用的TF。转录因子DLX5和LHX8在C3中富集,与成骨和胚胎发育相关。在C4中,由FOS调节的基因功能与细菌来源分子、机械刺激和脂多糖的反应相关。

图4 成牙本质细胞的亚群特征
5. MSCs亚群特征
具有多重分化潜力和再生能力的MSCs被认为与体内器官组织发育和修复相关。鉴定出的MSCs被分为5个亚群(图5)。其中C1、C2主要来自于Y2、A1和A2,并表达离子调控和细胞骨架形成相关的基因。C3细胞主要来源于Y1,高表达牙齿间充质干细胞marker基因THY1/CD90以及脂质合成和运输相关的基因。C4表达谱类似于成牙本质细胞。推断C3、C4可能是成牙本质细胞的前体细胞(图5B,C)。功能分析表明,C3和C4富集BMP受体结合功能,提示它们与成牙本质细胞分化和矿化有关。在C5中,“SAGA复合物”、“动力蛋白复合物”和“多糖结合”显著表达,可能有助于细胞分裂和转录(图5D)。根据拟时序变化的基因表达模式特征将其划分为新的簇,C1中基因(BMP7,OMD,RUNX2和SP7等)表达与“Wnt信号通路的调节”、“成骨”和“细胞外基质组织”相关,并随Fate2分化后降低。C2、C3中变化的基因与“蛋白质靶向”和“肌肉组织发育”有关,提示在MSC分化过程中出现了两个不同的方向(矿化和肌生成)。同时干性分析表明,间充质干细胞亚群C3-C5有更高的分化潜力。
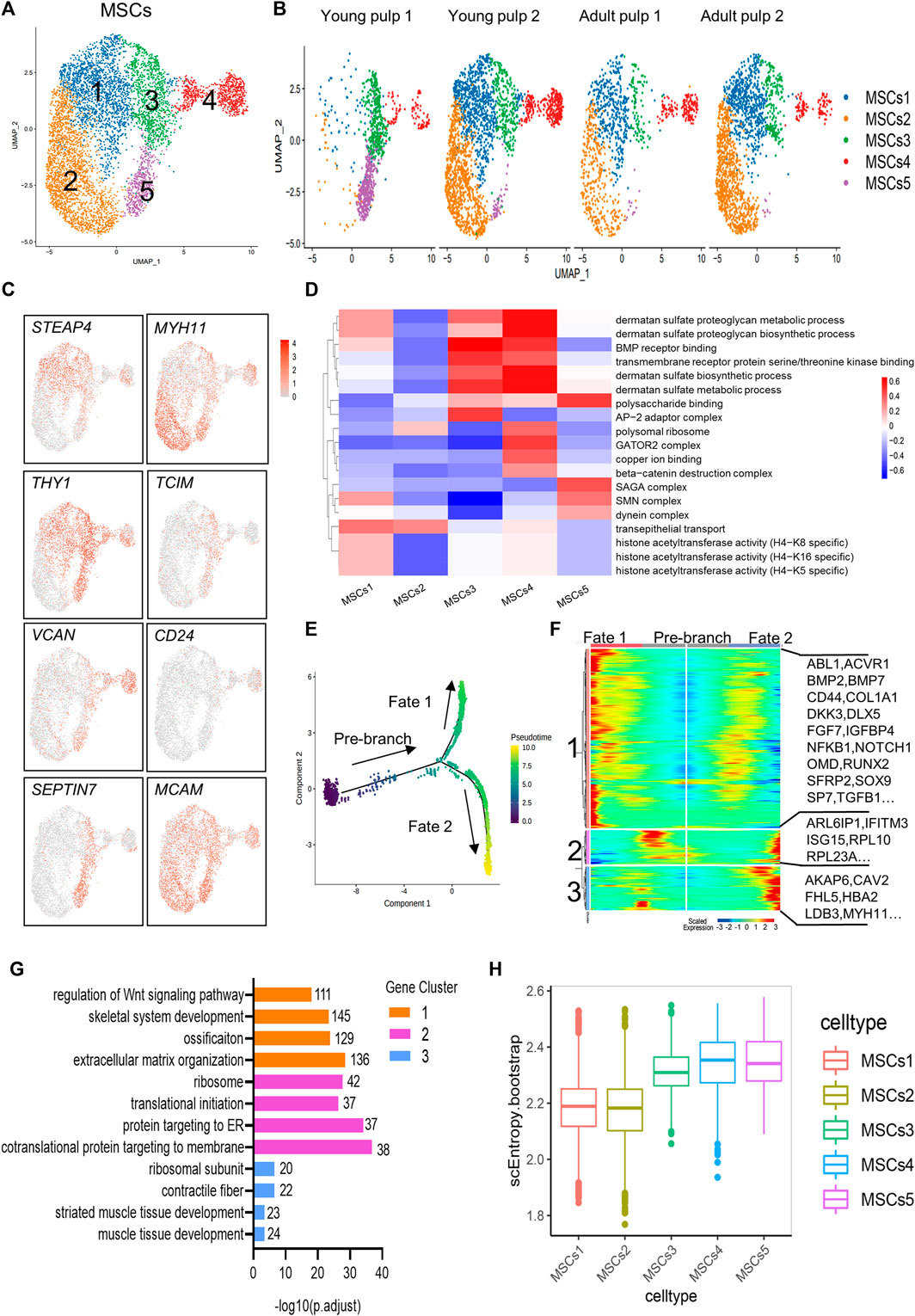
图5 MSCs亚群特征
另外,本文对每个亚群的转录因子进行了分析(图6)。由SOX11,PRRX1和MSX2 TF调节的靶基因在“条纹肌组织发育”、“局灶性粘附”和“细胞迁移或运动的负调节”途径中富集。C5中关键TF FOXF2的下游基因参与了与“牙本质生成”和“BMP信号通路”相关的途径。
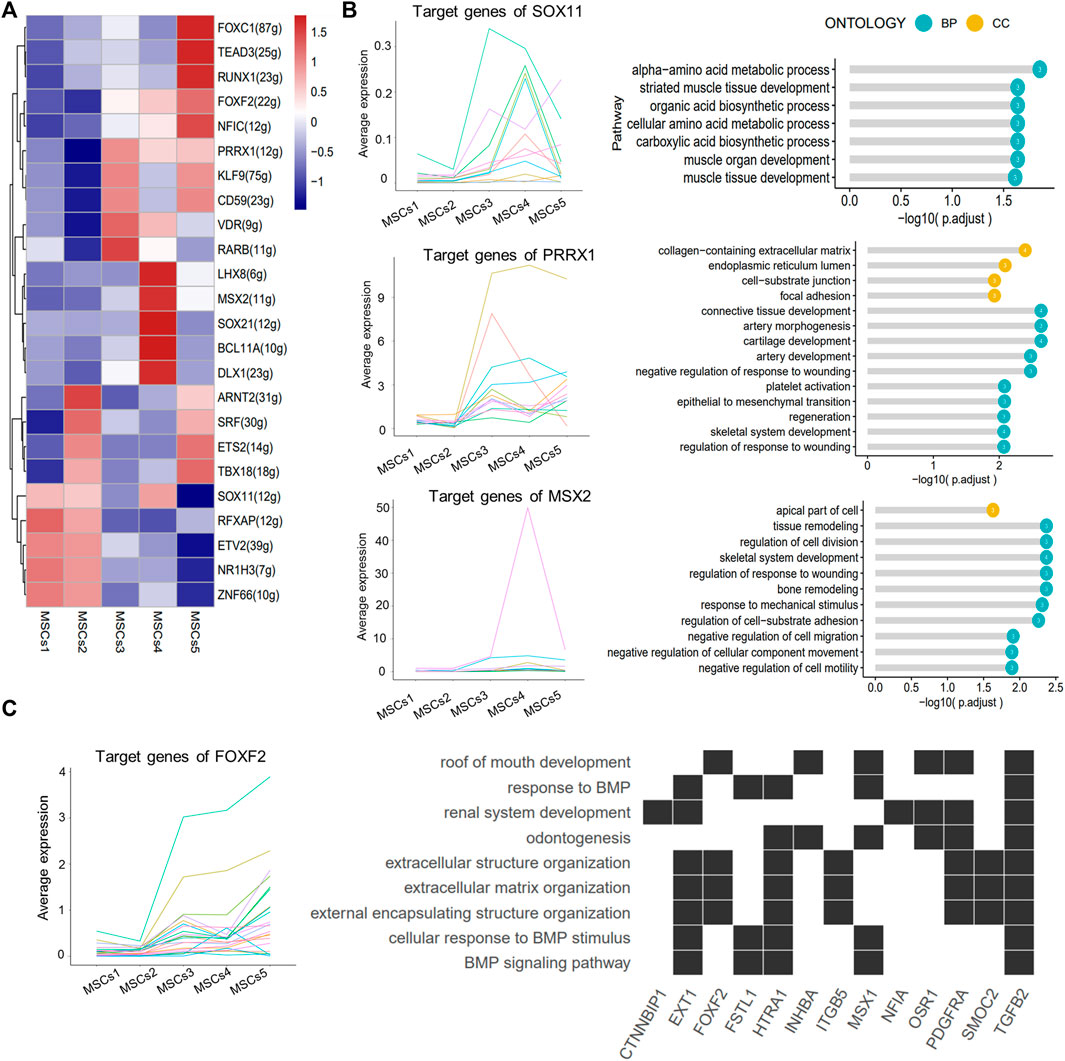
图6 MSCs转录因子分析
结论
此研究对四个不同发育时期的牙髓样本进行了单细胞转录组测序数据分析,探索了牙髓和干细胞的发育。结果揭示了发育过程中牙髓细胞比例、转录特性、功能和细胞通讯的差异。对成纤维细胞、成牙本质细胞和MSCs的组成进行了详细的分析,并确定了这些细胞群内的异质性。同时还鉴定出发育中的成牙本质细胞、潜在的原始干细胞和分化活跃的干细胞群,揭示了牙髓细胞在不同的空间和时间水平上的细胞异质性。这些发现充实了牙齿发育的机制研究,对牙髓细胞的再生工程及提高牙髓再生的成功率提供了新的探究方向。
参考文献
Huihui Ren, Quan Wen, Qingxuan Zhao,et al.Atlas of human dental pulp cells at multiple spatial and temporal levels based on single-cell sequencing analysis. Front Physiol.2022 Oct 4;13:993478.








