1.TCGA数据库相关性分析及Gsdmd-/-小鼠对PD-L1抑制剂的响应情况
作者首先通过公共数据库分析Gasdermin蛋白家族成员在人和小鼠各类免疫细胞中的表达情况,发现Gasdermin D总体表达水平最高,尤其在髓系细胞。在TCGA数据库收集的所有癌症数据中,Gasdermin D的表达与多个免疫检查点分子(如PDCD1、CTLA4及CD244等)表达正相关。此外,通过GEPIA2预后数据库对33种不同癌种的分析发现GSDMD高表达与肿瘤患者总生存期负相关(图1 D-F ACC、LGG及UVM3个癌种的GSDMD表达和患者预后)。
通过检测GSDMD在多个肿瘤细胞系(B16F10、 MC38、GL261 及MCA205)的蛋白表达水平,发现其在B16F10细胞系的水平最低,选择该细胞系研究GSDMD对抗肿瘤免疫抑制的调控作用。构建Gsdmd-/-小鼠并构建黑色素瘤小鼠模型,发现化疗药物奥沙利铂可以提高WT及Gsdmd-/-小鼠抗肿瘤效果,但两组小鼠对化疗药物的响应没有显著差别。Gsdmd-/-小鼠PD-L1阻断治疗效果较野生型小鼠好(肿瘤体积变小,免疫检查点阻断后生存期变长)。流式细胞术分析结果表明GSDMD敲除后I型干扰素及PD-1+TIM-3-T细胞比例上升,TIM-3+及TIGIT+CD8+ T细胞减少,CD4 T细胞、B细胞及NK细胞比例上升。此外表达MHC II的树突细胞及巨噬细胞比例增加,骨髓来源抑制性细胞(MDSCs)比例显著下降。以上结果说明GSDMD缺失可显著提高PD-L1阻断介导的CD8 T细胞抗肿瘤免疫响应。
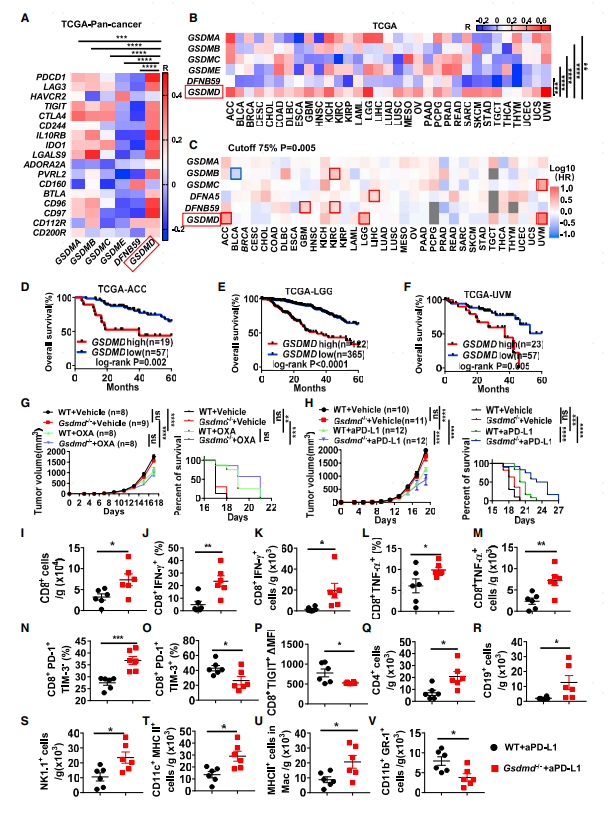
图1 TCGA数据库相关性分析及Gsdmd-/-小鼠对PD-L1抑制剂的响应情况
2.GSDMD缺失可提高肿瘤组织对PD-L1阻断剂的响应
研究人员在ImmGen数据库分析GSDMD在小鼠各类免疫细胞的表达情况,发现其在巨噬细胞和树突细胞中高表达。共聚焦原位成像分析验证了该结果(图2B-C),提示GSDMD通过抗原呈递细胞来抑制PD-L1的抗肿瘤效果。为了验证这一猜想,构建了条件性敲除小鼠(Gsdmdfl/fl、Cx3xr1-Cre)。敲除GSDMD并不会影响肿瘤进展,但是可以提升PD-L1的治疗效果(图2D-E)。流式分析发现这类小鼠肿瘤组织中CD8 T细胞比例显著上升,尤其是IFN-γ+和TNF-α+CD8+ T细胞(图2F-J)。此外CD8 T细胞T-bet、Ki-67及TCF表达水平上升,表现出增强的毒性T细胞及干细胞特征。同样PD-1+TIM-3-非耗竭性CD8 T细胞比例上升,PD-1+TIM-3+耗竭性CD8 T细胞及TIGIT+CD8+ T比例下降(图2N-P)。和此前的结果一致,表达MHC II的树突细胞及巨噬细胞比例上升,MDSCs比例下降。这些研究结果表明抗原呈递细胞表达的GSDMD在PD-L1阻断治疗过程中对效应T细胞及抗原呈递细胞的扩张起负调控的作用。
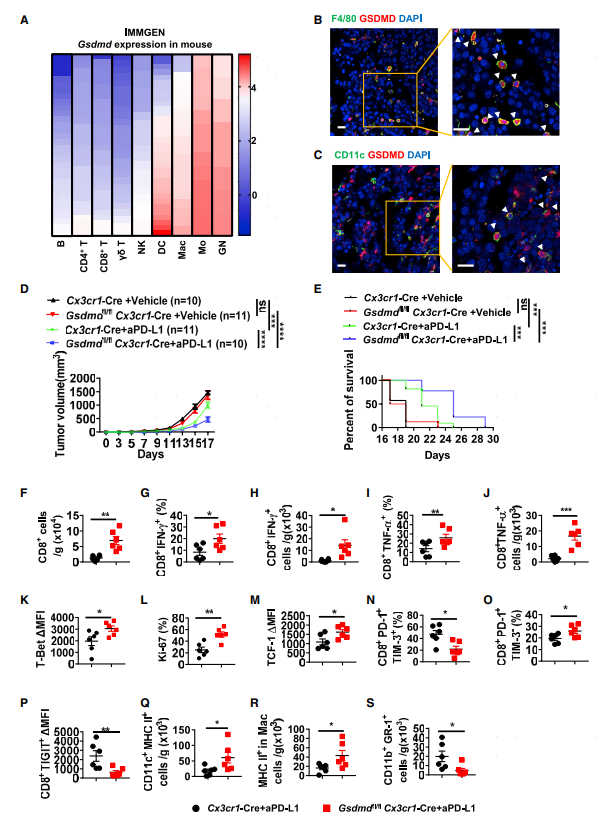
图2 GSDMD缺失可提高肿瘤对PD-L1阻断剂的响应
3.GSDMD缺失通过APC细胞ISG程序促进CD8 T细胞的抗肿瘤免疫
为了阐明GSDMD抑制APC细胞抗肿瘤免疫治疗的分子机制,研究人员从肿瘤组织中分离出免疫细胞进行单细胞测序。无监督分群将TME的免疫细胞分为16个亚群,两组小鼠的免疫细胞在降维图上边界明显,说明它们基因表达特征差异较大。和流式结果一致,GSDMD敲除小鼠高表达和效应T细胞和记忆祖细胞相关的分子。此外MDSCs和迁移性DC细胞比例下降,已有研究表明这些细胞可以抑制CD8 T细胞的抗肿瘤作用。因为CD8 T细胞是肿瘤进展中关键的细胞类型,研究人员进一步分析了它和其他细胞的通讯情况。结果显示Mac-4及migDC这两类细胞和CD8 T细胞的互作评分最高(图3C),巧合的是这两类细胞ISG基因集评分也高于其他细胞类型,且敲除小鼠的ISG表达水平更高(图3E)。另外注意到Mac-4和migDCs这两类细胞是通过抗原呈递相关的受配体与CD8 T进行细胞通讯,先前的研究表明干扰素刺激会促进抗原呈递,这和单细胞分析结果是一致的。GSDMD敲除小鼠的几个免疫细胞亚群比对照组有较高的抗原呈递相关蛋白表达(图3F-G)。分离出髓系细胞用B16F10肿瘤细胞的DNA进行体外实验进行qPCR及流式检测,发现接收肿瘤刺激信号后GSDMD敲除小鼠来源的髓系细胞ISG基因集相关蛋白(图3H-I)及pTBK1和IRF3表达水平升高。以上结果表明GSDMD通过调节APC细胞中ISG的基因表达从而发挥抑制抗原呈递及CD8 T细胞的抗肿瘤作用。

图3 GSDMD缺失通过APC细胞ISG途径促进CD8 T细胞的抗肿瘤免疫
4.GSDMD缺陷可增强PD-L1抑制剂处理时依赖cGAS的抗肿瘤免疫效果
已有的研究表明在结肠炎及F.novicida感染时GSDMD是c-Gas介导的炎症反应的负调控分子。TME的抗原呈递细胞通过吞噬胞外肿瘤DNA分子激活cGAS-STING信号通路,从而诱导ISG的响应。基于这些研究基础,研究人员构建了Gsdmd-/-cGas-/-双敲除小鼠验证GSDMD的促癌作用是否依赖c-GAS。GSDMD敲除小鼠肿瘤体积变小且生存期较长,而双敲除小鼠没有明显的抗肿瘤特征(图4A-B)。和表型结果一致,进一步的流式细胞分析发现双敲除小鼠肿瘤组织中表达INFα和INFγ的CD8 T细胞比例及表达水平都要低于Gsdmd-/-单敲小鼠(图4C-G)。此外,双敲除小鼠中耗竭相关marker如TIM-3及TIGIT表达上调(图4H-J),表达MHC II的DC及巨噬细胞比例也显著下降(图4K-L),而MDSCs细胞比例显著上升(图4M)。这些数据一致表明GSDMD通过抑制cGAS途径来推动肿瘤进展。
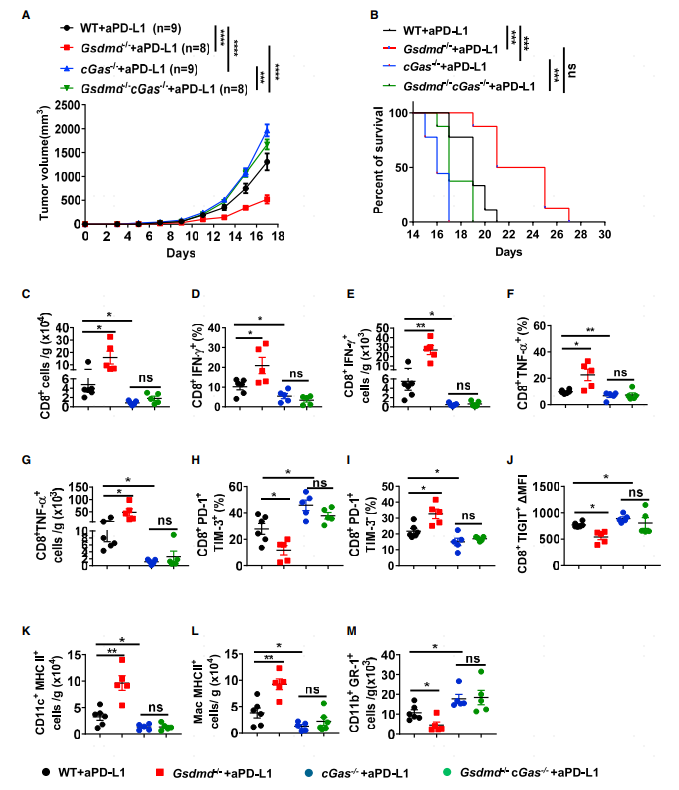
图4 GSDMD缺陷可增强PD-L1抑制剂处理时依赖cGas的抗肿瘤免疫效果
5.药物抑制GSDMD结合PD-L1抑制剂处理显著提高抗肿瘤免疫效果
此前有研究报道富马酸二甲酯(DMF)可以抑制经典细胞焦亡通路中GSDMD被caspase1切割及后续的活化过程。用PD-L1抑制剂联合DMF处理荷瘤小鼠,小鼠的肿瘤体积减小生存期延长(图5A-B)。同时,总CD8 T细胞及产生细胞因子的T细胞比例较PD-L1抑制剂单药处理组上升(图5C-G),且耗竭特征T细胞比例下降(图5H-I)。同时DMF和PD-L1抑制剂联合处理后肿瘤组织中表达MHC II的DC及巨噬细胞比例上升,MDSCs细胞比例下降(图5J-L)。此前有报导mTORC1可以调节GSDMD介导的细胞焦亡途径,作者用mTORC1/2抑制剂AZD2014处理荷瘤的野生型小鼠及Gsdmd-/-小鼠,结果表明阻断GSDMD介导的细胞焦亡途径可提高PD-L1的抗肿瘤效果。

图5 药物抑制GSDMD结合PD-L1抑制剂处理显著提高抗肿瘤免疫效果