SUMO化修饰是一种动态的翻译后修饰,可维持心脏功能,并可保护心脏压力过载的肥厚反应。然而,心肌梗死(MI)后SUMO化修饰的功能以及心脏细胞对SUMO1缺陷反应的分子机制尚未确定。在本研究中,作者构建了SUMO1-/-小鼠模型,通过单细胞核RNA(snRNA-seq)测序揭示了SUMO1在调节心脏细胞中的不同作用。
思维导图

研究结果
1.SUMO1参与MI后的病理过程
为了确定SUMO1是否与MI后的修复反应有关,作者采用免疫组化检测了MI后小鼠心脏切片中SUMO1的水平,MI后7天,梗死区SUMO1水平明显升高(图1A),提示SUMO1参与MI后心脏病理修复过程。然而边界区的SUMO1水平明显降低(图1B)。
为了进一步探索SUMO1对MI后心功能的影响,在MI后7天,对SUMO1-/-小鼠和同批次WT小鼠进行了检测。MI后,与WT小鼠相比,SUMO1-/-小鼠在射血分数(EF)和缩短分数(FS)方面明显表现出更差的心功能(图1C-E)。染色结果也显示, SUMO1-/-小鼠梗死面积更大,心室不良反应更严重(图1F和G)。这些结果表明,心脏SUMO1缺失加重了MI诱导的不良心脏重塑和收缩功能障碍。
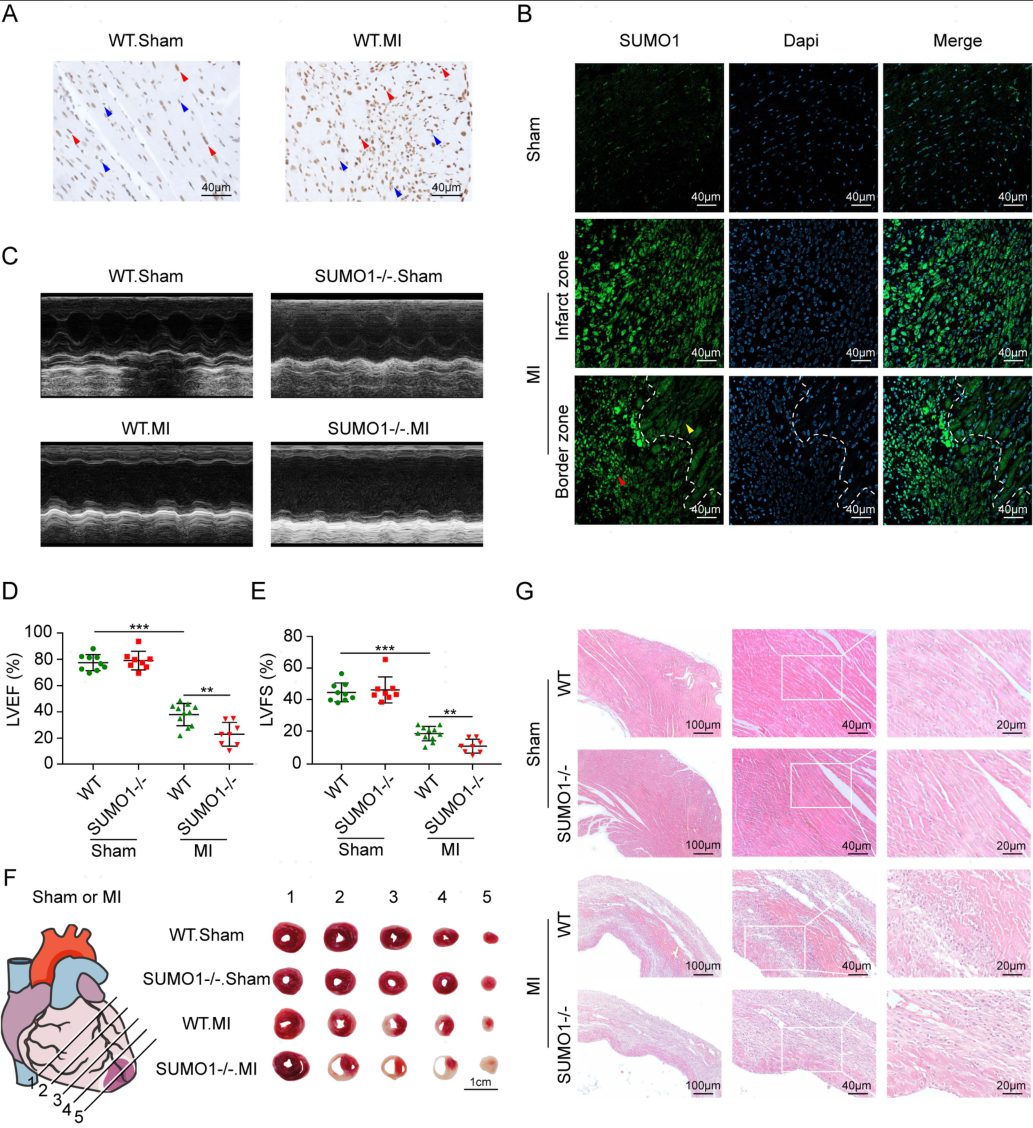
图1 SUMO1参与MI后的病理过程
2.snRNA-seq鉴定四种主要心脏细胞群
MI的病理过程涉及多种细胞类型。作者利用snRNA-seq在假手术或MI后第7天鉴定WT和SUMO1-/-小鼠心脏的细胞群(图2A)。经过筛选和质控,共保留103,806个细胞,根据marker基因分为心肌细胞(CMs)、内皮细胞(ECs)、成纤维细胞(FBs)和单核吞噬细胞(MPs)四种细胞类型 (图2B-E)。这四种细胞的丰度在MI后发生了改变(图2F)。例如,MI后CMs明显丢失,且SUMO1-/-小鼠丢失比例高于WT小鼠,提示SUMO1缺失导致缺血缺氧损伤时CM代偿能力下降。这些结果表明,SUMO1对MI后不同类型的心脏细胞具有不同的调节作用。
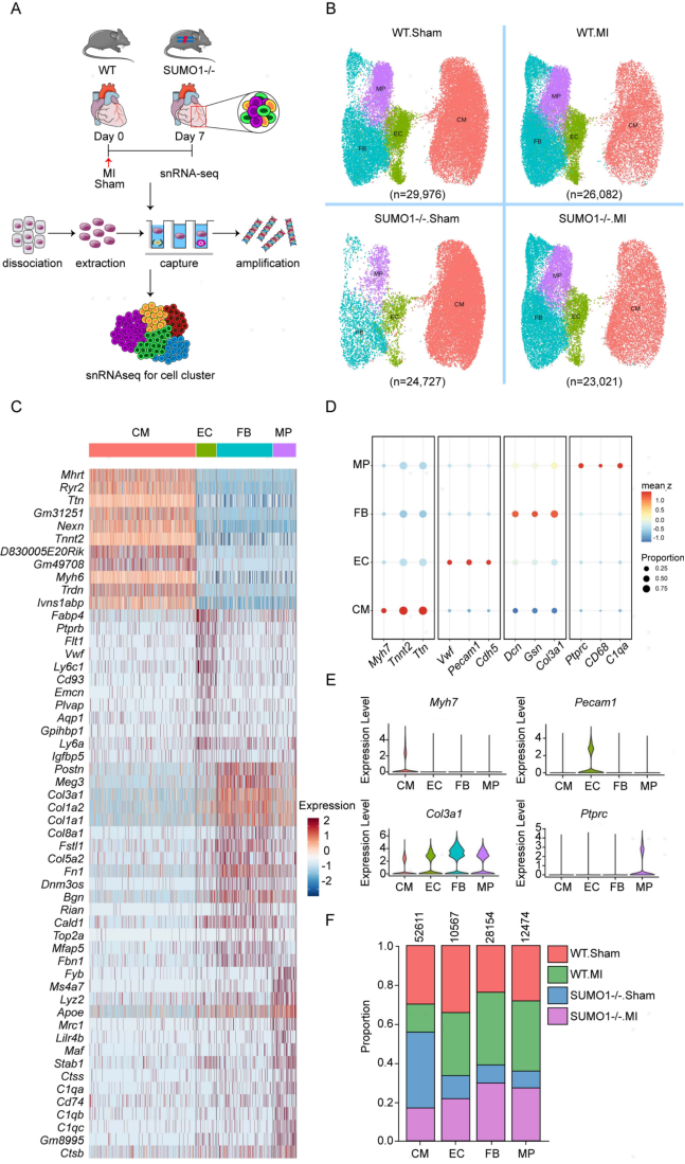
图2 snRNA-seq鉴定四种主要心脏细胞群
3.SUMO1缺失导致MI后Nppa+Nppb+Ankrd1+CM簇比例上升
CMs是决定MI后心脏命运的主要细胞类型,作者将来自所有样本的52,611个CM聚类为6个不同的CM亚群 (图3A)。CM-3簇特异性表达多种应激相关基因(Nppa, Nppb, Ankrd1),这些基因是心脏病预后不良的标志,CM-3簇比例的增加可能表明损伤加重 (图3D和E)。此外,SUMO1-/-小鼠MI后心房钠尿肽(ANP)和脑钠肽(BNP)mRNA水平均高于WT小鼠(图3F)。ANP和BNP水平与局部壁面应力呈正相关,会导致更大的梗死面积。通过免疫荧光染色,作者发现SUMO1-/-小鼠MI后边界区域Ankrd1的表达高于WT小鼠(图3G),提示SUMO1缺失增加了MI后CM-3簇的比例。此外,MI引发了CM-4簇比例的增加,但在SUMO1-/-小鼠中却相反。CM-4簇主要表达干扰素相关基因,可能参与心脏的免疫监测,而SUMO1缺失可能损害这种作用。
TF活性分析显示,CM-3簇显示出应激相关TF的结合活性增加,如AP-1复合物中的Jun亚基(JunB和JunD)和Fos亚基(Fosl1和Fosl2)(图3H)。JunD是CM肥大的负调控因子,在肥大刺激下降低ANP和BNP的表达。作者通过免疫共沉淀检测MI后JunD与SUMO1的结合丰度。MI后,SUMO1的磷酸化水平和JunD的表达水平都降低了。与WT小鼠相比,SUMO1的缺失导致MI后JunD的表达进一步降低(图3I)。SUMO1与JunD结合的减少导致JunD稳定性降低,从而增加了MI后Nppa/Nppb的转录。这些结果表明,SUMO1主要通过调控边界区CM-3簇参与心肌损伤。敲除SUMO1基因后,CM-3簇比例增加,心肌损伤相关基因表达水平增加,JunD参与了这一过程。
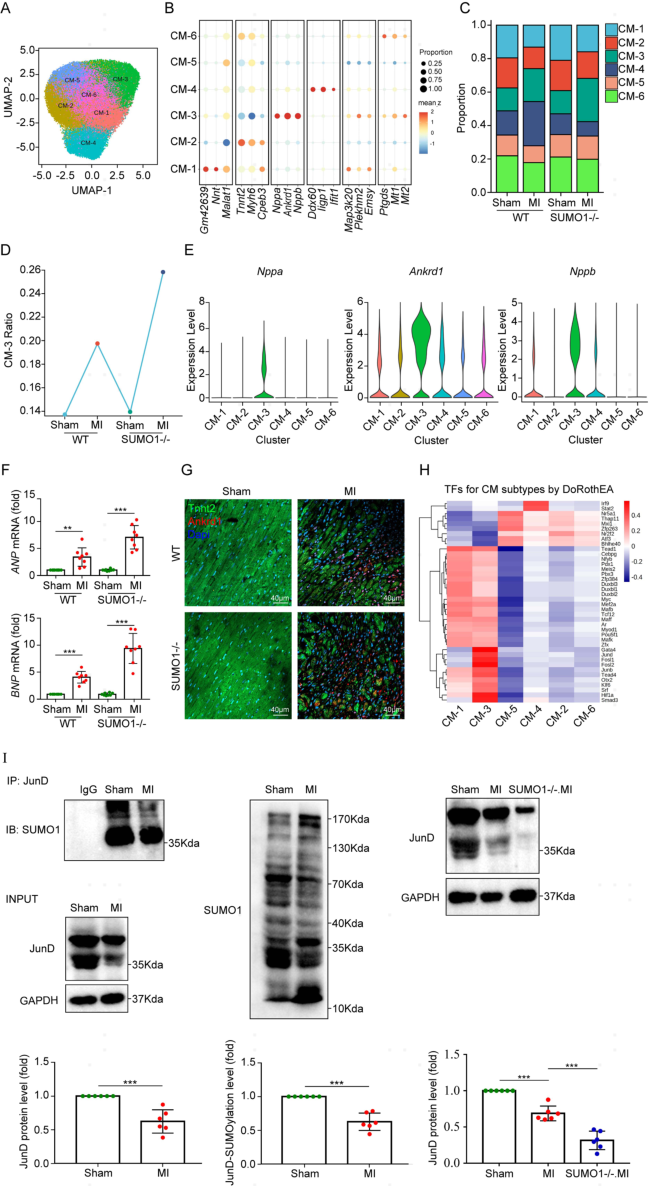
图3 SUMO1缺失导致MI后Nppa+Nppb+Ankrd1+CM簇比例上升
4.SUMO1基因的缺失抑制了MI后增生性FB簇向胶原分泌FB簇的转化
为了探索FB亚群在MI后心脏重塑中的作用,作者将FBs细分为8个簇(FB1-8),MI后,FB亚群大幅增殖 (图4B)。作者使用CytoTrace分析FBs的分化轨迹,结果显示,FB-2和FB-5簇(Postn、Col1a1和Col1a2低表达)是初始状态FBs亚群, FB-3和FB-6簇(Col1a1, Col1a2和Col3a1高表达)是终末期FBs。与WT小鼠相比,MI后SUMO1-/-小鼠的FB-3和FB-6簇的比例有所降低。然而,FB-4簇的比例显著增加,FB-4簇处于分化中间状态,高表达增殖相关基因,表明其处于增殖状态。使用Top2a和III型胶原进行免疫荧光染色显示,与WT小鼠相比,SUMO1缺失导致MI后梗死区FB大量增殖,但胶原分泌减少(图4G)。I型和III型胶原免疫组化染色显示,SUMO1缺失减少了MI后胶原分泌。作者发现SUMO1缺失引发梗死区部分破裂,提示修复能力不足(图4H)。这些发现表明,多个FB亚群参与了MI后修复反应,SUMO1缺失抑制了FBs从增殖状态向胶原分泌状态的分化。
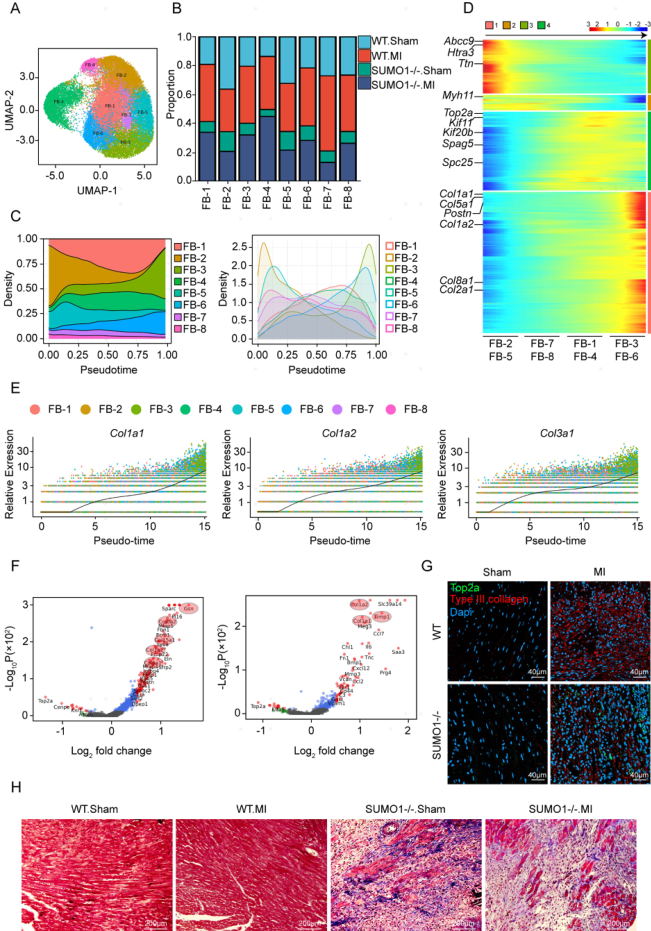
图4 SUMO1基因的缺失抑制了MI后增生性FB簇向胶原分泌FB簇的转化
5.SUMO1缺失促进MI后具有血管再生能力的EC亚群增殖
心肌损伤后梗死部位新生血管网络的重建和恢复对改善MI的预后至关重要。MI后的血管稳态和新生血管是由ECs调节的。作者将ECs分为9个不同的EC亚群 (图5A)。MI后EC-2、EC-5、EC-8和EC-9比例增加,而EC-1和EC-3比例相对Sham组减少,说明MI后EC亚群参与不同功能(图5B)。差异基因分析显示,EC-2簇高表达冠状动脉EC标记物Fabp4以及组织修复和血管生成标记物Sparcl1,表明EC-2簇可能在心肌损伤的血管重建过程中充当冠状动脉ECs。EC-5簇主要表达激活ECs亚群标记物Selp和Rasa4。EC-7簇表达Sema3g,参与血管发育、血管生成和心肌缺血缺氧时新血管的重塑。利用Monocle拟时序分析EC亚群的发育轨迹,作者发现MI诱导EC分化,而SUMO1缺失进一步促进EC分化,因为SUMO1-/-组聚集在终端状态(图5D和E)。具体来看,SUMO1缺失增加了MI后EC-2、EC-5、EC-7和EC-9簇的比例,这些亚群主要负责EC激活、冠状动脉/小动脉血管重建和再生,有利于MI后的心功能恢复(图5G)。
为了进一步探讨SUMO1缺失对MI后ECs的影响,作者用Pecam1和Ki67进行免疫荧光染色。结果显示,SUMO1缺失促进了Ki67+ ECs在MI后梗死区的分布。此外,Pecam1和α-SMA的免疫荧光结果显示,SUMO1缺失导致梗死区大量小血管形成(图5H)。这些结果表明,SUMO1缺失有利于EC增殖,从而促进梗死区新生血管的形成。

图5 SUMO1缺失促进MI后具有血管再生能力的EC亚群增殖
6.SUMO1通过抑制VEGFA信号来阻止新生血管形成
为了进一步研究心脏中不同细胞类型之间的通信网络,作者使用CellPhoneDB进行了全面和系统的分析(图6A)。EC2、EC-5和EC-9簇作为负责EC激活、冠状动脉/小动脉血管生成和重建的EC亚群,受到CMs分泌的VEGFA的调控(图6C)。为了研究SUMO1缺失是否促进VEGFA介导的EC增殖,作者将SUMO1沉默(siSUMO1)和SUMO1过表达质粒转染人脐静脉EC(HUVECs)(图6D和E)。在体外实验中,SUMO1的沉默显著增强了VEGFA诱导的HUVECs的增殖和迁移能力(图6F和G)。为了进一步确定SUMO1是否介导VEGFA的血管生成信号,作者进行了基质管形成实验。在HUVECs中,SUMO1的沉默显著促进了VEGFA诱导的EC小管形成,而过表达SUMO1则导致了小管和分支数量的减少(图6H和I)。此外,SUMO1基因沉默增加了VEGFA介导的HUVECs G2/M比例(图6J和K)。这些发现表明,VEGFA促进EC增殖的作用被SUMO1抑制,这不利于MI后的血管新生和血管重建。
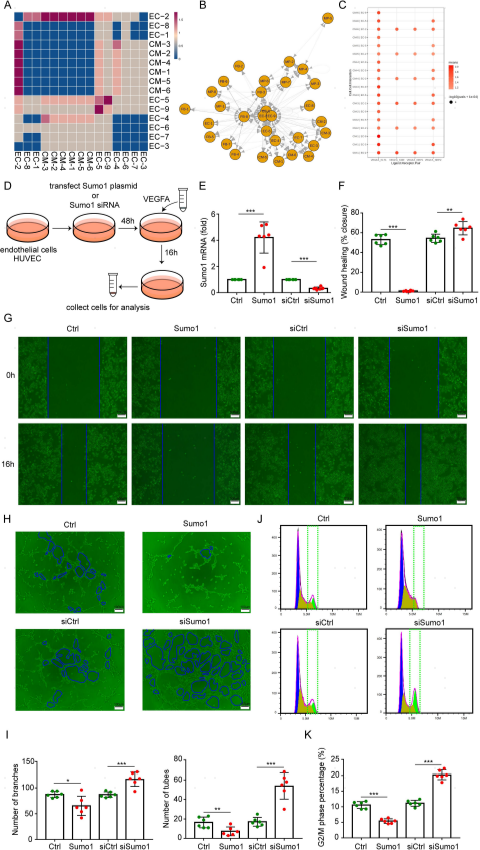
图6 SUMO1通过抑制VEGFA信号来阻止新生血管形成
7.CM特异性SUMO1基因治疗减弱MI后的病理反应
为了确定CM特异性SUMO1基因治疗是否是一种有效的预防性治疗策略,作者在8周龄小鼠尾静脉注射腺相关病毒(AAV),21天后进行MI或假手术(图7A)。与AAV-CTnT-EGFP对照组相比,AAV-CTnT-SUMO1转导小鼠对MI诱导的异常心功能更有抵抗力,心功能障碍显著减少,心肌损伤程度也较低(图7B和C)。与对照组相比,CM特异性SUMO1过表达显著降低MI后ANP和BNP mRNA水平(图7E)。苏木精、伊红和Masson染色显示,与对照组相比,AAV-CTnT-SUMO1转导小鼠MI后梗死面积更小,心室重塑改善,纤维化水平显著降低(图7F和G),且AAV-CTnT-SUMO1转导小鼠的边界区域CM面积显著减小(图7H)。免疫荧光结果显示,AAV-CTnT-SUMO1转导小鼠在梗死区周围表现出更少的Ankrd1+CMs和更高的JunD+CMs分布(图7I)。这些结果表明,在病理条件下SUMO1在CMs中过表达可以缓解心脏重构,增强心脏功能。

图7 CM特异性SUMO1基因治疗减弱MI后的病理反应
结论
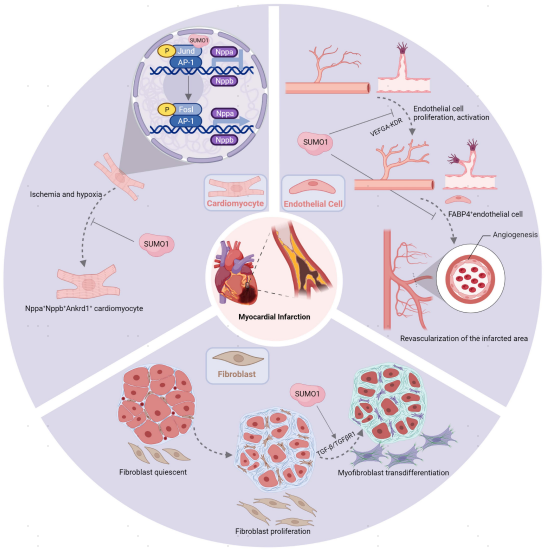
该研究确定了SUMO1在心肌损伤后心脏修复过程中的作用,并描述了SUMO1在MI后不同类型的心脏细胞(包括CMs、FBs和ECs)中的功能。在高分辨率下确定了SUMO1的缺失触发了不同类型细胞的转录谱,并表明SUMO1通过不同的信号通路参与MI后的心脏重塑。该数据集也为进一步研究SUMO1对MI后不同心脏细胞亚群的调节作用提供了宝贵的资源。
参考文献
Z. Liu, X. Liu, L. Liu, et al. SUMO1 regulates post-infarct cardiac repair based on cellular heterogeneity, Journal of Pharmaceutical Analysis, https://doi.org/10.1016/j.jpha.2022.11.010.








