肝纤维化是日本血吸虫病患者的不良结局,极大影响病人的生活质量乃至生存时间。沉积在肝脏中的虫卵是日本血吸虫病肝纤维化的主要致病因素。然而,血吸虫病中肝纤维化的机制尚不明确,目前尚无预防和治疗血吸虫诱发肝纤维化的有效措施。单细胞层面研究血吸虫病的内在机制可以为该病的早期预防和后续治疗提供新思路和潜在新靶点。
项目文章 | 单细胞测序剖析血吸虫感染后小鼠肝纤维化的免疫网络
发布时间:2023-01-31 10:18:46
2022年12月,中南大学湘雅三医院在学术期刊上发表题为“Single-cell RNA sequencing to dissect the immunological network of liver fibrosis in Schistosoma japonicum-infected mice”的研究成果。文章使用单细胞测序深入研究剖析了日本血吸虫感染小鼠肝脏纤维化的免疫网络。
本研究中使用新格元PythoN®组织解离仪完成组织解离,Singleron Matrix®自动化单细胞测序文库构建系统与单细胞转录组(GEXSCOPE®)建库试剂盒完成细胞分离、核酸捕获与文库构建,使用新格元CeleScope®(https://github.com/singleron-RD/CeleScope)开源软件完成测序下机数据定量。
下面和元小新一起来看一下单细胞如何剖析血吸虫感染后小鼠肝纤维化的免疫网络的吧~
研究背景
思维导图
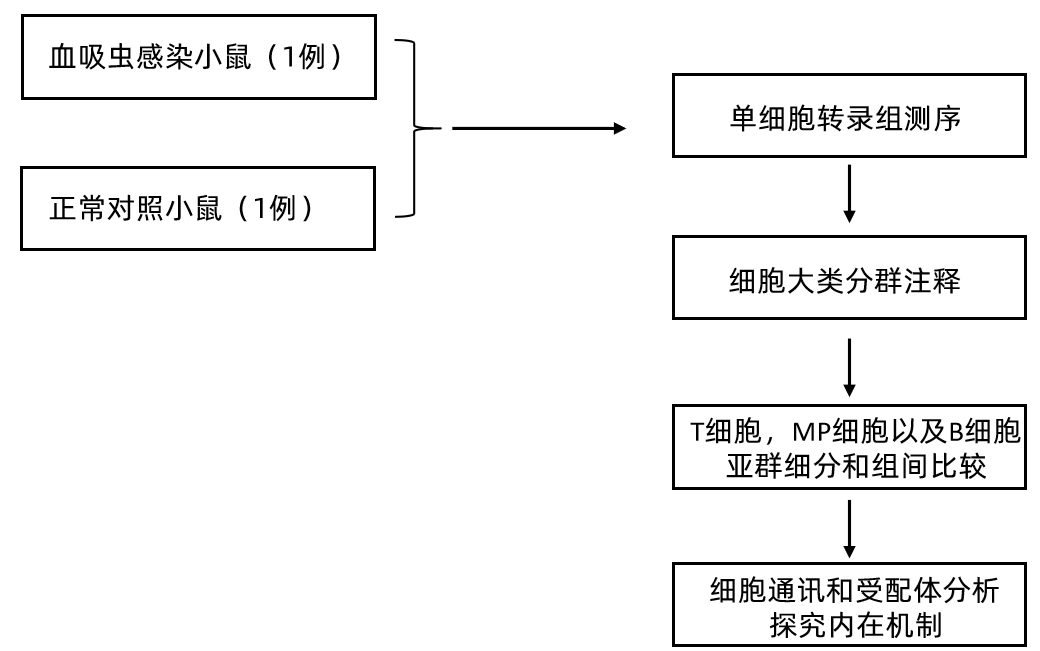
研究结果
1.血吸虫小鼠肝脏(SJ)和正常对照小鼠(HC)肝脏的单细胞细胞大类分群概述
作者选取一只6周大C57小鼠经皮感染血吸虫尾蚴构建血吸虫肝纤维化模型,在感染后的第11周取样进行单细胞捕获,同时取1只健康小鼠取样作为对照。在进行质控后,一共获得10,403个细胞用于后续分析,其中HC组5824个细胞而SJ组4579个细胞。T-SNE分群共展示出18个细胞亚群,且两组样本之间细胞分布存在明显差异(图1B)。小提琴图展示各亚群的关键marker基因(图1C),并将18个亚群进行注释,包括T细胞、B细胞、内皮细胞以及MP细胞等(图1D)。各亚群在HC和SJ组的分布也存在显著差异,SJ组中主要是T cell-1、MP-2和MP-4,而HC中主要是MP-1、MP-3和Hepatocyte-1(图1E)。
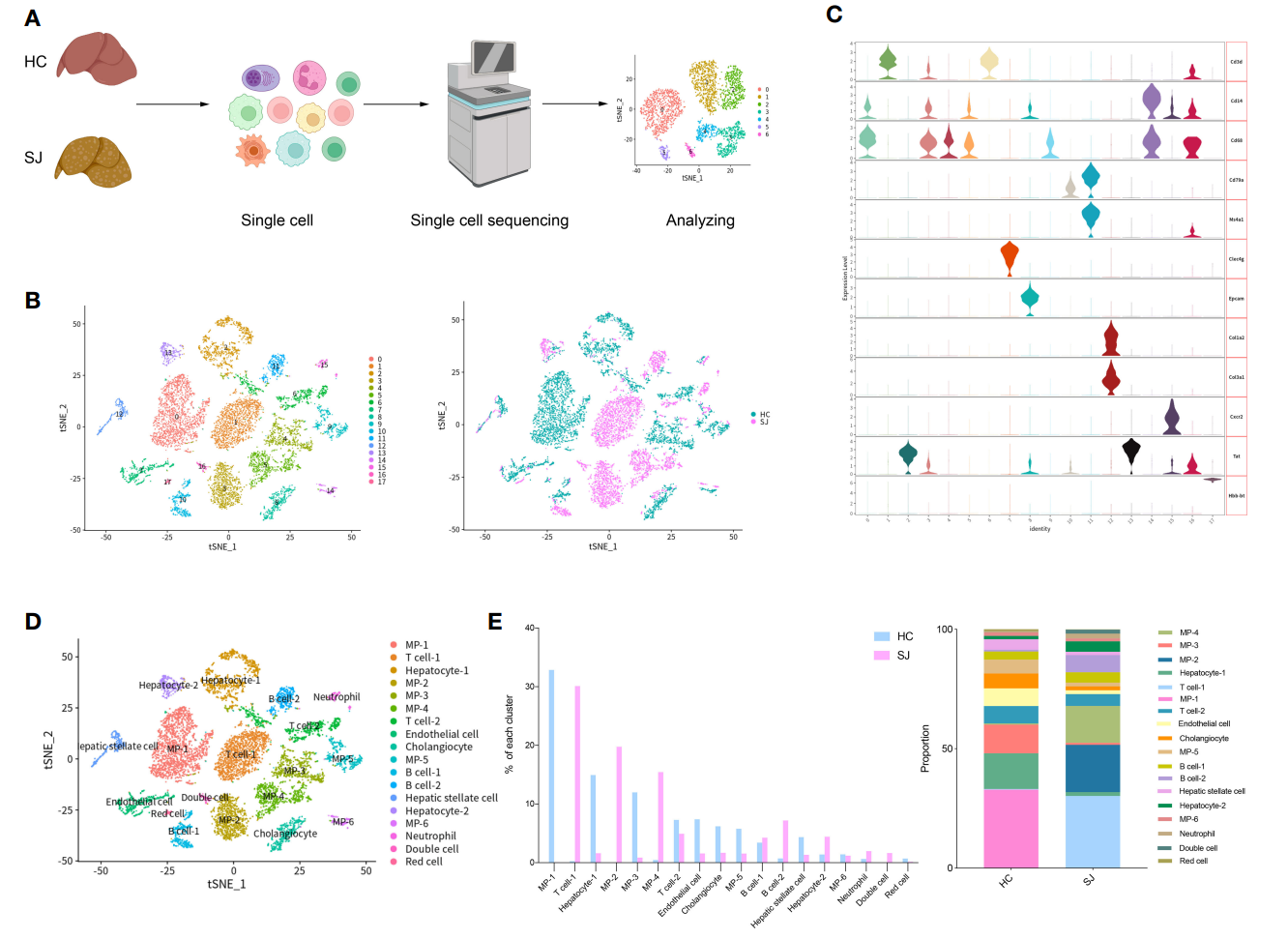
图1 血吸虫小鼠肝脏(SJ)和正常对照小鼠(HC)肝脏的单细胞大类分群概述
2.日本血吸虫病纤维化肝脏中的Th2细胞和NKT细胞变化
为了研究血吸虫感染后肝脏纤维化的免疫微环境变化,作者首先对T细胞进行了进一步亚群细分,可以分成6个不同的T细胞亚群,且T细胞亚群分布在SJ组和HC组之间呈现极大的异质性(图1A)。差异基因列表展示了不同T细胞亚群的Top10差异基因(图2B)。小提琴图展示结果表明所有的T细胞亚群都表达T细胞经典标志物Cd3d,而细胞毒性T细胞标志物Cd8a则主要表达于T(0)、T(1)和T(2);T helper细胞标志物则主要表达于T(4);Gata3和IL4也主要在T(4)中表达,而Prf1则只表达于T (5)(图2C)。组间细胞占比显示SJ组主要包含T(0)、T(1)、T(2)、T(4)和T(5)亚群,HC组则主要是T(2)和T(3),且T(4)和T(5)亚群只存在于SJ组中(图2D)。KEEG信号通路分析显示T(5)亚群和其它T细胞亚群的差异基因主要富集于自然杀伤细胞介导的细胞毒性和趋化因子信号通路(图2E)。这些结果表明血吸虫导致的肝脏纤维化可能与自然杀伤T细胞介导的细胞毒性高度相关。
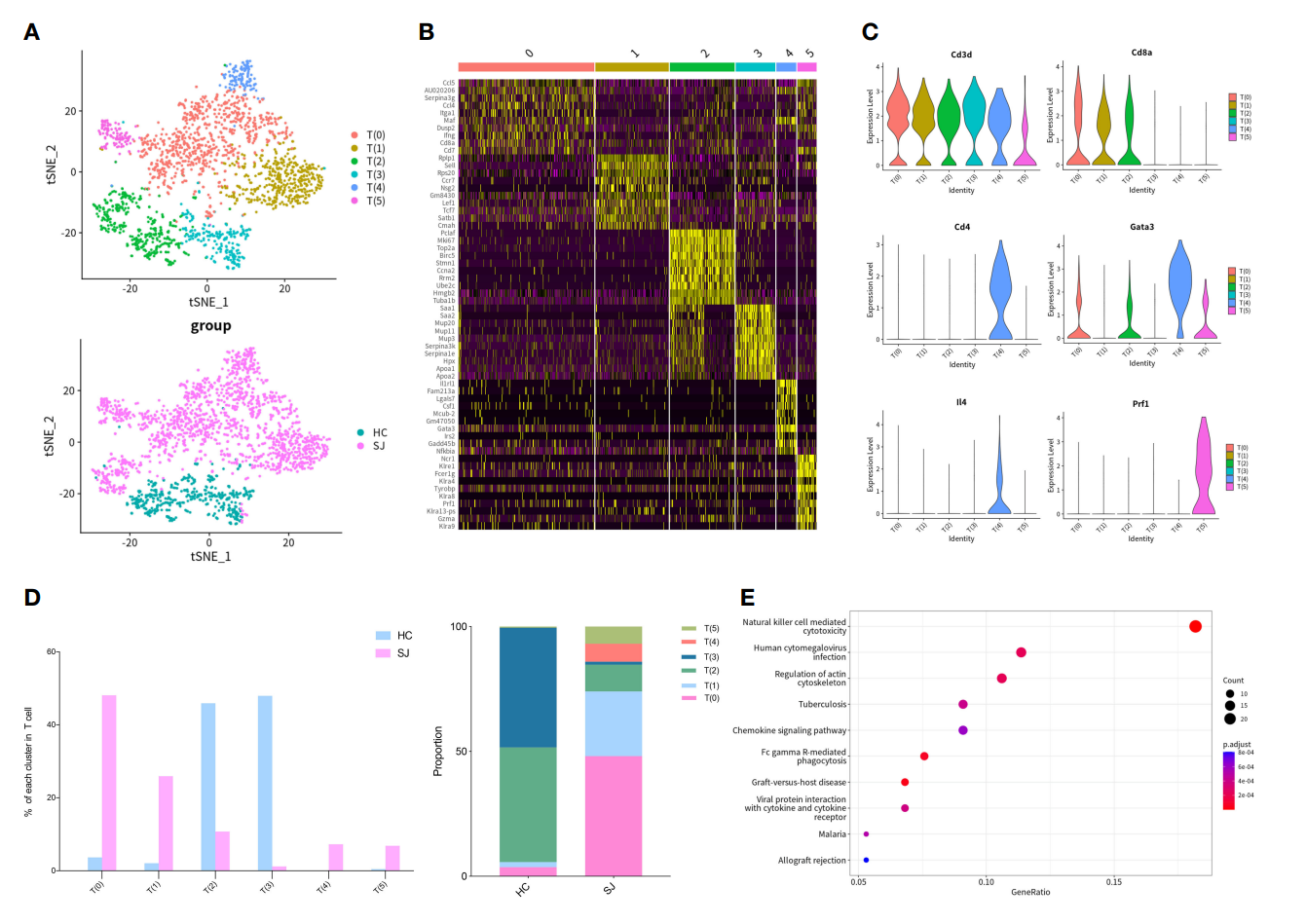
图2 日本血吸虫病纤维化肝脏中的Th2细胞和NKT细胞变化
3.日本血吸虫病纤维化肝脏中巨噬细胞的M2样极化
进一步地,作者对单核吞噬细胞进行了亚群细分,分成了7个亚群,SJ组和HC组之间同样显现出极大的异质性(图3A),之后对各亚群差异Top10基因进行了展示(图3B)。Cd14和CD68是单核吞噬细胞的表面标志物,小提琴图展示显示出Cd14在除了MP(5)的所有亚群都表达,同时CD68在所有亚群都表达;Kupffer细胞的标记物Cd163、Marco、Timd4和Adgre1,在MP(0)、MP(1)、MP(4)和MP(6)亚群中高表达;CCR2主要在MP(1)、MP(2)、MP(3)和MP(5)亚群中表达,但Cxcl9则只表达于MP(1)和MP(3)亚群中(图3C)。MP(1)还高表达交替活化的巨噬细胞marker如Arg1、Retnla和Chil3(图3D)。组间比较表明SJ组中主要是MP(1)和MP(3),而HC组中则没有MP(1)亚群(图3E)。KEEG信号通路分析显示MP(1)亚群与其它MP细胞亚群的差异基因主要聚类于NOD样受体信号通路、溶酶体和吞噬体信号通路等(图3F)。
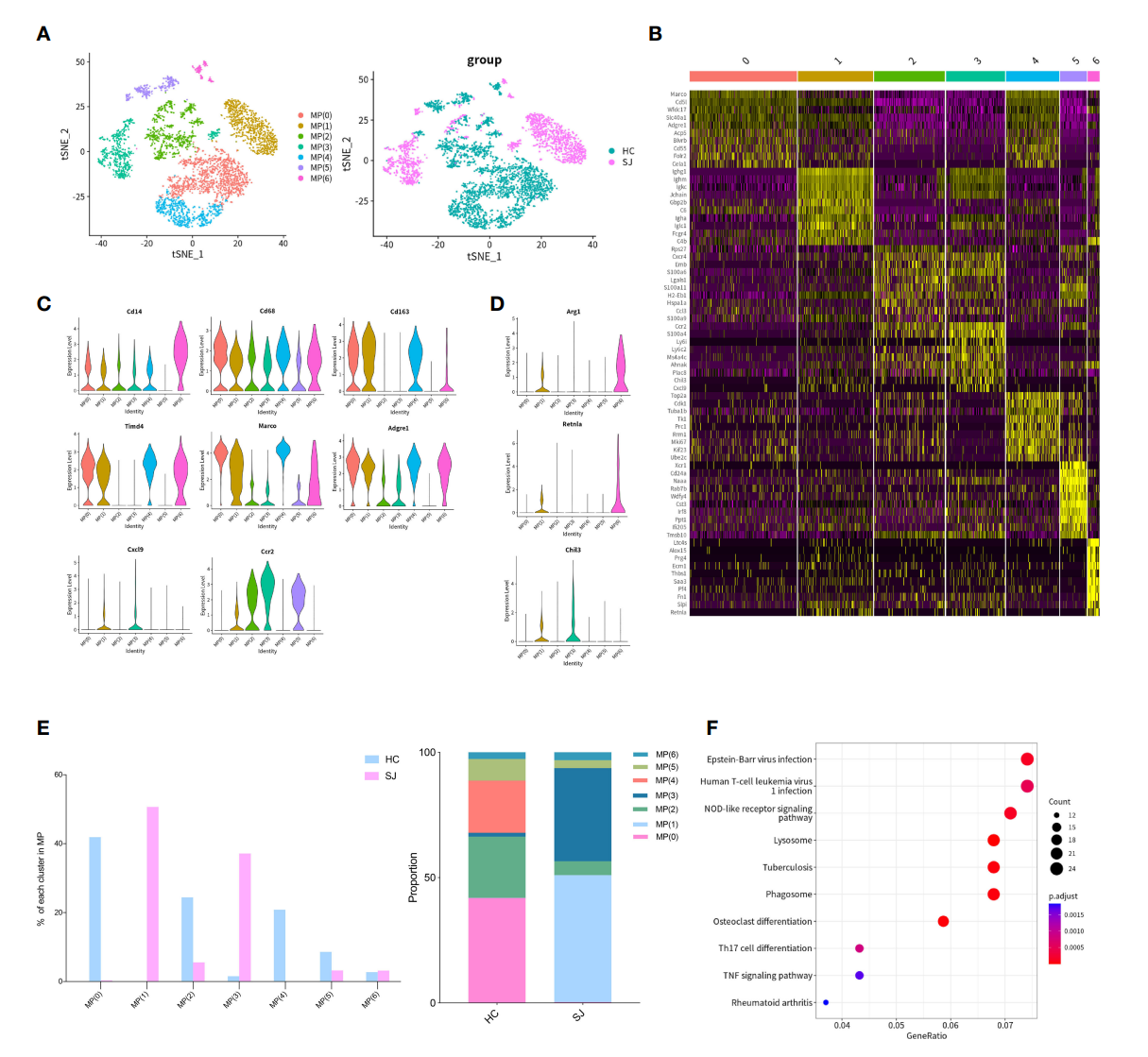
图3 日本血吸虫病纤维化肝脏中巨噬细胞的M2样极化
4.日本血吸虫病纤维化肝脏中的B细胞变化
在此基础上,作者进一步对B细胞进行了亚群细分,769个B细胞可分为5个亚群,并且同样的,B细胞亚群在SJ组和HC组之间显示出巨大差异(图4A),作者之后对5个不同亚群的Top10差异基因进行了热图展示(图4B)。Ighm和Cd79a在所有B细胞亚群中均表达,但是Cd19和Ighd则主要在B(0)和B(4)亚群中表达,同时作者将高表达Prdm1、Sdc1和Irf4的B(1)、B(2)和B(3)亚群定义为浆母细胞(图4C)。组间细胞占比分析显示SJ组中主要是B(0)和B(1)亚群,而HC组中则主要是B(0)、B(2)和B(3)亚群(图4D)。B(1)亚群与其它B细胞亚群的差异基因富集显示其主要与内质网中的蛋白质加工和蛋白质运输相关(图4E)。
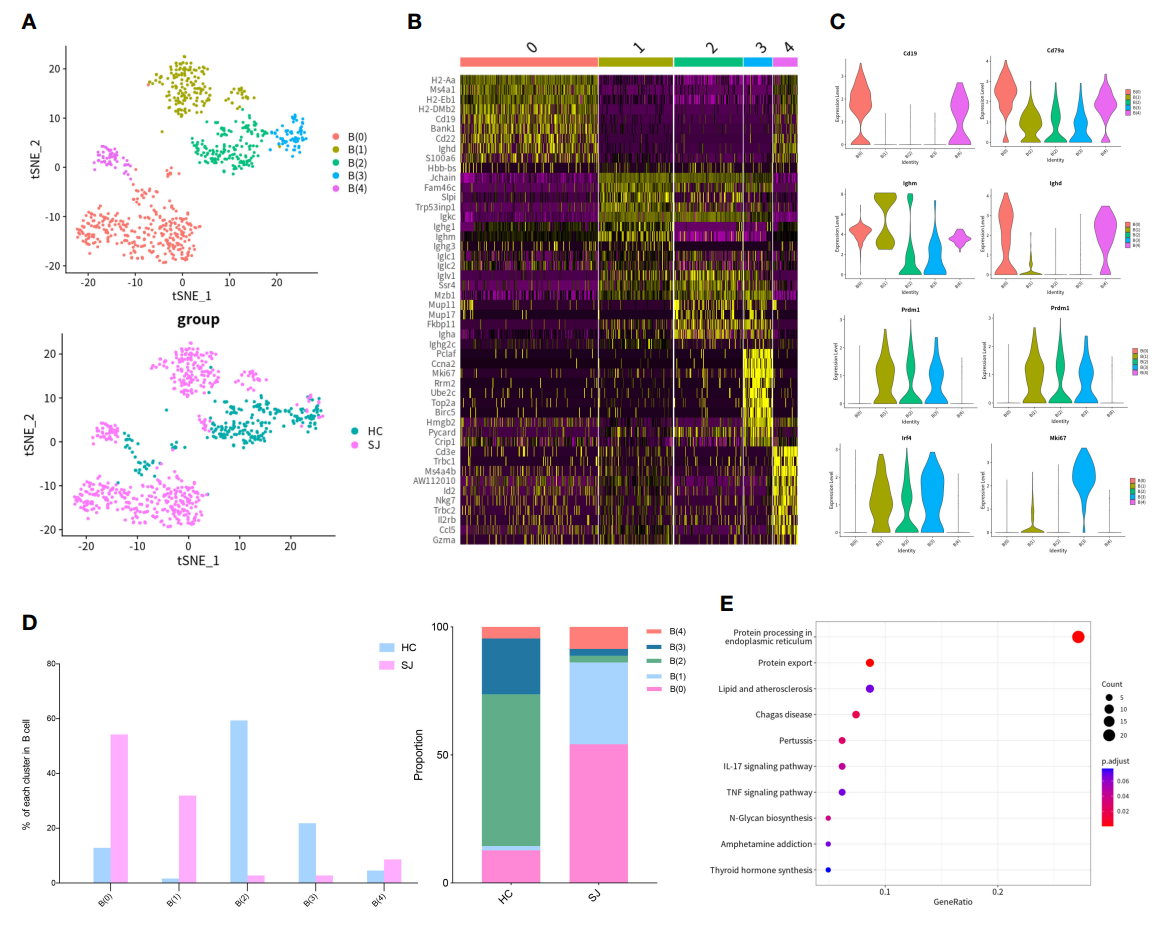
图4 日本血吸虫病纤维化肝脏中的B细胞变化
5.日本血吸虫病纤维化肝脏中的CXCL和CCL信号通路网络
细胞浸润促进了血吸虫病中肉芽肿和肝纤维化的形成。为了更好地了解细胞间通信,作者使用CellChat探索了CXCL和CCL信号通路。图5A显示了不同细胞簇之间关于CXCL信号通路的细胞-细胞通信网络,而圈线图显示出Cxcl16-Cxcr6是CXCL信号通路中受配体对中最显著的相互作用(图5B,5C)。在此基础上,作者还分析了CCL信号通路(图5D),结果表明,Ccl6-Ccr2和Ccl5-Ccr5是CCL信号通路的最显著的相互作用受配体对(图5E-F)。气泡图表明T细胞与MP之间通过CXCL和CCL信号通路具有密切的关系。作者进一步探讨了主要趋化因子和趋化因子受体在T细胞和MP上的表达。CCL6主要在MP(6)中表达,而T(5)则高表达CCL3、CCL4和CCL5;Cxcr6主要表现在T(4)中,而Ccr2主要在MP(3)中表达;而MP(1)和T(5)则主要表达Ccr5(图5G)。与正常肝脏相比,纤维化的肝脏中其Cxcl16-Cxcr6、Ccl6-Ccr2andCcl5-Ccr5受配体相互作用显著增强(图5H)。
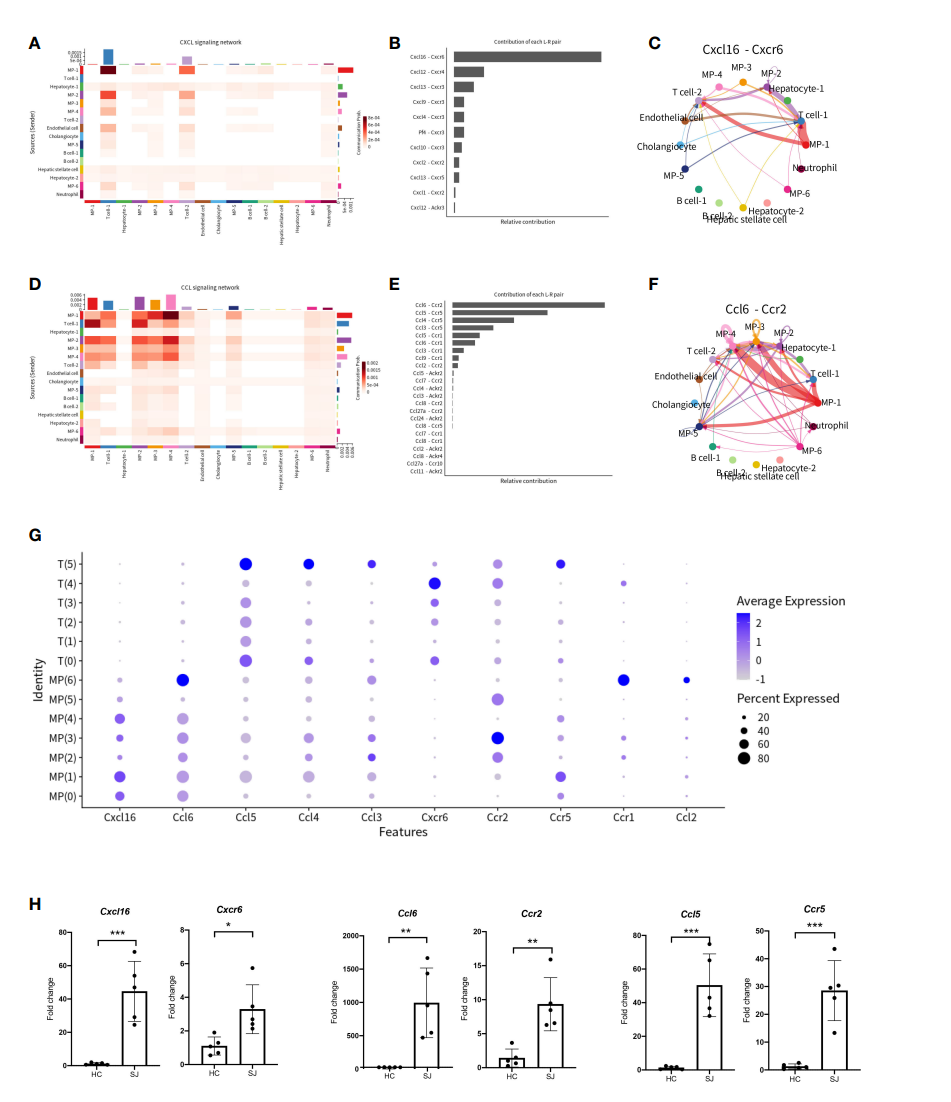
图5 日本血吸虫病纤维化肝脏中的CXCL和CCL信号通路网络
6.日本血吸虫病纤维化肝脏中的FASLG信号通路变化
为了更好地了解血吸虫病肝纤维化的机制,作者采用CellChat进一步分析了不同簇之间的细胞间信号传导和相互作用。结果表明FASLG信号通路(Fasl-FAS)与T细胞和内皮细胞密切相关(图6A)。Fasl只在SJ组中T(5)亚群中表达(图6B),而Fas则在主要在内皮细胞中表达(图6c)。tSNE分群显示内皮细胞可以分成6个不同的亚群(图6D)。组间细胞分布显示SJ组中主要是End(2)和End(4)亚群,而HC组中则主要是End(0)和End(1)亚群(图6E)。Fas出现在End(0)、End(2)、End(3)、End(4)和End(5)中,它们表达了肝窦内皮细胞(LSECs)标记基因(Flt4、Mrc1、Pecam1和Stab1)(图6F)。qPCR验证显示Fasl和Fas在SJ组显著升高(图6G),在SJ组中的NKT细胞,CD8 T细胞和NK细胞中,Fasl的表达量也显著升高(图6H)。
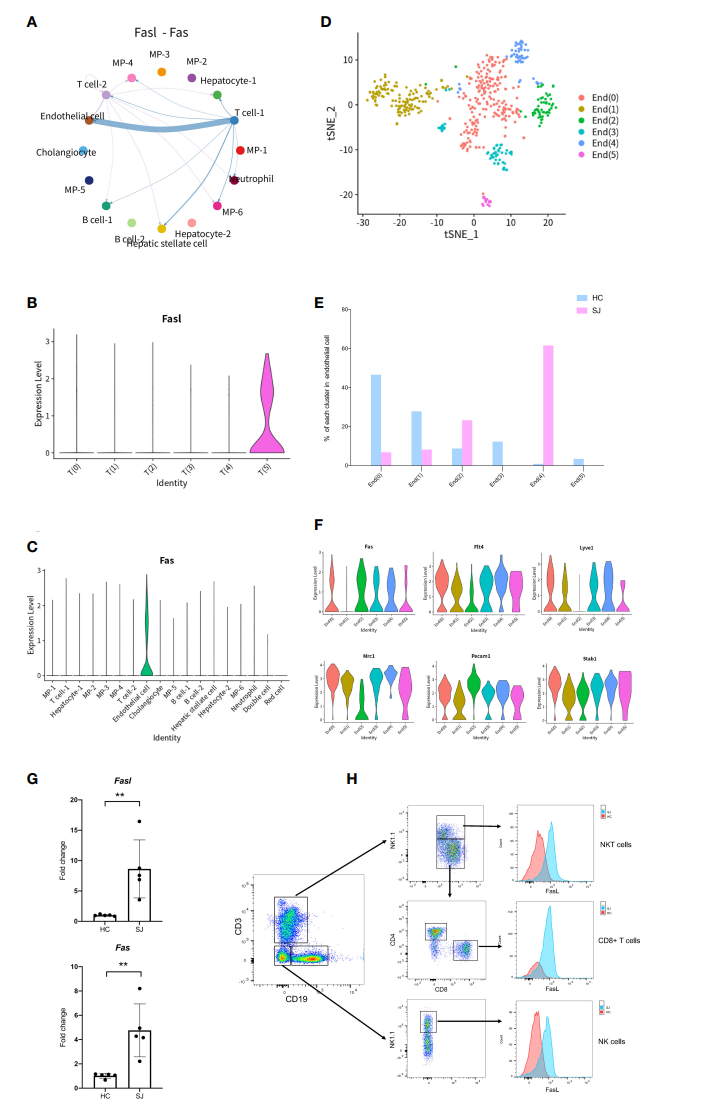
图6 日本血吸虫病纤维化肝脏中的FASLG信号通路变化
结论
作者应用单细胞转录组测序来探索日本血吸虫病肝纤维化的机制,为血吸虫病肝纤维化的治疗提供新的线索,绘制了日本血吸虫病导致的纤维化肝脏的免疫细胞图谱。日本血吸虫感染后大量T细胞浸润到小鼠纤维化肝脏中,这表明T细胞与血吸虫相关肝纤维化的发展密切相关。日本血吸虫感染后Th2细胞和NKT细胞在肝脏中显著富集。T细胞与FASLG信号通路之间存在着密切的联系,且Fasl在血吸虫感染的NKT细胞、CD8 T细胞和NK细胞中的表达量更高。
参考文献
Yu Zhang, Junhui Li, Hao Li,et al. Single-cell RNA sequencing to dissect the immunological network of liver fibrosis in Schistosoma japonicum-infected mice. Front. Immunol., 22 December 2022.








