1.分离线粒体并评判线粒体功能
通过人结肠腺癌细胞(R)、小鼠成纤维细胞(F)、小鼠肌肉细胞(M)、小鼠心肌细胞(H)这四种细胞进行线粒体分离效率测试。流式细胞仪测量结果显示线粒体数量通过(Mitotracker green,MTG)和线粒体膜电位(TMRM)染料两种方法测量的线粒体数量结果基本一致。
为了评判分离的线粒体是否功能失调,分别测量了四种细胞和分离线粒体中的线粒体数量(MTG)、膜电位(TMRM)和氧化状态(MitoSox)。结果显示,四种细胞的MTG、TMRM和MitoSox存在差异,但在分离的线粒体中差异都消失了,说明分离的线粒体功能失调。
表1 线粒体分离效率
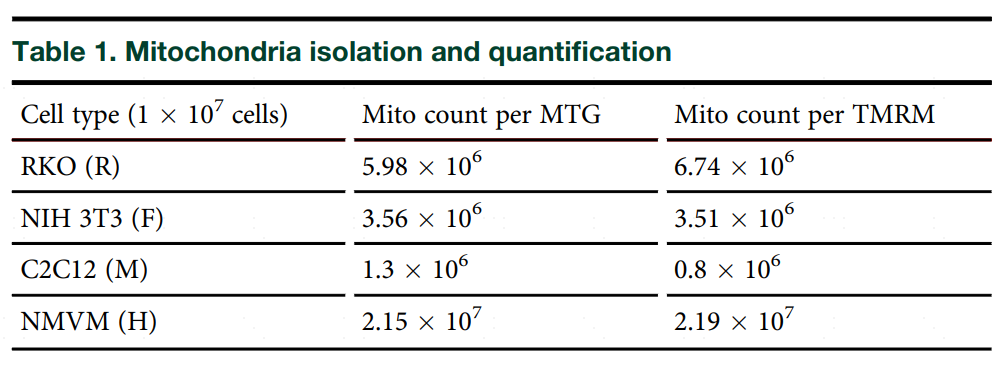

图1 流式细胞术分离和定量线粒体
2.线粒体移植在阿霉素(DOX)诱导的心力衰竭中具有心脏保护作用
首先将人类R-mito注射到野生型小鼠心脏中,并在注射后2小时和24小时提取心肌细胞中的DNA,通过RT-qPCR检测到人类mtDNA存在小鼠心肌细胞中,验证了移植的线粒体能够被小鼠心肌细胞吸收。
本研究又检测了DOX激发前进行线粒体移植是否能够预防心脏毒性,对8周龄的C57/Bl6J雄性小鼠进行了阿霉素激发前的单剂量心肌内线粒体移植(M-mito+DOX)或PBS(PBS+DOX)处理。结果显示:PBS+DOX心肌细胞表现出细胞总ROS(CellROX)升高、MitoSox降低和TMRM降低,M-mito+DOX心肌细胞表现出相反的结果。
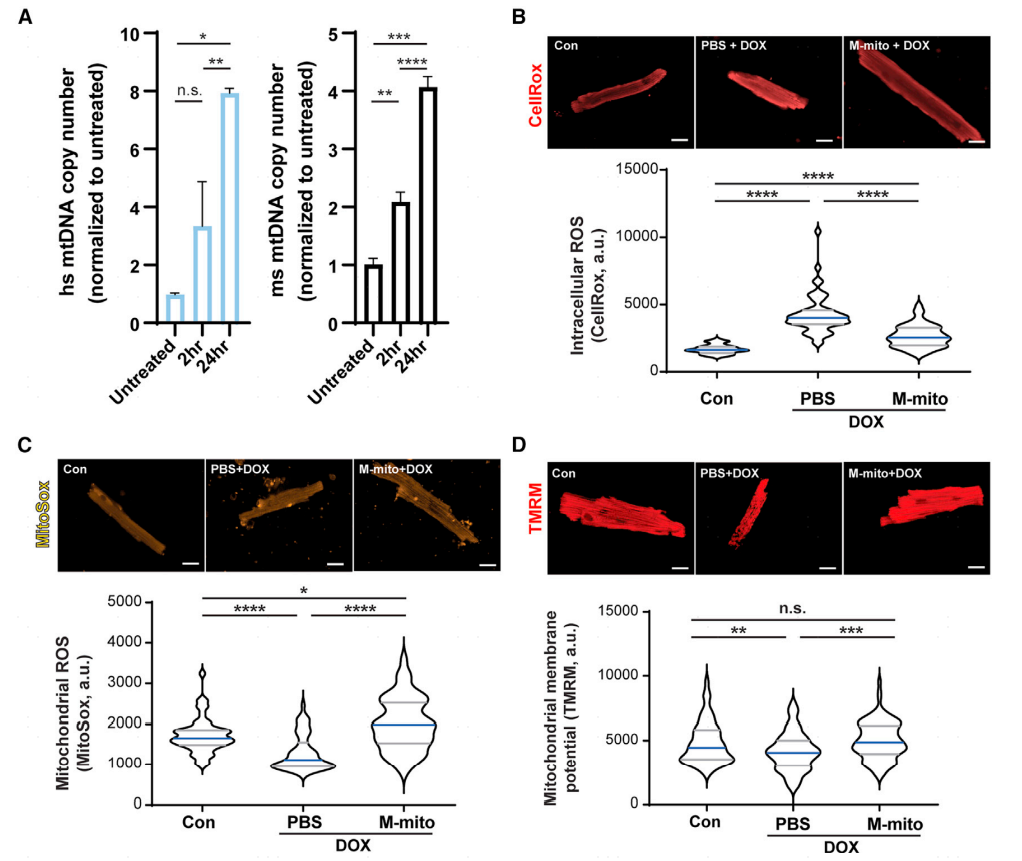
图2 线粒体移植保护心肌细胞免受阿霉素诱导的线粒体功能障碍
3.在阿霉素诱导的心力衰竭模型中,线粒体移植通过抑制细胞调亡和代谢恢复提供心脏保护功能
为了探究线粒体移植如何提供心脏保护功能,将1x104 mito/100uL线粒体移植到新生小鼠心室肌细胞(NMVMs)中,并用1uM DOX进行刺激。发现线粒体移植会抑制DOX诱导的调亡信号(碘化丙啶/膜联蛋白V双染色)。接下来,对新生小鼠心室肌细胞的收缩和线粒体呼吸功能进行检查。结果显示:线粒体移植能够改善小鼠心室肌细胞的收缩功能,线粒体移植恢复了基础线粒体呼吸。
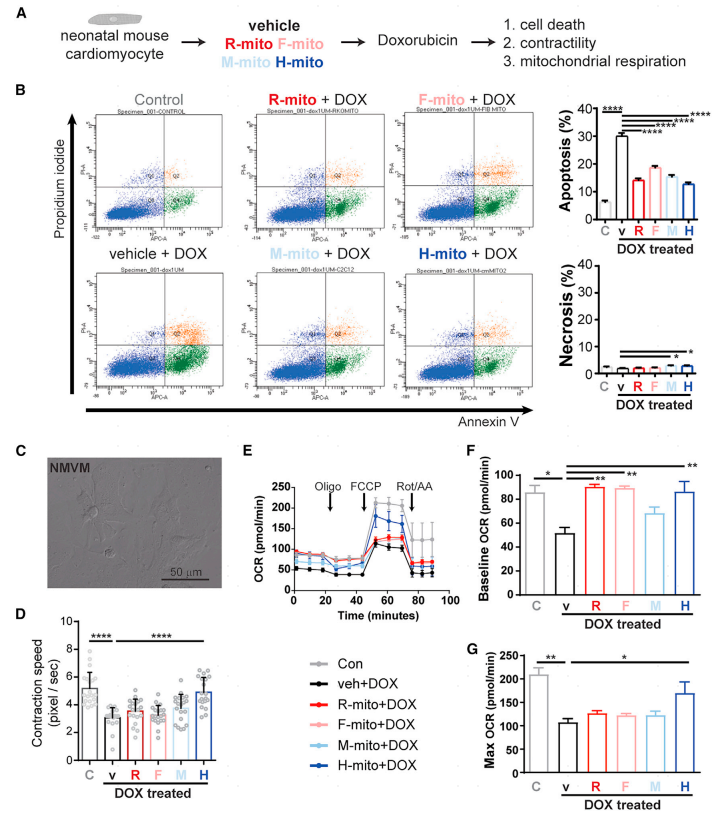
图3 线粒体移植改善阿霉素(DOX)诱导的心肌功能障碍
4.线粒体移植恢复扩张型心肌病心肌细胞的收缩能力
接下来,在扩张型心肌病(DCM)hiPSC-CM模型中测试了线粒体移植是否可以挽救线粒体功能障碍和心肌收缩力。从同遗传背景健康的hiPSC-CM中分离线粒体移植到来自扩张性心肌病患者的hiPSC-CMs中,观察到收缩速度的改善和搏动频率的降低。但线粒体移植仅在心室hiPSC-CMs中带来了收缩改善,而在心房hiPSC CMs中没有带来收缩改善。与NMVM DOX研究结果一致,将H-mito移植到心肌病患者 hiPSC-CM中增加了最大线粒体呼吸。总之,这些结果说明线粒体移植优先恢复心室心肌细胞的收缩功能,同时保持心房心肌细胞的完整。

图4 线粒体移植改善DCM hiPSC-CMs的收缩功能
5.线粒体移植可能通过恢复线粒体呼吸来加强心室心肌功能,而非通过诱导转录组变化起作用
为研究线粒体移植如何影响心室心肌细胞的功能,作者对H-mito处理和未处理(UT)的DMD(杜氏肌营养不良患者)hiPSC-CMs进行了单细胞转录组测序。共鉴定了1个肝细胞群(Hep)、1个心房细胞群(Atr)和10个心室细胞群(SC)。分别对心室细胞群和心房细胞群在H-mito处理和未处理组的差异基因进行GO term分析,发现心室细胞群中,线粒体移植诱导的基因显著富集到细胞周期状态(有丝分裂、细胞周期和细胞分裂通路)和结构强化状态(细胞骨架、肌动蛋白结合和肌肉蛋白通路)。在心房细胞群中,线粒体移植诱导的差异基因富集到RNA相关基因网络,但细胞骨架重塑和线粒体呼吸通路保持不变,但RT-qPCR验证显示H-mito处理和未处理的DCM hiPSC-CMs基因表达差异不大。结果表明,线粒体移植可能通过恢复线粒体呼吸来加强心室心肌功能,而不是通过诱导转录组变化起作用。

图5线粒体移植诱导转录组改变