1.单细胞转录组分析上颌突的细胞异质性
为了评估上颌突发育和外胚层间质分化过程中转录程序变化,使用基于微孔的GEXSCOPE®单细胞文库制备系统对12个小鼠胚胎的E10.5、E11.5、E12.5和E14.5上颌突进行了scRNA-seq(图1A)。质控后共10873个高质量单细胞转录谱用于进一步分析。细胞注释出间充质细胞、上皮细胞、内皮细胞和神经元细胞等(图1B,D,F,H)。间充质细胞和上皮细胞分别以Twist1和Epcam基因的高表达为特征,是上颌突内最丰富的两种细胞类型。在每个发育阶段,间充质细胞占上颌突细胞总数的72%以上;上皮细胞占E10.5和E12.5细胞总数的1.4%-8.2%,在E14.5增加到15.6%(图1C,E,G,I)。
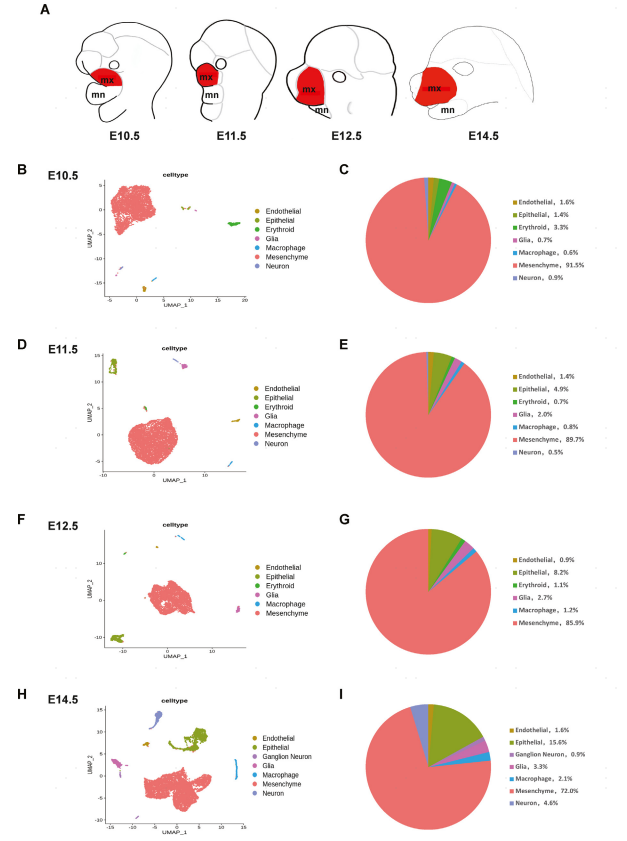
图1 scRNA-seq揭示发育中的小鼠上颌突E10.5至E14.5的细胞类型
2.不同发育阶段的间充质亚群对应不同的分化状态
为了揭示上颌突的神经嵴源性间充质细胞如何逐步分化成不同的细胞类型,作者从每个时间点选择Twist1阳性间充质细胞进行亚群细分。
E10.5时,间充质细胞分为两个细胞簇,可通过转录因子Barx1和Msx1的差异表达来区分(图2A)。Barx1和Msx1是公认的优先在E10.5上颌突的近端和远端表达,随后分别丰富了腭的后端和前端。
E11.5时,上颌突间充质内细胞组成的复杂性显著增加(图2B)。一些E11.5间充质细胞簇表现出中胚层特异性转录本Mest的高表达,同时表现出位置标记Msx1、Barx1和Shox2的差异表达,从而代表了位于上颌突前后轴不同位置的原始腭间充质。一簇间充质细胞表现出分泌性生长因子Igf1高表达,表明这些细胞在调节腭的生长。在E11.5处的一小部分细胞亚群中检测到肌周标记物Aldh1a2,这表明软组织的出现最终有助于未来的软腭发育。值得注意的是,E11.5大量细胞表达Wnt信号转录因子Lef1(图2C,D)。有研究表明,Lef1在口腔上皮下层的间充质细胞中强烈表达,并最终分化为口腔间充质。并且Lef1阳性细胞也表现出高的Msx1表达,这表明这些假定的牙齿间充质祖细胞起源于位于上颌突前部的Msx1阳性细胞。总之,这些结果表明,牙齿间充质谱系在E11.5出现,可能是由Wnt信号及其下游转录因子驱动的。
在E12.5时,腭和牙间充质进一步多样化了它们的细胞命运(图2E),在腭间充质中,可以很容易地检测到表达典型成骨标记物Dlx5的细胞亚群,这表明腭成骨在这一阶段开始。在Lef1阳性细胞中,出现了表达转录因子Tbx18和Sox18的细胞亚群(图2E,F),在血管生成中发挥重要作用。有趣的是,之前的一项研究表明,在牙胚E18.5处可以检测到Sox18转录本,这表明Sox18参与了牙齿发育。此外,一些簇表现出高表达的细胞外基质成分,如Dcn和Lum或周细胞标记物Ebf1,表明这些细胞是各种类型结缔组织和成纤维细胞的祖细胞。
在E14.5,腭系和牙系的细胞在UMAP图上进一步分为两大组(图2G,H),在E12.5中检测到的不同间充质细胞类型在E14.5中继续大量存在。在腭间充质谱系中,出现了一簇表达典型软骨细胞标记物Col9a1和Sox9的细胞。在牙齿间充质谱系中,Sox18/Tbx18阳性细胞持续存在。因此,Sox18/Tbx18阳性细胞可能代表一种特殊类型的牙间充质细胞。
总的来说,单细胞数据揭示了发育中的上颌突内组织复杂性和异质性的逐步增加。

图2 不同发育阶段的间充质亚群表现出不同的转录特征
3.整合多个发育阶段数据揭示了上颌突间充质的发育轨迹
接下来作者整合了所有四个发育阶段(E10.5、E11.5、E12.5和E14.5)的scRNA-seq数据,以更好地阐明上颌突间充质细胞的细胞命运转变的时间顺序。初步分析后发现来自不同细胞类型的S期和G2/M期的增殖细胞仍然倾向于聚集在一起,这表明细胞周期依赖性的转录差异不能完全消退。为了尽量减少细胞周期阶段对发育轨迹推断的影响,作者仅从数据中选择6093个G1期间充质细胞进行后续分析。
对整合的G1期间充质细胞进行无监督聚类,分出18个簇(图3A,B),并利用特异性标记基因推断出这些细胞类型的特征,将这些细胞分为未分化的腭间充质细胞(簇1、5、14)、成骨细胞(簇3)、软骨细胞(簇7、16)、软骨膜细胞(簇4)、肌周细胞(簇12、15)、成纤维细胞(簇2、6、8、10、13)和牙间充质细胞(簇0、9、11、17)(图3C)。正如在E14.5数据集中观察到的,腭间充质细胞及其衍生物在整合数据集的UMAP图上明显地从假定的口腔间充质谱系中分离出来(图3A-C),这与之前的观察一致,即口腔间充质谱系在E11.5从腭架间充质中分离出来,并采用了独特的分化路径。
作者探索了上颌突间充质分化状态下的关键转录因子(TF)。利用整合scRNA数据,确定了每个簇中富集的TF(图3D)。作者发现一些TF表现出更广泛的表达谱,通常在来自同一谱系的几种相关细胞类型中。例如,Lef1在所有的牙齿间充质细胞群和一些相关的成纤维细胞群中表达(图3C,D)。在表达Lef1的细胞中,Trps1和Pou3f3表现出一种几乎互斥的表达模式,牙间充质相关簇0、9、11和17表达Trps1,成纤维细胞相关簇2、8和10表达Pou3f3(图3C,D)。此外,一些TF只在一个细胞亚群中表达。例如,Sox18和Tbx18在11簇中特异性表达,这是一个完整的牙间充质群体(图3C,D)。总之,在上颌突发育过程中,TF的层次结构以逐步的方式来指定细胞命运。
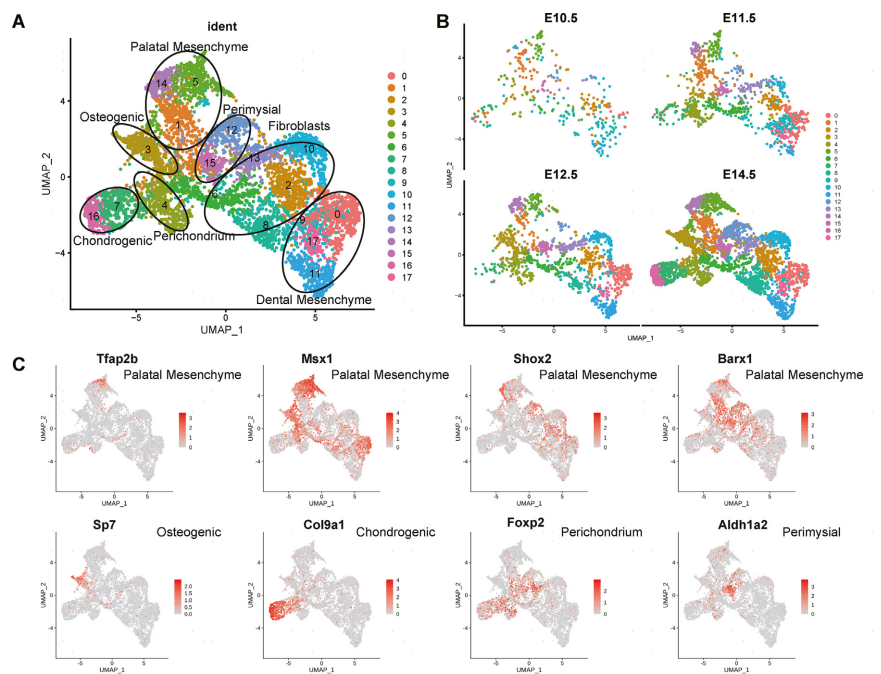

图3 与上颌突间充质分化状态相关的转录因子的动态表达模式
接下来作者使用Monocle3进一步推断了腭系和牙系上颌突间充质的伪时间发育轨迹(图4A,B)。沿着伪时间轨迹对齐腭相关细胞,发现了一个分叉模式,表达Msx1和表达Barx1的间充质细胞分别优先向软骨细胞和肌周细胞命运分化(图4A)。这些发现与特定TF建立空间模式域先于并引导腭间充质下游分化的观点一致。对于牙齿间充质谱系,表达Lef1/Trps1的簇向多个方向分化,产生表达Tbx18的牙齿间充质,以及不同类型的成纤维细胞(图4B)。
接着描述了关键TF沿分化轨迹的时间动态(图4C,D),作者发现与特定细胞状态相关的TF也是在伪时间轨迹上表现出最大变化的TF之一。在牙间充质谱系中,Trps1、Sox18和Pou3f3等转录因子均表现出不同的时间表达模式(图4D)。Trps1优先在伪时间轨迹的早期阶段表达,Sox18则在轨迹的中间阶段表达,Pou3f3在发育过程中逐渐上调,持续时间较长。总之,这些分析强调了在腭和牙齿形态发生的复杂过程中,位置指定、谱系指定和细胞类型指定TF在指导细胞命运转变中的精确协调作用。
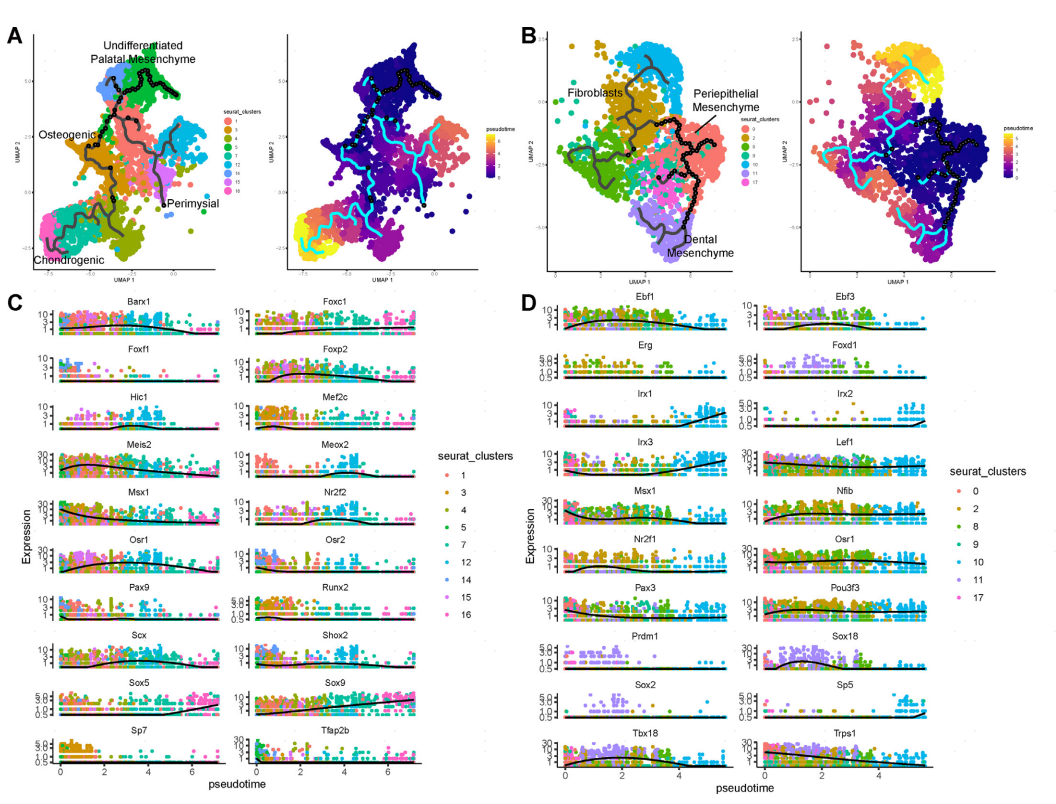
图4 腭系和牙系上颌突间充质发育轨迹
4.转录因子导向的间充质分化调控网络
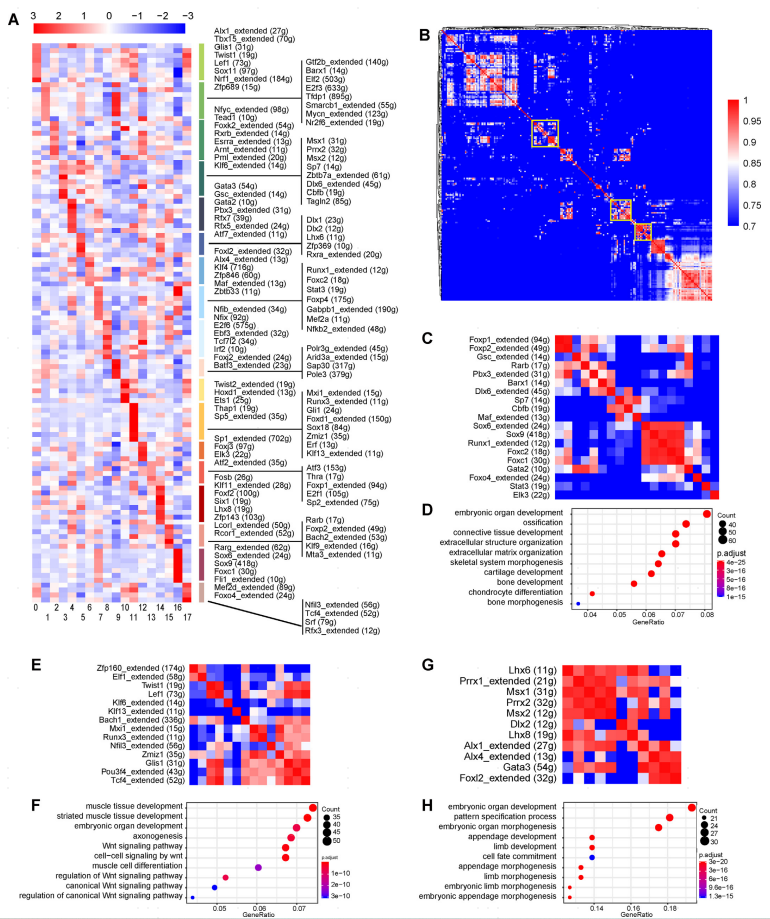
由于某些TF的表达水平与其功能影响不一定相关,作者接下来进行了单细胞转录因子调控网络(SCENIC)分析,以评估TF的活性,并推测在间充质分化过程中由这些TF指导的靶基因。热图展示了特定间充质亚群中表现出最强活性的转录因子调控模块(图5A)。与TF的表达模式一致,最原始的腭间充质细胞(簇5)表现出高活性的Msx1、Dlx1和Lhx6转录因子模块,而Sp7的活性在成骨细胞中特别丰富(簇3)。Tbx18/Sox18阳性的牙间充质(簇11)不仅表现出高活性的Sox18调控,而且它们还表现出最强的典型牙周干细胞(PDSC)标记物Gil1的调控活性,这增加了这些细胞是PDSCs祖细胞的可能性。SCENIC分析为解释间充质细胞群体的生物学特性提供了重要信息。
为了进一步了解不同TF之间的功能关系,并评估不同TF是否可以协同作用来调节细胞命运,作者使用先前描述的连接特异性指数(CSI)方法量化了调节子之间的功能相似性(图5B)。一对调控子之间较高的CSI分数意味着两个调控子在细胞群内的活动比与其他调控子之间的相关性更强。基于CSI评分对281个调控因子进行分层聚类,发现了一系列由多个调控因子组成的功能关联调控模块(图5B)。例如,一个由18个调控因子组成的模块,包括成骨调控因子Dlx6和Sp7、成软骨调控因子Sox9、软骨膜调控因子Foxp2等在CSI热图上相互聚集(图5C)。虽然该调节模块中的一些TF在成骨和软骨发生中的功能尚未得到明确的测试,但进一步功能富集发现该模块调节的基因在骨骼和软骨发育相关的GOs中富集(图5D),这强烈表明该调节模块在上颌突的骨骼发生中起着重要作用。同样,作者还发现一个包括Lef1在内的13个调控模块是Wnt信号的主要调控模块,可能与牙间充质的发育有关(图5E,F)。另一个突出的模块包含Lhx6、Lhx8、Msx1、Msx2、Prrx1、Prrx2和Dlx2调控,可能参与了原始的、未分化的腭间充质细胞的调控(图5G,H)。总的来说,这些分析为推断上颌突发育过程中复杂基因调控网络提供了新的见解。