1.锑暴露介导果蝇睾丸生殖毒性效应
为了研究锑暴露在果蝇睾丸中的毒理学效应,作者检测了在0、0.3、0.6和1.2mg/mL的锑暴露下果蝇睾丸中生殖干细胞(GSCs)和长形精子细胞簇的数量。结果表明,与对照组(0mg/mL)睾丸相比,不同浓度(0.3、0.6或1.2mg/mL)的锑暴露10天后以剂量依赖的方式显著减少了GSCs的数量(图1A,B)。此外,作者进一步统计了长形精子细胞簇的数量,发现了其显著的以剂量依赖性减少(图1C,D),提示锑暴露参与了果蝇睾丸的分化和损伤长形精子的形成。以上结果表明,锑暴露会导致果蝇睾丸精子发生过程中的生殖毒性。
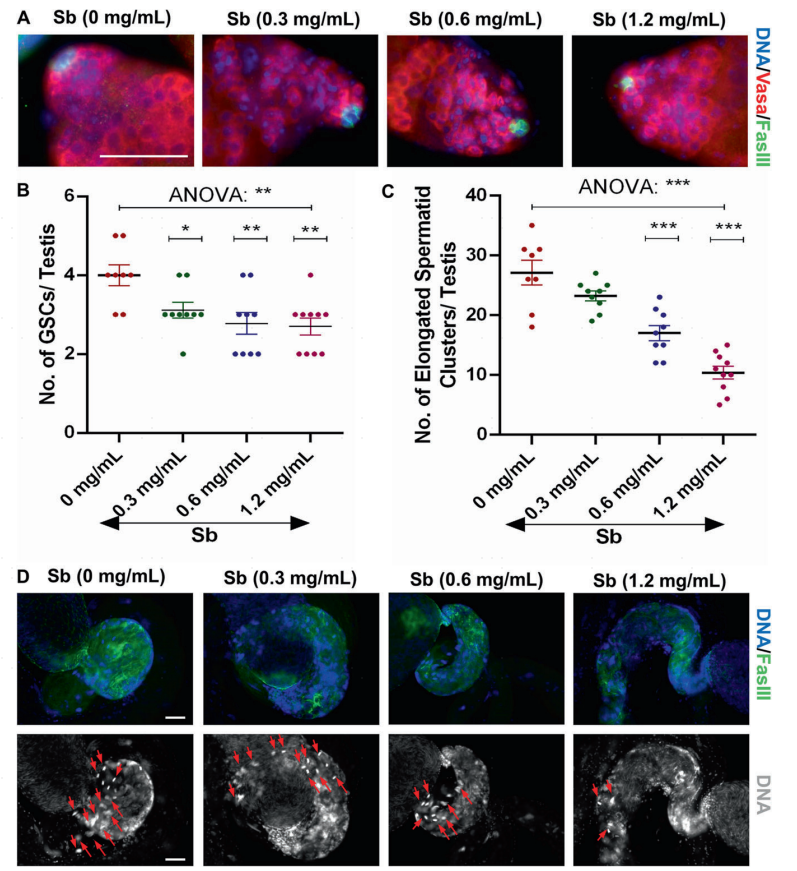
图1 锑暴露损害GSCs维持和长形精子延伸
2.果蝇睾丸的单细胞图谱
为了探究果蝇睾丸中受锑暴露影响的细胞类型,作者对锑暴露和正常组(每组180只雄性果蝇)新鲜睾丸组织进行了scRNA-seq分析(图2A)。经过质控后共捕获到9180个高质量细胞用于后续分析,每个细胞的中值UMI和中值基因数分别是10821.5和2058。根据已发表的标记基因,共注释为12个细胞群,几乎涵盖了果蝇睾丸的所有细胞类型(图2)。
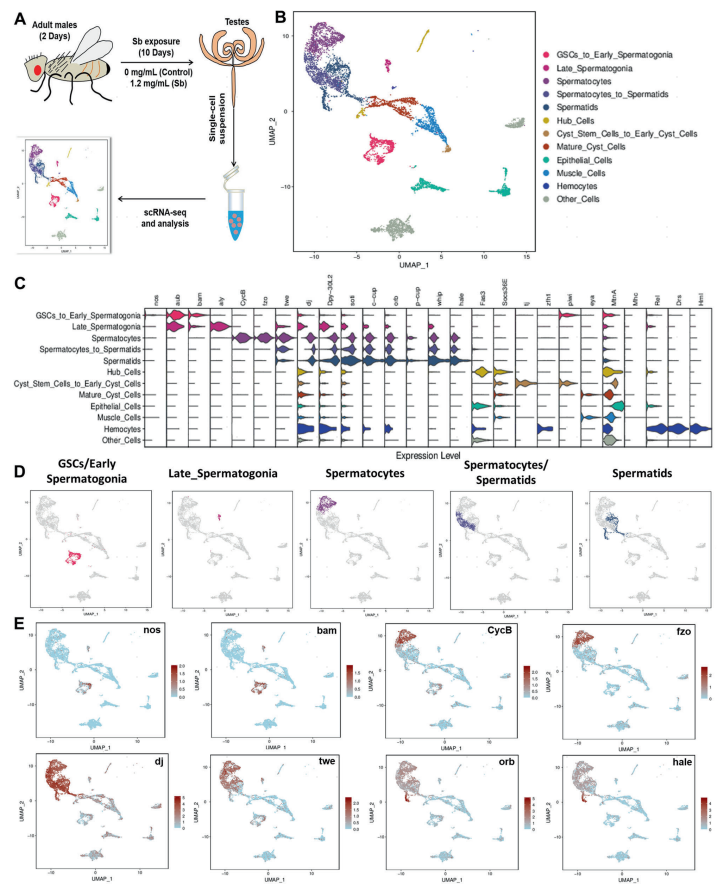
图2 scRNA-seq鉴定睾丸细胞簇
3.锑暴露后果蝇睾丸细胞群变化特征
为了进一步探索锑暴露对果蝇睾丸细胞群的影响,作者对对照组和锑暴露组细胞群分布进行分析,结果表明锑暴露后,各细胞类型的占比显著降低,这些变化在生殖细胞中最为明显(图3A-C),提示了锑暴露在精子发生过程中的生殖毒性。由于在GSCs和精子细胞中鉴定出锑暴露对精子发生的表型,因此接下来的分析主要集中在GSCs_to_Early_Spermatogonia和Spermatids簇。在这两个细胞群中,生殖细胞中的DEGs显著增加,分别为925个(上调177个,下调748个)和605个(上调352个,下调253个) (图3E)。以上结果表明,锑暴露后果蝇睾丸细胞群具有明显的特征变化。
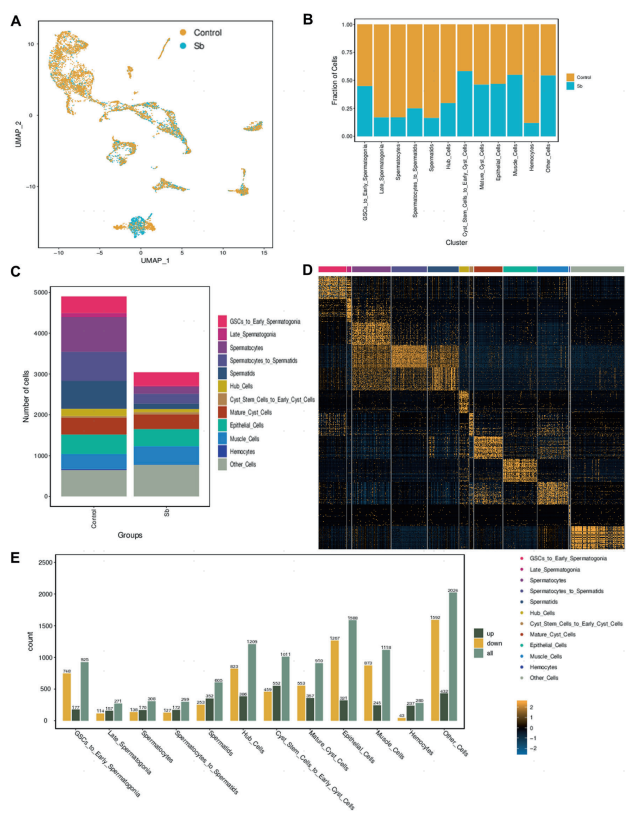
图3 果蝇睾丸细胞群的特征
4.锑暴露介导早期生殖细胞的分子调控
接下来作者探讨了锑暴露对生殖细胞转录调控的影响,对GSCs_to_Early_Spermatogonia细胞簇进行差异基因的富集分析。GO富集结果多与精子发生有关(图4A),而KEGG富集结果表明,包括碳代谢在内的多种代谢通路揭示了在GSCs/早期精原细胞维持中锑暴露与遗传的相互作用(图4B)。同时,作者也注意到,在果蝇睾丸中,SCP-Containing Proteins、S-LAPs和Mst84D基因家族在锑暴露后的表达趋势表现出高度一致性,并研究了这些特征与相应睾丸细胞群中碳代谢途径的相关性,发现碳代谢与SCP-Containing Proteins、S-LAPs和Mst84D特征呈正相关性(图4C)。接下来,作者进一步检测了果蝇睾丸相关特征中关键因子[碳代谢相关因子(CG7059、CG32026和CG9314)、SCP-Containing Proteins (scpr-A、scpr-B、scpr-C)、S-LAPs (S-Lap1、S-Lap3)及Mst84D (Mst84Dc)]的相对mRNA水平,发现与对照组相比,锑暴露组睾丸显著降低(图4E-G)。除此之外,作者利用免疫荧光和实时荧光定量PCR(qRT-PCR)的方法鉴定了在精子细胞发育过程中锑暴露后果蝇睾丸中的三个主要特征的变化,进一步验证了单细胞数据的结果。综上所述,这些结果有助于揭示锑暴露-遗传交互作用在早期生殖细胞维持过程中的调控机制。
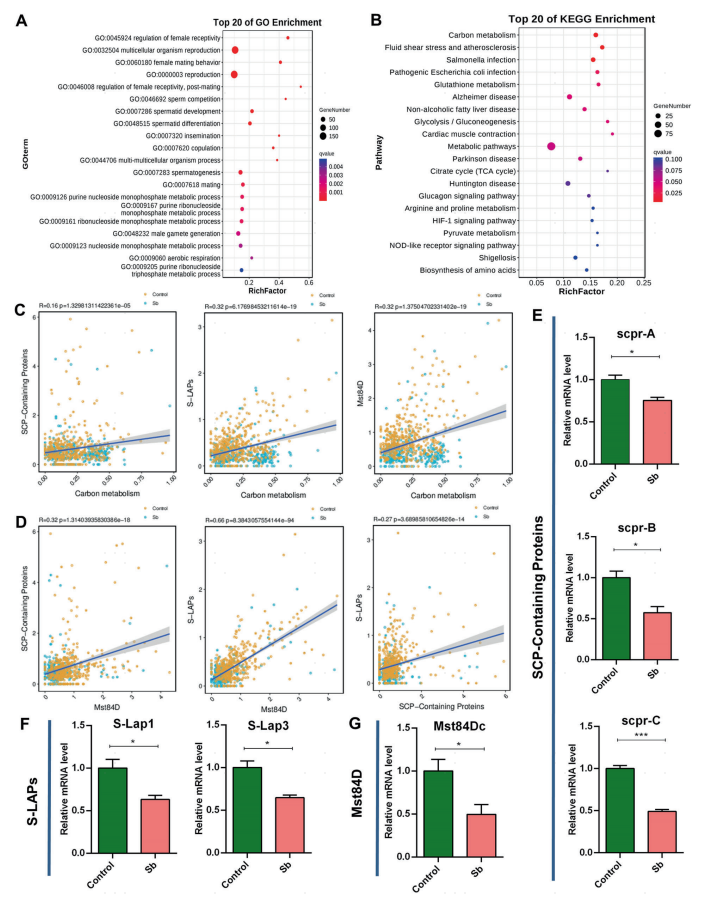
图4 生殖细胞中DEGs富集分析
5.锑暴露介导精子发生的三个阶段
为进一步探究锑暴露后果蝇睾丸中的生殖细胞特征,作者对精子发生过程中的生殖细胞进行了拟时序分析(图5A),并在果蝇睾丸中确定了三种阶段(图5B)。值得注意的是,在锑暴露后,各阶段下的生殖细胞数量和占比都显著降低(图5D,E)。重要的是,阶段1的生殖细胞主要由GSCs/早期精原细胞组成,而阶段2和阶段3的生殖细胞则趋向于由减数分裂期的精母细胞和减数分裂后的精子细胞聚集(图5F)。为了区分拟时轨迹分析中出现的两个分支,将阶段1/阶段2定义为分支1,阶段1/阶段3定义为分支2,根据其表达模式,作者鉴定到一系列代表性基因可以进一步区分这两个分支状态(在分支2中高表达,且在分支1中低表达)(图5G)。进一步分析锑暴露后果蝇睾丸中三种状态的特征,发现了三种主要的表达模式:阶段1特异性表达SmB和Fkbp39等基因,阶段2和阶段3表达CG43371、CG12861等基因,且whip、CG12126等基因在阶段3中高度富集(图6)。这些基因的表达模式研究有助于深入理解锑暴露介导的生精细胞异常调控机制。
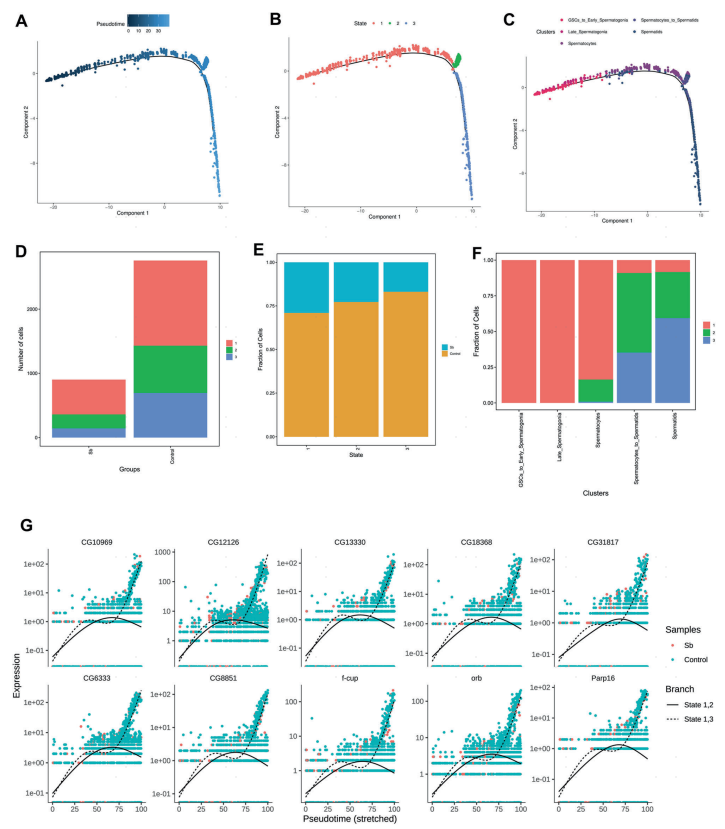
图5 精子发生过程中睾丸生殖细胞的拟时轨迹分析
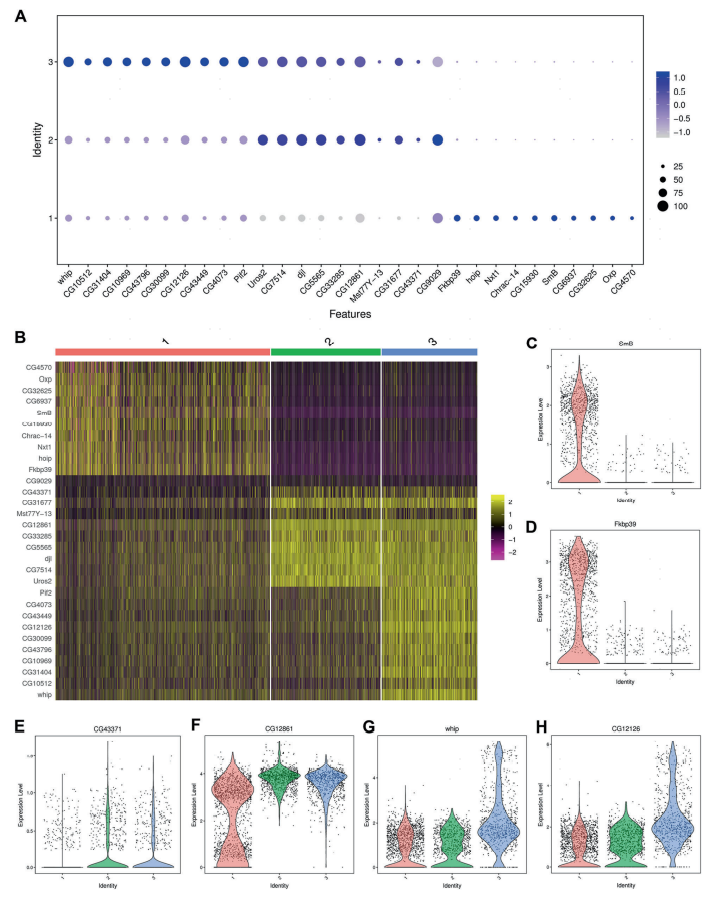
图6 精子发生过程中三种阶段的特征