1.HER2-low TNBC表现出更多的恶性临床特征
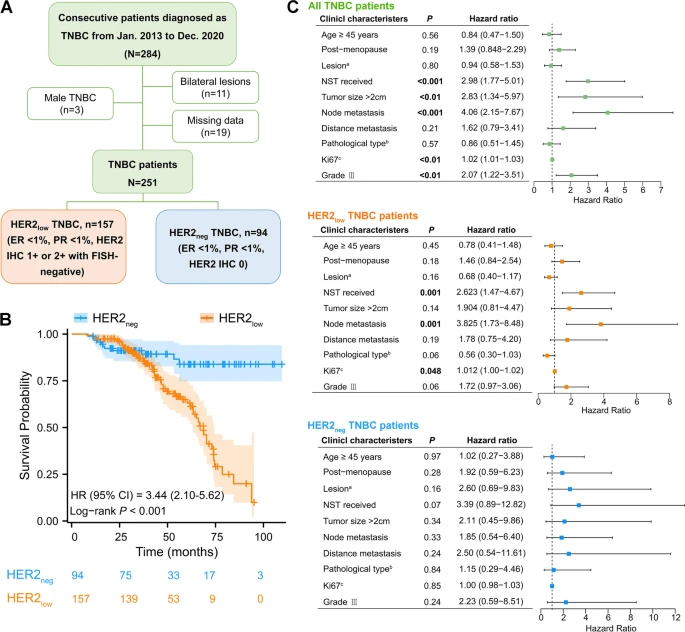
为探讨不同HER2状态TNBC的临床特征,研究人员随访分析了251例TNBC患者的临床资料,其中HER2-low组157例,HER2-negative组94例。结果表明:与HER2-negative TNBC患者相比,HER2-low TNBC患者具有更大的瘤灶、更多的淋巴结受累、更高的组织学分级、更高的Ki67表达水平、以及更短的总生存期。与此同时,Cox比例风险模型分析显示:新辅助治疗、淋巴结转移和Ki67水平是影响HER2-low TNBC患者(而非HER2-negative TNBC患者)预后的重要因素。
图1 不同HER2状态的TNBC患者的临床特征
2.scRNA-seq揭示HER2-low TNBC表现出更活跃的代谢和侵袭特征
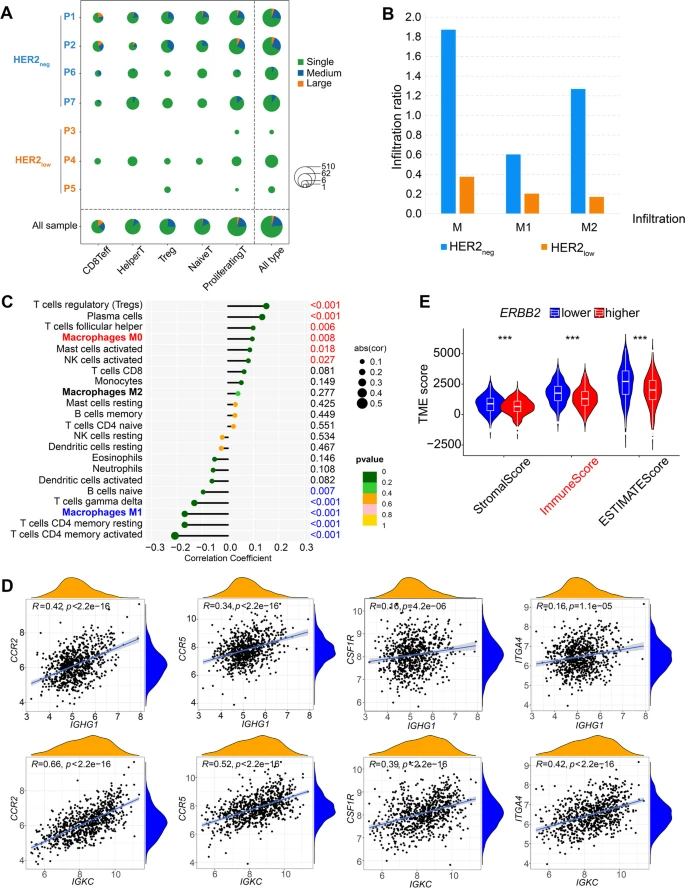
为进一步探究两种TNBC表型之间肿瘤生物学特性和潜在的分子机制。研究者对7例TNBC样本(HER2-negative 4例+HER2-low 3例)进行了scRNA-seq。该结果显示,与HER2-low TNBC相比,HER2-negative TNBC内皮细胞和成纤维细胞占比更低,但B细胞和T细胞占比较高。根据基因表达谱将肿瘤细胞分成了15个cluster,其中肿瘤细胞cluster(2,3,8,9,11,12和14)主要来源于HER2-low样本,主要上调血管生成,EMT和生物代谢等相关功能,表明该组中肿瘤细胞具有侵袭性特征。相比之下,肿瘤细胞cluster(4,5,6,7,10和15)主要来源于HER2-negative TNBC组,与细胞增殖和免疫反应过程有关。以上结果表明,HER2-low和HER2-negative TNBC组肿瘤细分和功能特征上具有异质性,其中HER2-low TNBC组肿瘤细胞更具侵袭性。
图2 HER2-low和HER2-negative TNBC组肿瘤细胞不同分群和功能特征
3.HER2-low和HER2-negative TNBC组具有不同的肿瘤进化特征
拟时序分析发现,HER2-negative TNBC肿瘤细胞主要分布在轨迹分化的起始段,HER2-negative TNBC细胞主要分布在轨迹末端。根据拟时序轨迹将所有肿瘤细胞分为三种状态(state1-3)。对3个state进行差异基因分析,结果表明state1的肿瘤细胞表现出免疫相关特征基因(IGLC2、IGHG4、IGHG1和IGKC)的激活,而处于state3的肿瘤细胞主要上调代谢生物学相关基因(PTN、SCGB2A2、MUCL1、PIP)的表达量。同时,作者也研究了两组的不同分化分支(Pre-branch、Fate 1和Fate 2)的基因表达特征,发现HER2-low TNBC组中Fate 1主要与基因(PTN、KRT15、S100A8等)相关,这表明这群肿瘤具有细胞凋亡,迁移和代谢的特征;Fate 2细胞中的基因主要富集在免疫和炎症过程,细胞增殖和迁移,以及细胞干性维持上。HER2-negative TNBC组,Fate 2基因主要参与细胞增殖和DNA损伤修复;Fate 1的基因主要在免疫应答和肿瘤迁移过程中富集,高表达TNF、CXCL1、JUN等基因。以上结果表明,HER2-low和HER2-negative两组TNBC具有不同的肿瘤进化特征。

图3 HER2-low和HER2-negative TNBC组具有不同的肿瘤进化特征
4.HER2-negative TNBC高表达良好预后相关的免疫球蛋白基因
为了进一步探索两个TNBC组之间肿瘤生物学特征的潜在差异,进一步研究两组肿瘤细胞的差异基因。值得注意的是,HER2-negative TNBC肿瘤细胞上调免疫球蛋白相关基因(IGHG1、IGHG4、IGKC、IGLC2),主要富集在抗原加工和呈递、免疫应答激活信号转导和先天免疫应答的调节等功能。利用免疫荧光(IF)染色分析临床TNBC患者肿瘤切片表明IGHG4和IGKC主要在HER2-negative中表达,而APOD和MUCL1在HER2-low中高表达,此结果与scRNA-seq数据一致。IGKC,IGHG1和IGHG4(在HER2-negative TNBC)与TNBC患者良好预后显著相关。
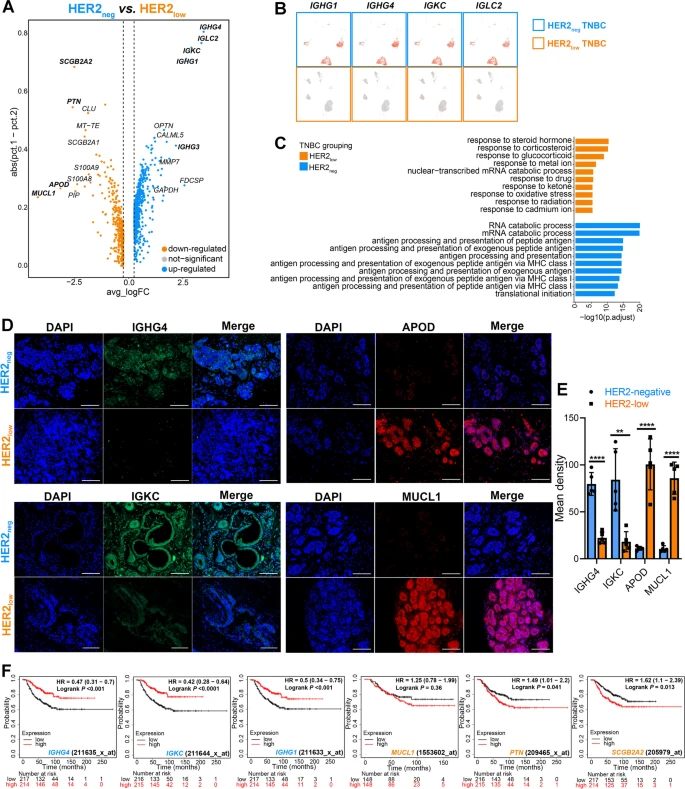
图4 HER2-low和HER2-negative TNBC肿瘤细胞的不同特征
5.与HER2-low TNBC相比,HER2-negative TNBC具有更为活跃的免疫微环境特征
单细胞(T细胞)受体测序(scTCR-seq)结果显示HER2-negative组具有更丰富的TCR多样性。与HER2-low TNBC相比,HER2-negative TNBC表现出更高的巨噬细胞浸润(主要是M2表型)。利用GEO数据集分析表明,TNBC中ERBB2的表达与M0巨噬细胞浸润呈显著正相关,而与M1巨噬细胞浸润呈负相关,说明M0巨噬细胞浸润在抗肿瘤免疫活性中起重要作用。
图5 HER2-low和HER2-negative TNBC免疫细胞的不同特征
6.HER2-negative TNBC在免疫治疗后表现出免疫微环境的促炎状态
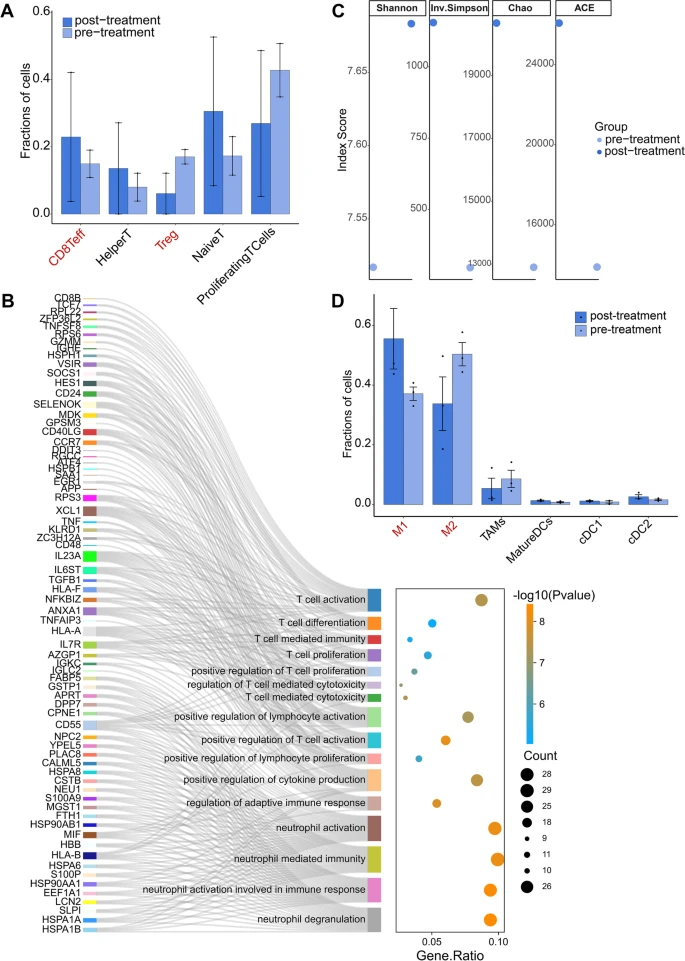
与初治患者相比,免疫治疗后患者的Tregs水平降低,CD8 T细胞和CD4辅助性T细胞水平升高,这些潜在肿瘤反应性T细胞的增强表明HER2-negative TNBC患者免疫治疗后T细胞的抗肿瘤能力增强,表现为T细胞在免疫治疗后参与免疫应答的上调功能。治疗后和治疗前相比TCR克隆型多样性更高。免疫治疗后M1巨噬细胞的丰度增加,但M2巨噬细胞减少,表明免疫治疗HER2-negative TNBC可能会改变M1/M2巨噬细胞极化的程度。以上结果表明,HER2-negative TNBC免疫治疗后,免疫微环境可能更容易出现促炎状态,这可能有助于对免疫治疗的响应。
图6 新辅助免疫治疗前后HER2-negative TNBC免疫微环境的特征变化
7.HER2-negative比HER2-low TNBC高表达免疫治疗生物标志物
不同免疫治疗靶点(PD-1/L1、CTLA4、CD47、CDK4/6、PARP1/2和DDR1/2)在TNBC两组中肿瘤细胞的表达水平不同。PDCD1(PD-1)和CD274(PD-L1)在HER2-negative TNBC中的T细胞和髓系细胞上高表达。PD-L1在髓系细胞上显著表达也会增加肿瘤免疫逃逸的潜在风险。因此,对于HER2-negative TNBC患者,免疫疗法的应用似乎更为必要。同时,利用GEO数据库的TNBC数据集证实ERBB2与CD274、CTLA4、CD47、CDK6和DDR2的表达呈负相关。
图7 HER2-low和HER2-negative TNBC中关键免疫治疗生物标志物的不同表达模式