1.发育中的人视网膜单细胞调控图谱构建
通过对scRNA-seq数据进行聚类分群及使用已知marker基因进行注释,共获得17种细胞类型。通过匹配的scRNA-seq数据,对scATAC-seq数据也进行了映射注释。作者进一步鉴定了一系列细胞类型新的特征基因,将一组高表达RGR、GPX3和RLBP1的细胞标记为MGCs,并提出在胚胎时期RGR可能比RLBP1对于MGCs更具特异性。
考虑到RPCs具有胶质细胞和神经元两种分支发育趋势,作者通过两种不同的方法(Palantir和Monocle3)对RPCs、NPCs和MGCs以及六个主要神经元进行拟时序分析。结果证实,RPCs可以分化为MGCs或NPCs,而过渡性NPCs可以进一步发育为三种谱系的神经元。该部分结果创建了一个描述视网膜发育的图谱,为后续分析奠定了基础。
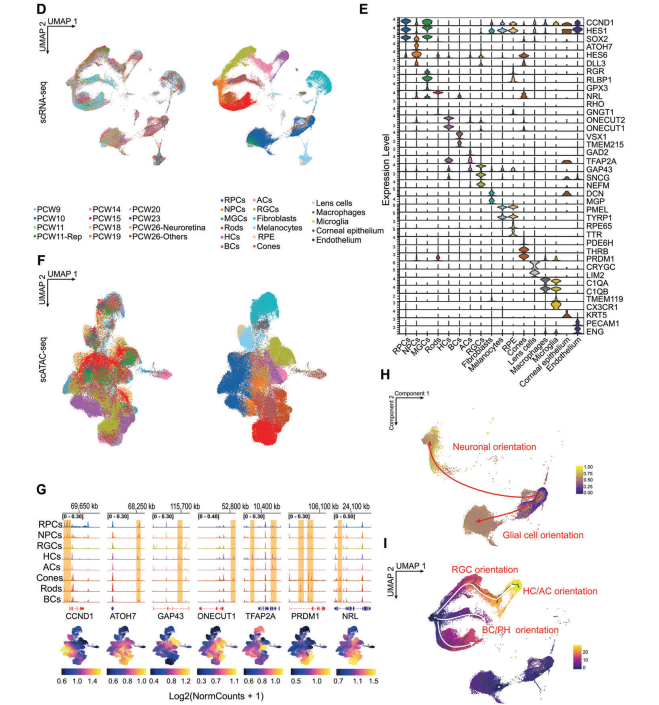
图1 发育中的人视网膜单细胞调控图谱构建
2.视网膜细胞转录组学和表观遗传学水平基因调控网络的构建
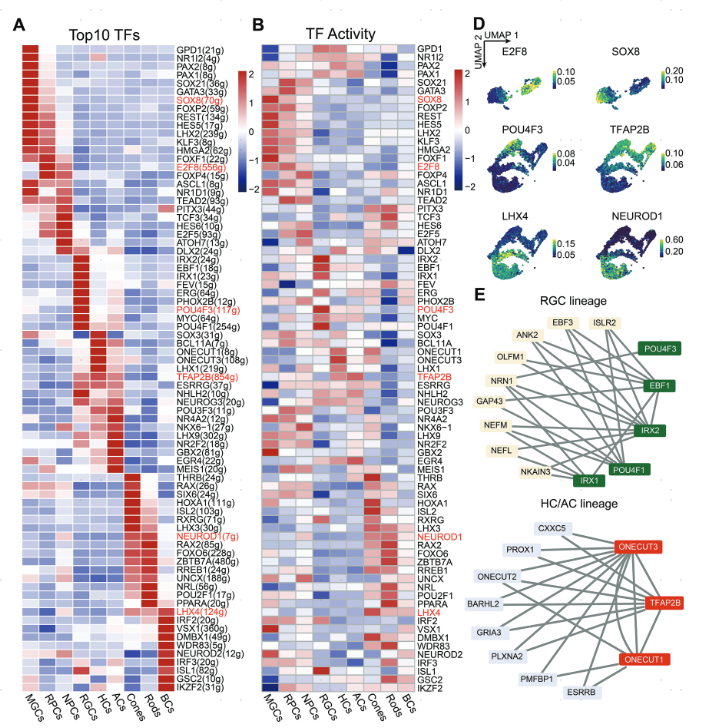
为了确定哪些转录因子(TFs)对于RPCs分化为主要视网膜细胞最终状态至关重要,作者通过SCENIC分析获得了一系列具有高度相似转录组学和表观基因组学水平的TFs,并使用scATAC-seq数据评估了相应TFs染色质可及性。UMAP展示的不同谱系TFs活性揭示了RPCs的四个发育分支端点,如MGC谱系的SOX8、RGC谱系的POU4F3、HC/AC谱系的TFAP2B,以及BC/PH谱系的LHX4和NEUROD1。
接下来,作者在表观遗传和转录两者水平上从各个谱系Top TFs中筛选关键的细胞类型特异性转录因子。IRX1和IRX2对RGCs发育所需的基因有显著影响,而ONECUT家族成员对HC/AC谱系特异性因子(包括PROX1和BARHL2)有调节作用。总之,该部分研究确定了RPCs及其衍生细胞类型的关键TFs,并在转录组学和表观基因组学水平上证明了几个重要TFs的细胞类型特异性。
图2 视网膜细胞转录组学和表观遗传学水平基因调控网络的构建
3.人胚胎MGCs的分类
作者进一步探究了视网膜胶质细胞的发育,对MGCs进行了分类确定了三个亚群。MGC1主要富集于蛋白质相关的生物过程,而MGC2主要响应外部环境,并可能参与胚胎视网膜发育过程中血管的生成。MGC2高表达一些黄斑特异性基因,包括FRZB、PTGDS和DIO2,表明MGC2可能是位于黄斑区的一群MGCs。此外,MGC2表现出与视锥细胞(中心凹唯一的光感受器类型)更强的相互作用,且黄斑区MGC2与Cones配受体对互作,这进一步支持了MGC2代表黄斑MGCs的猜想。
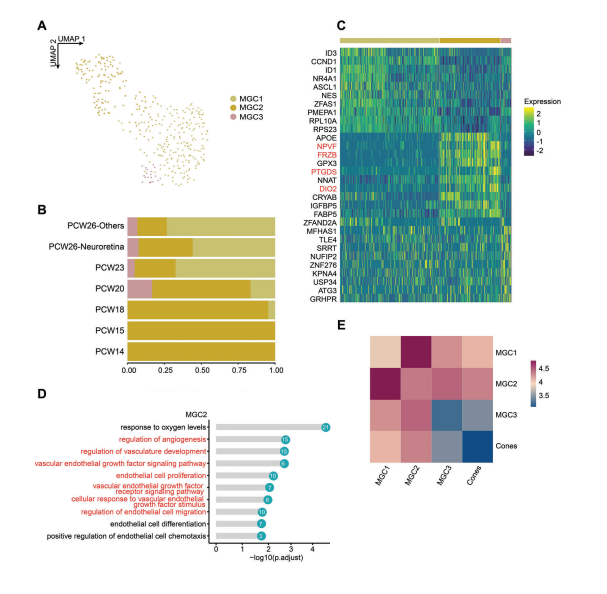
图3 MGC细胞亚群特征
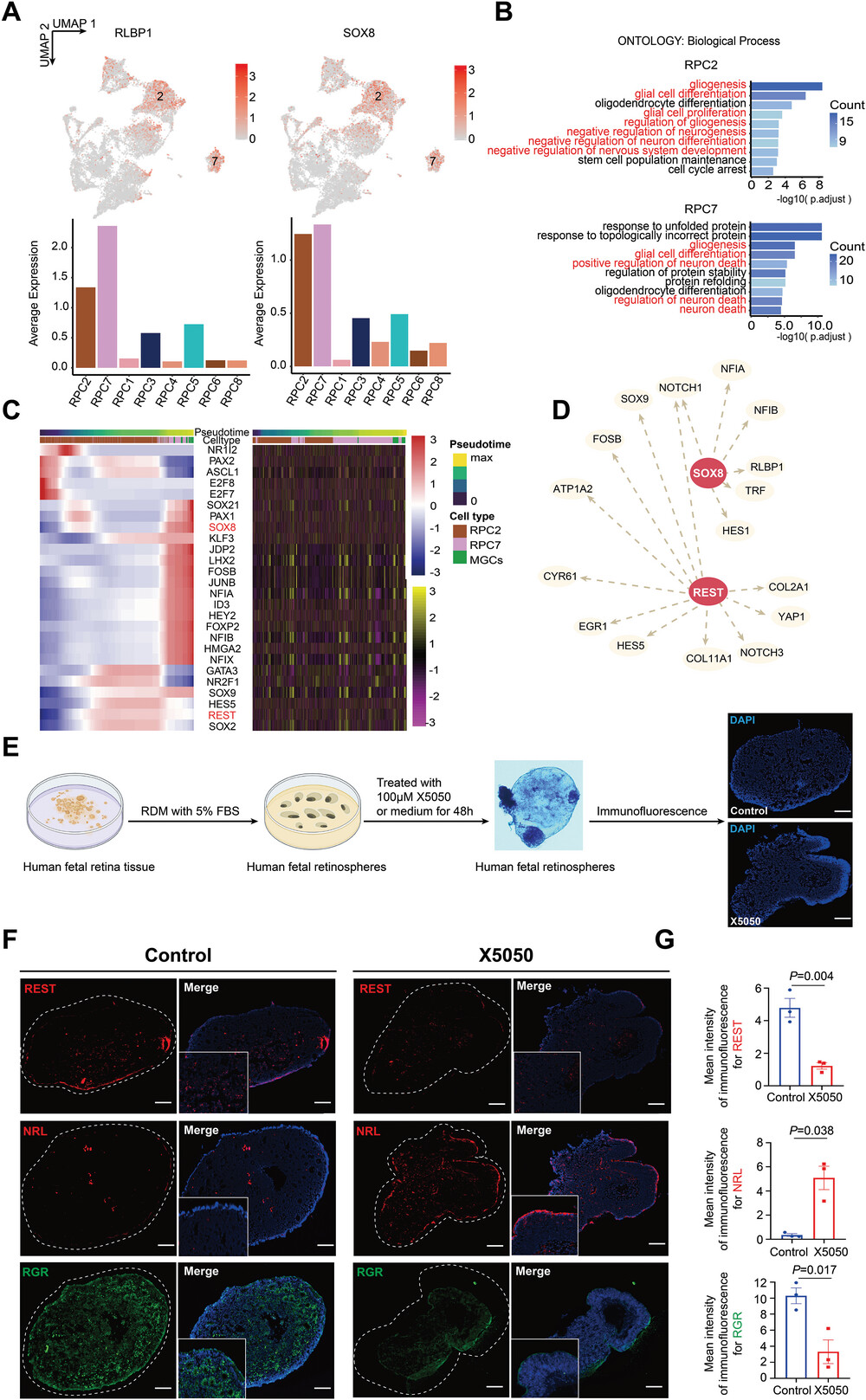
4.单细胞分辨率下人胚胎MGCs前体细胞亚群的鉴定
MGCs产生于RPCs发育后期,但目前很少有报道讨论胚胎视网膜中未成熟的MGCs或MGC前体细胞。作者将RPCs划分亚群并评估了它们的基因表达模式。从PCW18开始,RPC2和RPC7出现,并高表达NFIB、NFIX、RLBP1和SOX8。此外,它们的相关功能在胶质细胞增殖和分化过程中富集,因此,作者推测RPC2和RPC7可能是MGC前体亚群。通过拟时序及SCENIC分析构建了关键TFs的相对表达图,以及它们的Motif在逐渐分化状态下的相应富集。结果显示,REST在RPC2和RPC7中表现出高染色质可及性和表达,而SOX8在RPC7到MGCs中表现出染色质可及性和表达的逐渐增加。
为了验证REST在胚胎RPCs向MGCs发育的作用,作者培养和诱导了MGCs出现之前的早期PCWs(PCW11-PCW14)的胚胎视网膜分化并形成视网膜微球,然后用REST抑制剂X5050处理。在X5050处理后,RGR(标记的MGCs)的表达显著降低,而NRL(标记的杆状细胞)的表达则增加。尽管干预后双极细胞和视锥细胞数量无显著差异,然而,与干预前相比,视网膜分化的结构更加成熟完整,细胞排列更规整。因此,REST除了在维持RPCs和MGCs中发挥重要作用外,还可能影响视网膜神经元的产生。总的来说,该部分研究描述了从RPCs中形成MGCs的过程,定义了RPCs中MGCs前体的一个子集,并验证了REST在视网膜发育中的独特作用。
5.神经源性视网膜祖细胞的分化潜能及其内在联系
为了深入了解神经元细胞的分化,作者对NPCs进行亚分类。NPC3出现最早,其中99.9%处于G2M/S期,表明NPC3是由RPCs发育而来的最早的过渡性多能亚群。具有高特异性表达POU4F2、GAP43和SNCG的NPC4作为RGC谱系的前体;具有高特异性表达TFAP2C, PTF1A和PRDM13的NPC2作为HC/AC谱系的前体。接下来,作者对RPCs和NPCs的亚群进行了PAGA分析,NPC亚群间的内在联系明显强于RPC亚群间的内在联系。此外,视网膜特异性神经前体的连接轨迹呈现逐渐有限的分支过程,表明视网膜特异性神经前体的产生具有一定程度的规律性。多能性NPC3亚群最初默认局限于RGC谱系,在之后的发育过程中一些细胞的命运规范转向HC/AC谱系。
综上所述,作者探索并表征了NPC亚群的内部异质性,阐明了NPC内部密切相关的发展轨迹。
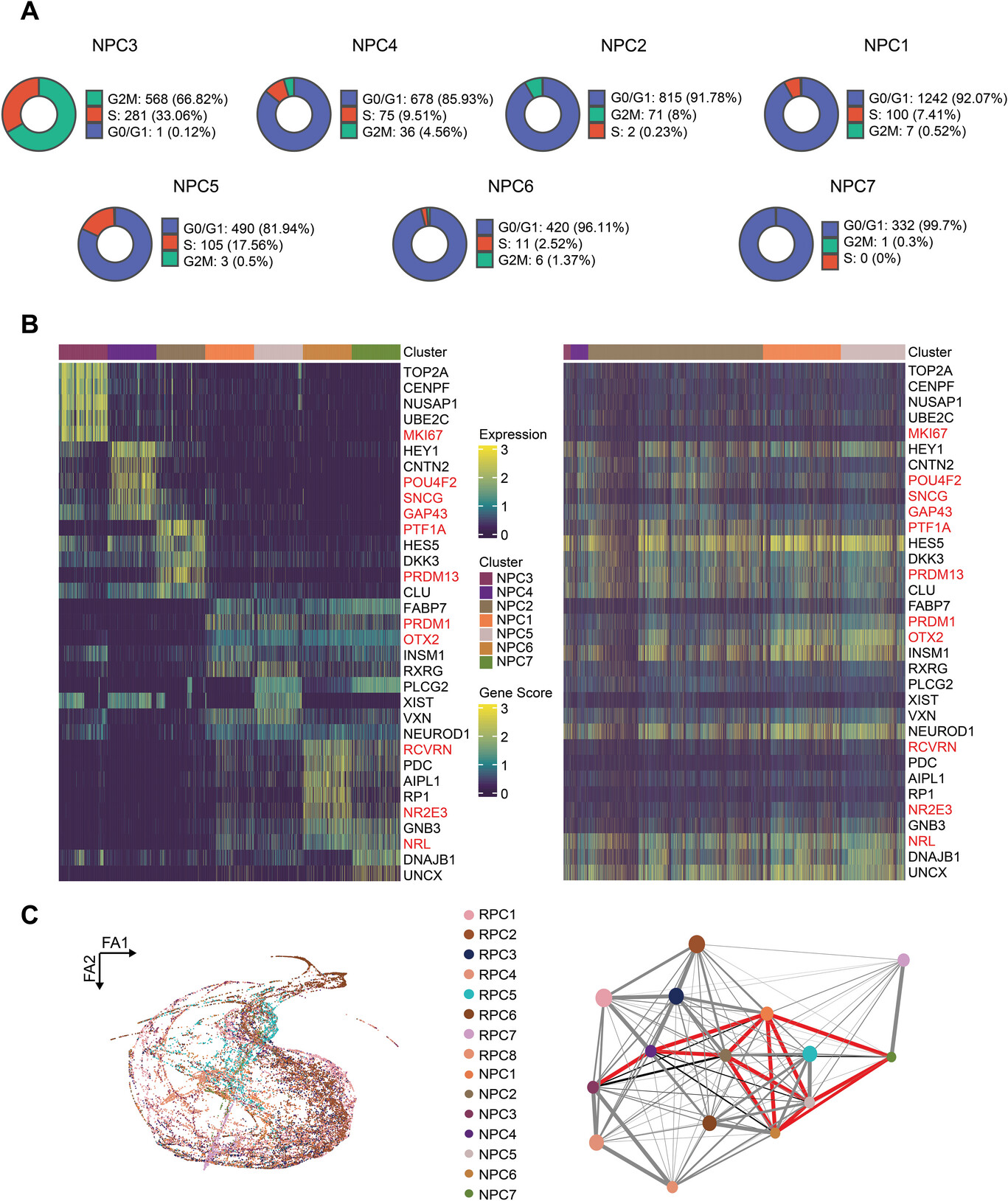
6.胚胎视网膜神经元发育过程中染色质可及性和表达动态
作者进一步探索了哪些TFs负责特定神经元谱系的分化,并构建了每个谱系发育的转录和表观遗传图谱。在NPC4亚簇(RGC前体)中,ATOH7和DLX2 motif的表达和染色质可及性丰富,表明这两个motif对驱动RGC命运限制至关重要。此外,作者还检测到ONECUT1对HCs命运规范的限制性作用,这反映在ONECUT1及由其调控的HCs特异性因子,如PROX1和LHX1在HC前体及HCs中的高表观遗传水平和转录水平。
值得注意的是,ONECUT3对HCs的发育有明显的影响。因此,作者对HCs进行了亚群细分,鉴定了HCs中几个可变的开放区域。这些区域的大部分在HC/AC前体阶段NPC2可以进入,并且在HC亚群中显著增加。接下来作者分析了这些开放区域的TF motif,几乎所有这些区域都包含ONECUT家族TF的motif,特别是ONECUT2。这些区域也可能被发育轨迹中“上游”的基因激活,如EBF3、MSX1和MSX2。PRDM1和VSX2是两种参与BC/PH谱系特异性的拮抗TF,分别对光感受器和BC在最终状态下的命运选择至关重要。结合之前的结果,该部分分析证明了从RPCs发育至特定神经元类型的关键转录调控因子。
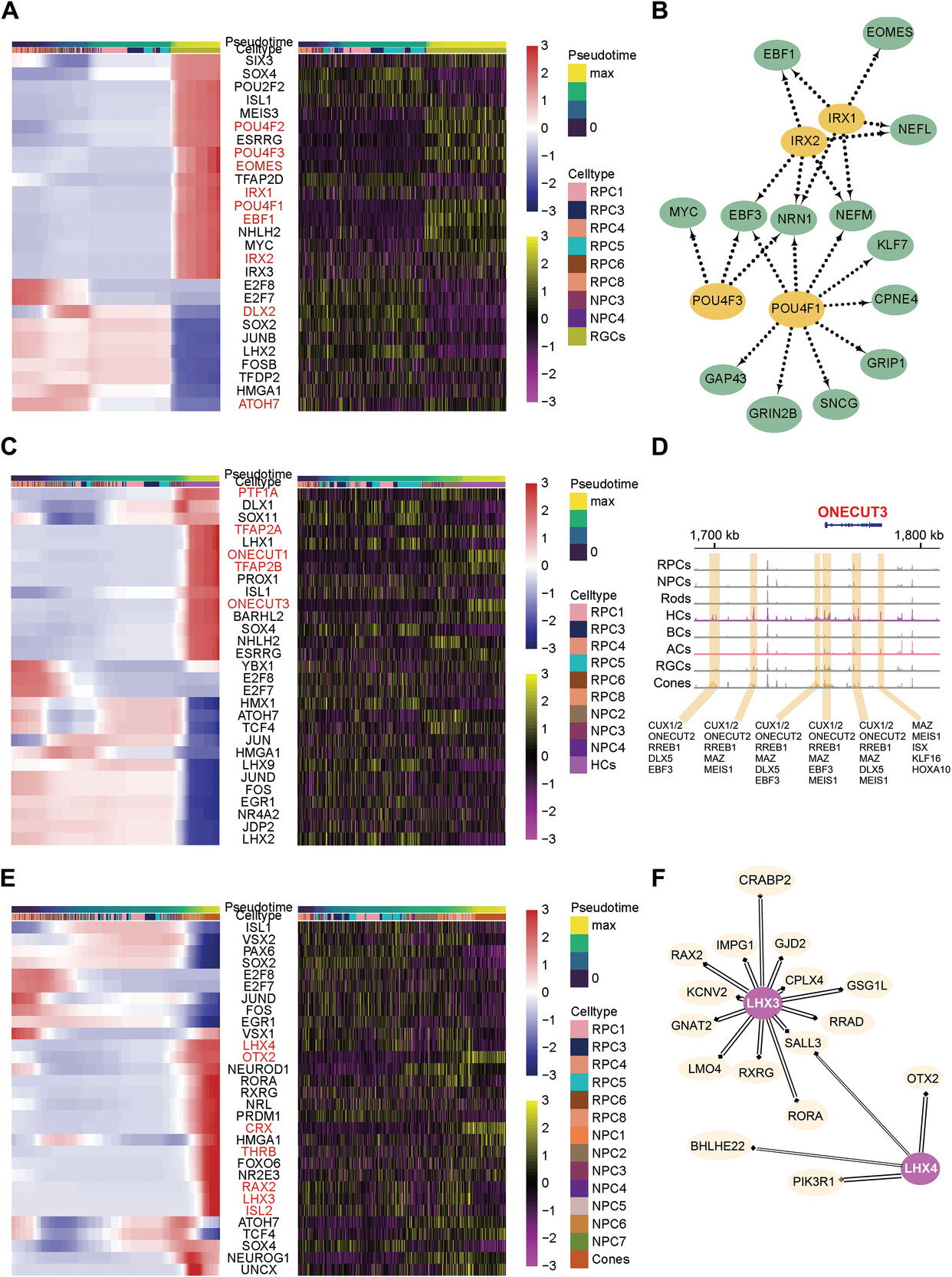
图6 视网膜神经元谱系发育的转录组学和表观遗传学图谱
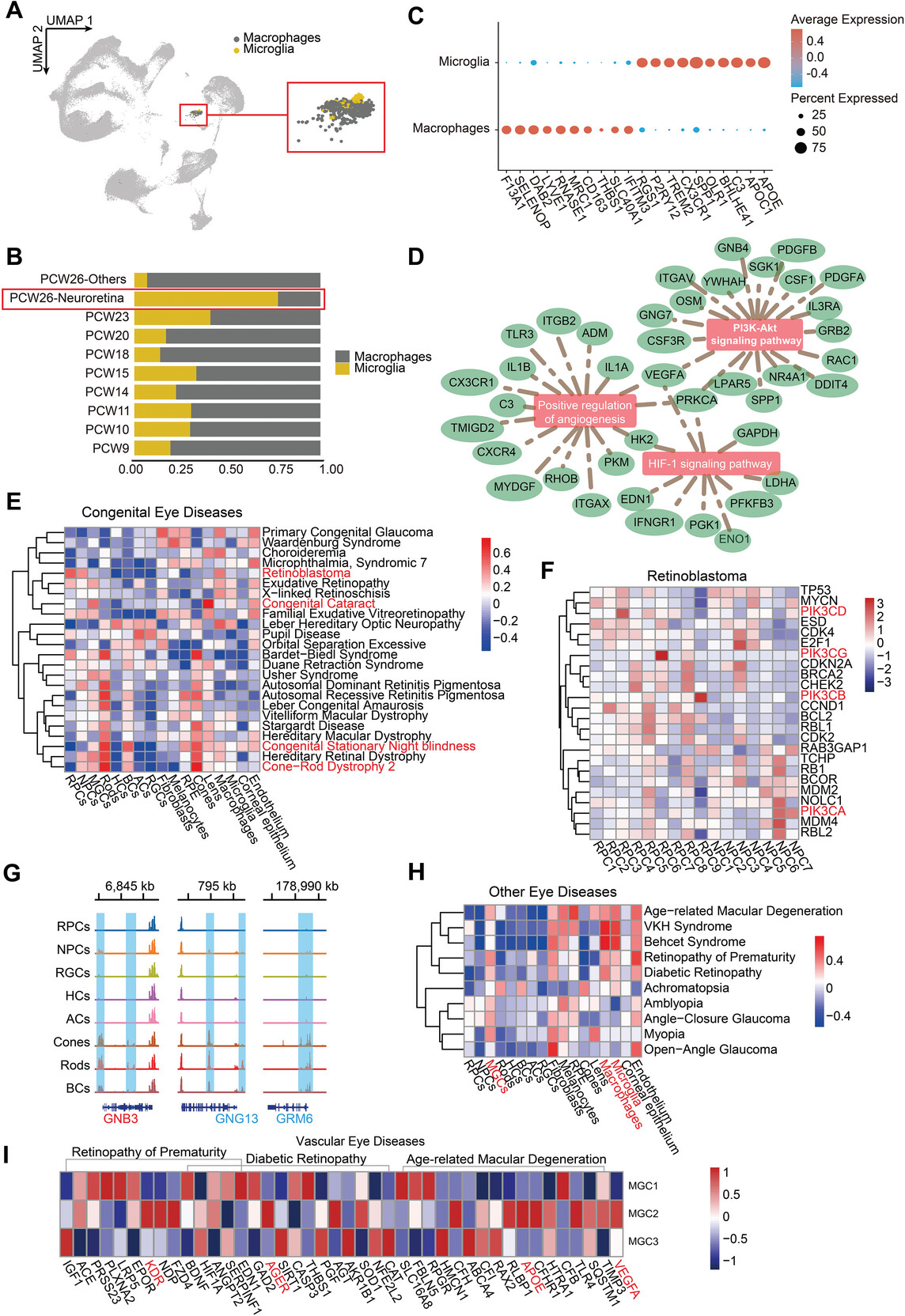
7.胚胎免疫细胞和人类眼病相关性
鉴于小胶质细胞和巨噬细胞对正常视网膜发育至关重要,作者用它们各自的特异性标记来注释这两个细胞类型,发现小胶质细胞在视网膜中有数量优势。小胶质细胞的相关功能主要富集在积极调节胚胎期眼球血管生成和血管发育通路。
作者进一步利用DisGeNet和RetNet数据库中各种先天性和其他眼病的前25位疾病相关基因,利用GSVA分析探究这些基因在细胞群中的分布,发现不同类型的疾病相关基因存在细胞类型差异,如锥杆视网膜营养不良-2的光感受器缺陷和先天性白内障的晶状体变性。此外作者观察到PI3K家族基因在视网膜神经元前体(包括PKI3CA、PKI3CB、PKI3CD和PKI3CG)中的表达升高,这与PI3K靶向抑制剂治疗视网膜母细胞瘤的有效性一致。在mGluR6观察到高染色质可及性,包括GRM6、GNB3和GNG13,这些突变是完全型CSNB的第三大常见原因。在其他眼病中,年龄相关性黄斑变性(AMD)、糖尿病性视网膜病变(DR)和常见类型的葡萄膜炎的基因组在眼部常驻免疫细胞中明显表达更多。该部分结果阐述了小胶质细胞和巨噬细胞在胚胎眼发育过程中的差异,并展示了多种眼病相关基因在不同细胞中的分布情况。