1.IDO1抑制剂Navoximod促进HSV-1复制和HSV-1介导的肿瘤杀伤
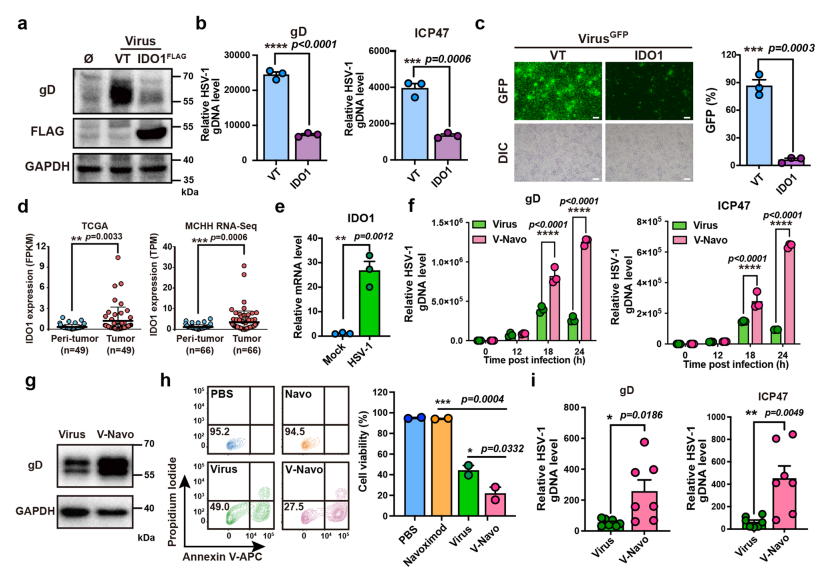
鉴于抗病毒免疫对HSV-1的清除是HSV-1溶瘤病毒治疗的主要障碍之一,本文首先探索抗病毒免疫的主要参与者,干扰素刺激基因(Interferon-stimulated genes,ISGs)中抑制HSV-1复制的基因,以优化基于HSV-1的病毒治疗。研究发现,ISGs之一的IDO1在HSV-1感染后表达上调,IDO1过表达显著抑制病毒在肝癌细胞中的复制。结合已报道的IDO1的免疫调控作用,认为在HSV-1溶瘤病毒治疗中有必要阻断IDO1以增强其疗效。
Navoximod是一种具有高度选择性的IDO1抑制剂,已在临床研究中用于抗肿瘤免疫治疗。本文进一步探讨利用Navoximod靶向抑制IDO1是否可以逆转对HSV-1复制的抑制。研究证实,Navoximod在体内和体外均能增强HSV-1的复制和溶瘤作用,提示HSV-1与Navoximod联合治疗的潜力和优势。
图1 HSV-1与IDO1抑制剂Navoximod联合用药效果
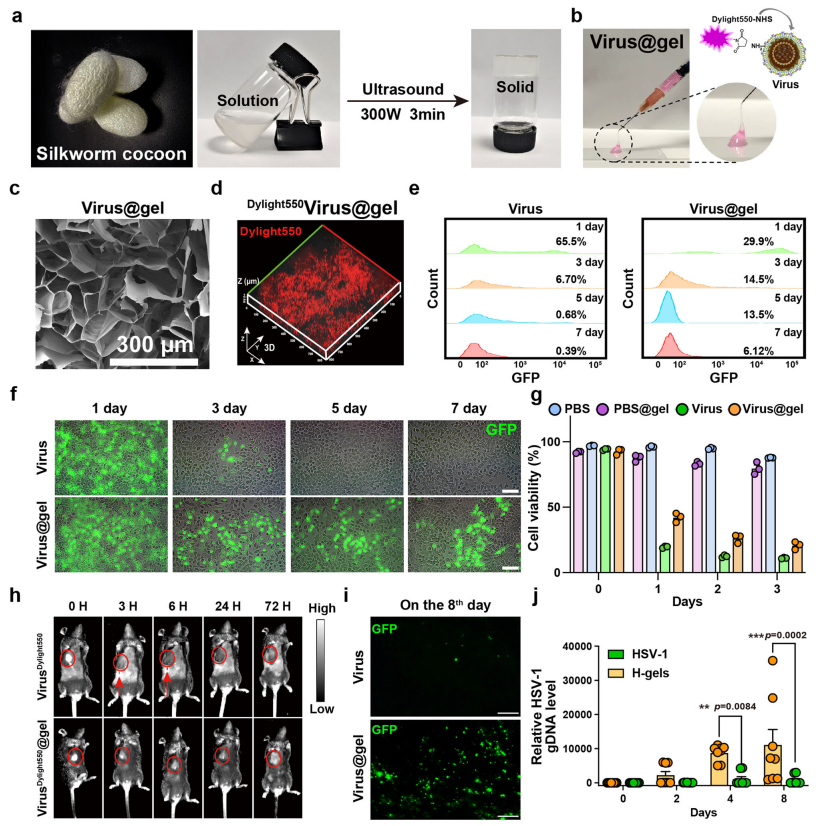
2.丝蛋白水凝胶是一种很有前途的递送溶瘤病毒的平台
为了提高病毒在肿瘤部位的富集效率,引入了蚕茧丝素合成的的丝蛋白水凝胶作为病毒的肿瘤内递送系统。将HSV-1包封到丝蛋白水凝胶中(Virus@gel),Virus@gel具有可注射性和凝胶性,并具有良好的力学性能和材料稳定性。细胞活力测定表明Virus@gel具有良好的溶瘤作用。此外,体内动物实验表明,丝蛋白水凝胶有效延长了病毒颗粒在肿瘤部位的滞留时间,促进病毒在瘤内的复制,并降低病毒的全身毒性。这些结果表明丝蛋白水凝胶包封的溶瘤病毒具有良好的肿瘤杀伤能力和生物安全性,使其成为潜在的病毒治疗递送平台。
图2 HSV-1丝蛋白水凝胶(Virus@gel)的制备与体外表征
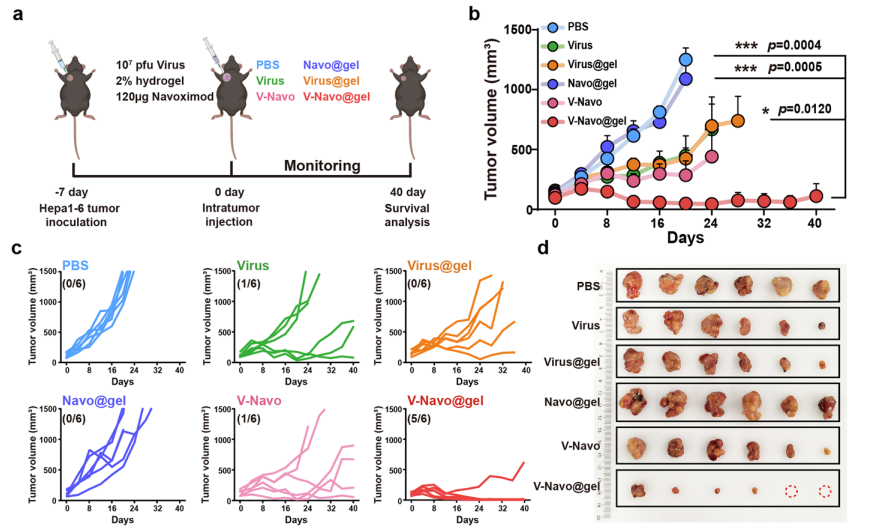
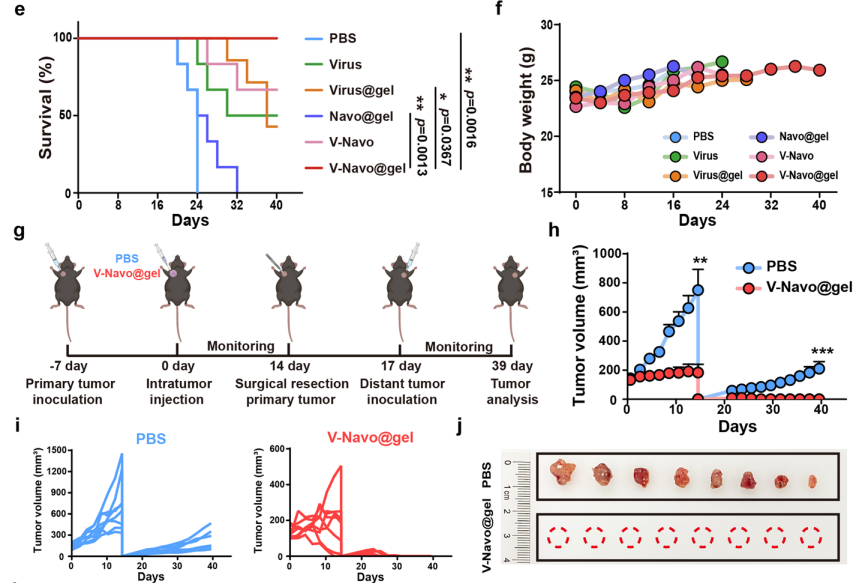
3.V-Navo@gel在小鼠模型中表现出强大的抗肿瘤的能力
在此基础上,进一步探讨了V-Navo@gel(包封有HSV-1/Navoximod的丝蛋白水凝胶)在肝癌小鼠皮下模型中的抗肿瘤作用。与阴性对照组相比,V-Navo@gel治疗组中肿瘤受到最显著的抑制作用,该组小鼠在治疗后40天内全部存活,表明V-Navo@gel能够有效抑制肿瘤生长,并显著延长荷瘤小鼠的生存期。本文还进一步证明,V-Navo@gel能引起机体产生强大的免疫记忆,从而有效抑制肿瘤的复发。
图3 HSV-1/Navoximod丝蛋白水凝胶(V-Navo@gel)在体内具有强大的抗肿瘤能力
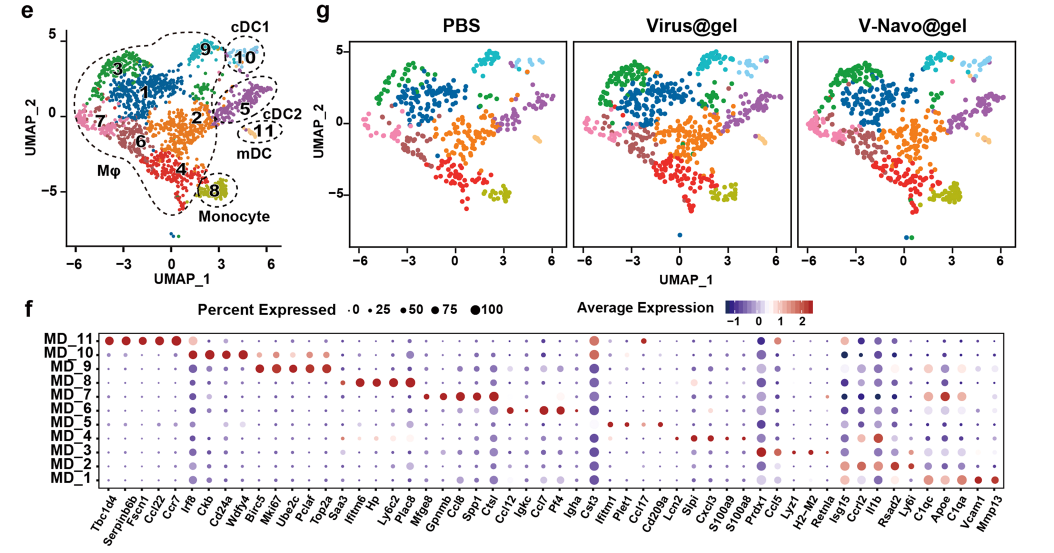
4.单细胞转录组测序表明V-Navo@gel重塑免疫抑制肿瘤微环境
为了对V-Navo@gel治疗组的小鼠肿瘤中的免疫细胞群和肿瘤-免疫相互作用进行更详细深入的分析,在瘤内注射PBS、Virus@gel或V-Navo@gel后分离肿瘤进行单细胞转录组测序(scRNA-seq)。V-Navo@gel导致NK细胞以及CD8阳性的细胞毒性T细胞明显富集。这两个细胞群的急剧增加解释了V-Navo@gel强大的抗肿瘤能力背后的机制。同时,辅助性T细胞也在V-Navo@gel治疗后富集,该细胞群能够通过激活效应T细胞和巨噬细胞等激活抗肿瘤免疫反应。
除此之外,V-Navo@gel对肿瘤微环境中的髓系细胞也起到了调节作用。与PBS组和Virus@gel处理相比,V-Navo@gel处理导致cDC1细胞明显富集,该细胞群可同时激活CD4+和CD8+T细胞并直接增强T细胞介导的抗肿瘤免疫。V-Navo@gel治疗后表达M1型标志物的巨噬细胞也发生了富集。M1型巨噬细胞通常被认为具有抗肿瘤的功能,该结果提示M1型巨噬细胞也参与了V-Navo@gel介导的抗肿瘤过程。
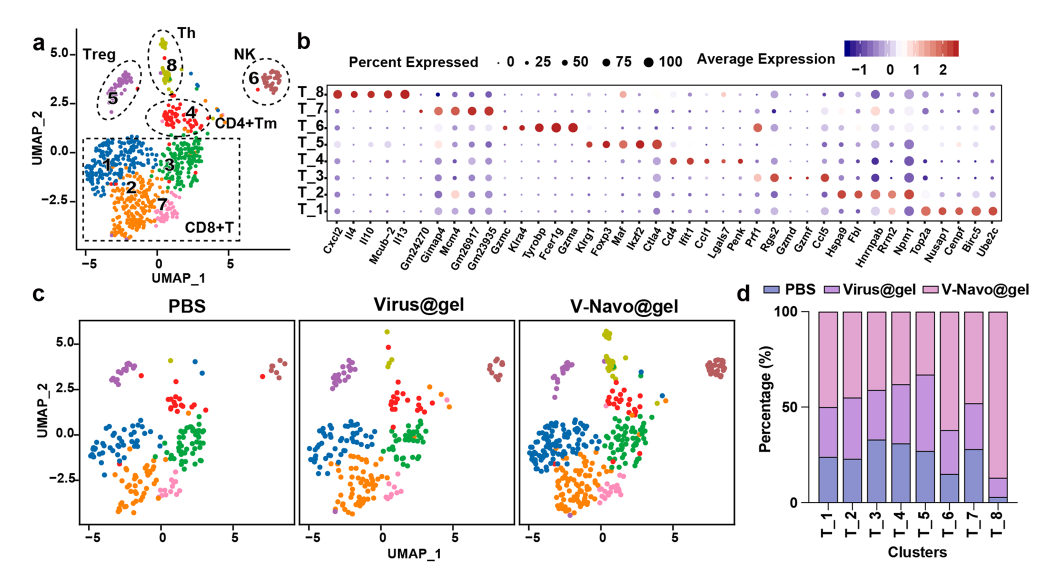
图4 scRNA-seq分析显示V-Navo@gel诱导了肿瘤免疫微环境的重编程
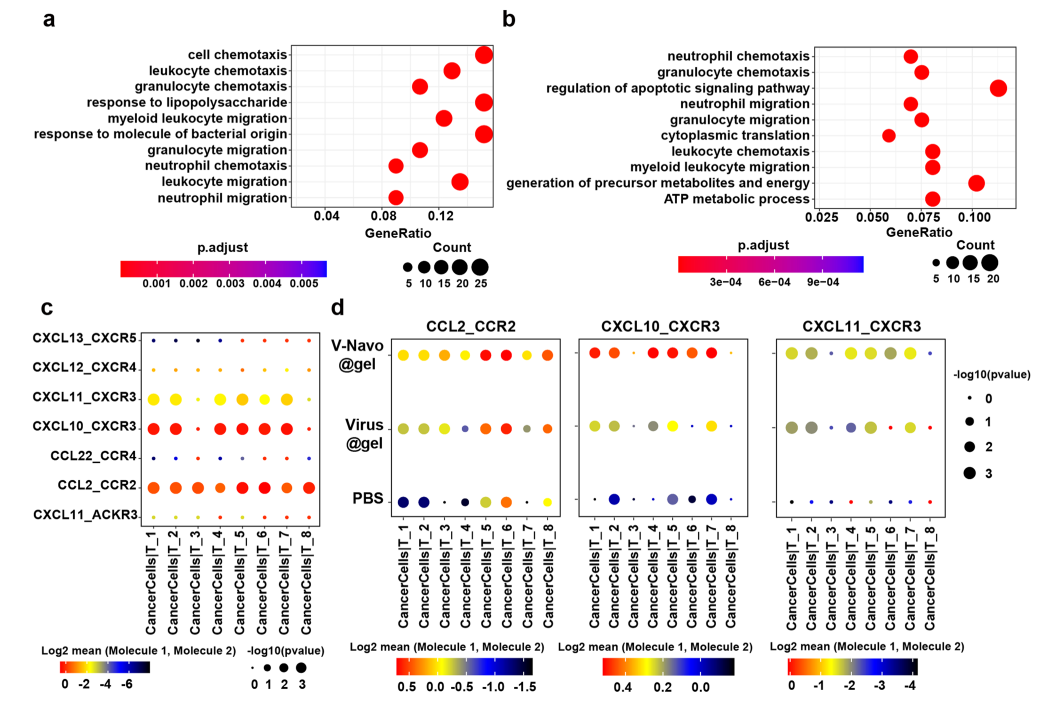
为了进一步评估V-Navo@gel对肿瘤细胞的影响,本文对肿瘤细胞的RNA测序结果进行了GO富集分析,发现V-Navo@gel处理后细胞趋化过程受到上调,CCL和CXCL家族基因高表达,该家族被认为可以调节免疫细胞的募集、分化和扩增。为了研究CCL和CXCL家族基因上调与V-Navo@gel诱导的T细胞依赖的抗肿瘤免疫之间的关系,使用CellphoneDB分析肿瘤细胞与T细胞之间的通讯情况。配体-受体分析显示,V-Navo@gel治疗显著增强CCL2/CCR2、CXCL10/CXCR3和CXCL11/CXCR3在肿瘤细胞与T细胞之间的相互作用。上述数据表明,除了直接作用于免疫细胞群外,V-Navo@gel治疗还通过调控肿瘤细胞的基因表达以促进T细胞向肿瘤部位的募集。
综上,本文通过单细胞转录组测序,对V-Navo@gel抗肿瘤作用背后的免疫学机制进行了详细的解读。
图5 scRNA-seq分析显示V-Navo@gel治疗调节了肿瘤细胞和T细胞之间的通讯
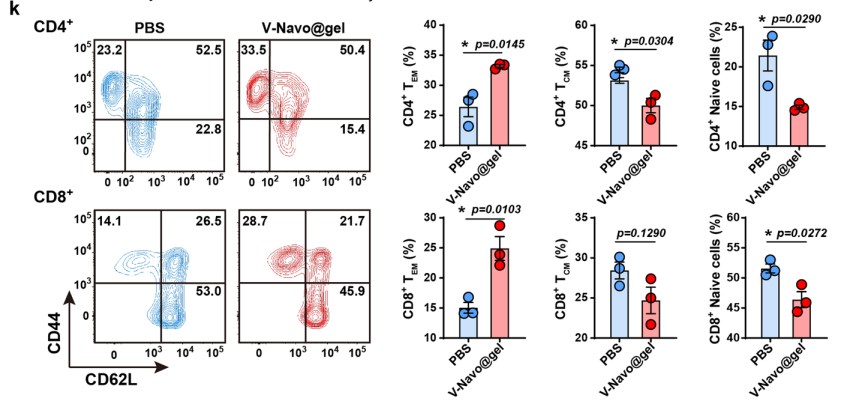
5.V-Navo@gel调控全身性抗肿瘤免疫应答
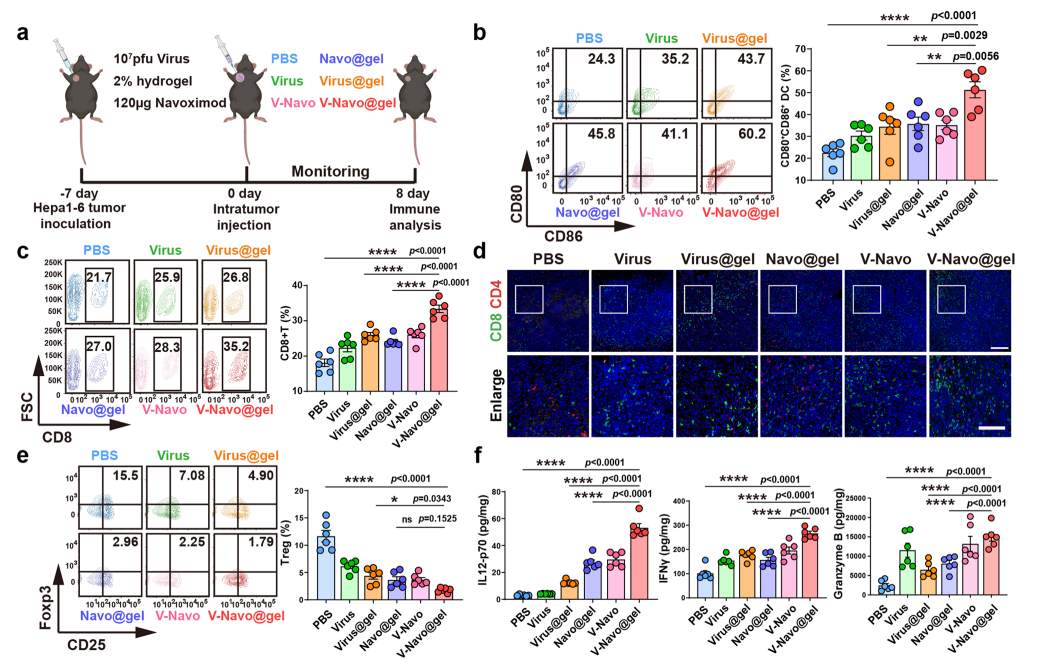
接下来,利用流式细胞分析和免疫组化染色等实验验证在scRNA-seq上观察到的V-Navo@gel导致的肿瘤免疫微环境的变化。结果表明,V-Navo@gel处理后,NK细胞、CD8+T细胞和调节性T细胞在肿瘤部位的浸润均发生明显变化。进一步的ELISPOT检测显示V-Navo@gel强有力地激活了肿瘤特异性CD8+T细胞的产生。qRT-PCR证实了V-Navo@gel对CCL和CXCL家族基因的调控作用。以上结果证实了scRNA-seq的结果,即V-Navo@gel对肿瘤免疫微环境进行了全面的重编程,从而实现有效的抗肿瘤溶瘤病毒治疗。
图6 V-Navo@gel在体内调节抗肿瘤免疫反应
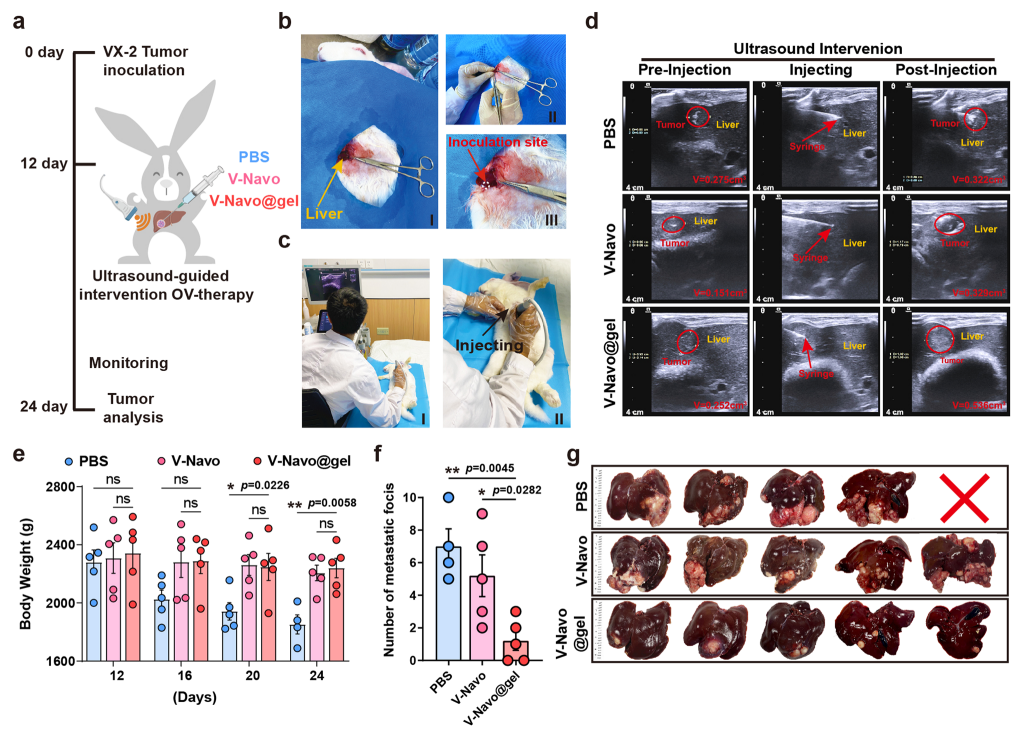
6.V-Navo@gel在大动物原位肝癌模型中能够发挥强大的抗肿瘤作用
为了进一步拓展V-Navo@gel的临床应用潜力,利用新西兰白兔构建肝癌原位模型,造模成功后将动物随机分为PBS、V-Navo和V-Navo@gel治疗组,在超声成像引导下将药物注射到肿瘤部位。结果表明,V-Navo@gel具有显著的抑制肿瘤的作用,且不影响动物的体重。综上,和小鼠模型类似,V-Navo@gel在大动物原位肝癌模型中也显示出强大的抗肿瘤作用。
图7 V-Navo@gel在兔原位肝癌模型中的抗肿瘤作用