1.组蛋白遗传受损导致乳腺癌MCF-7细胞的表观遗传重编程
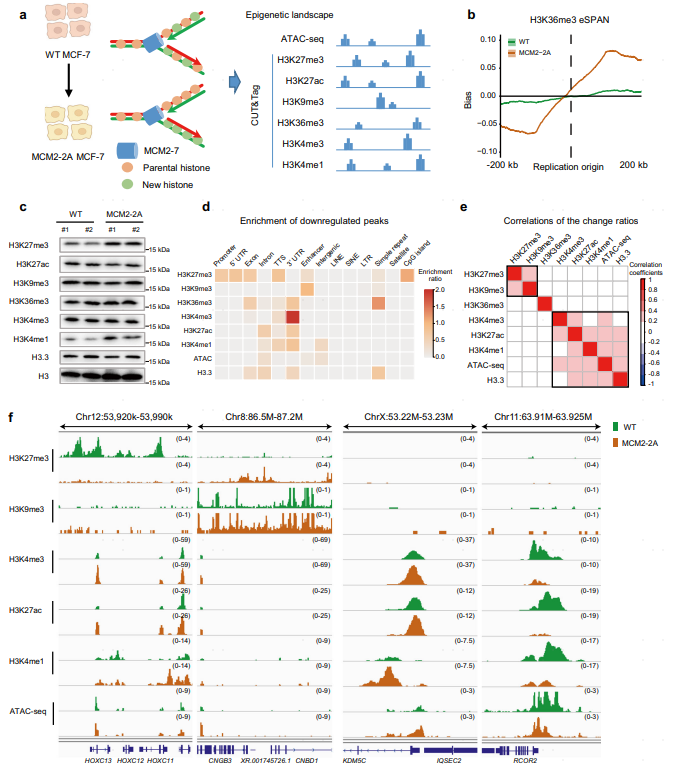
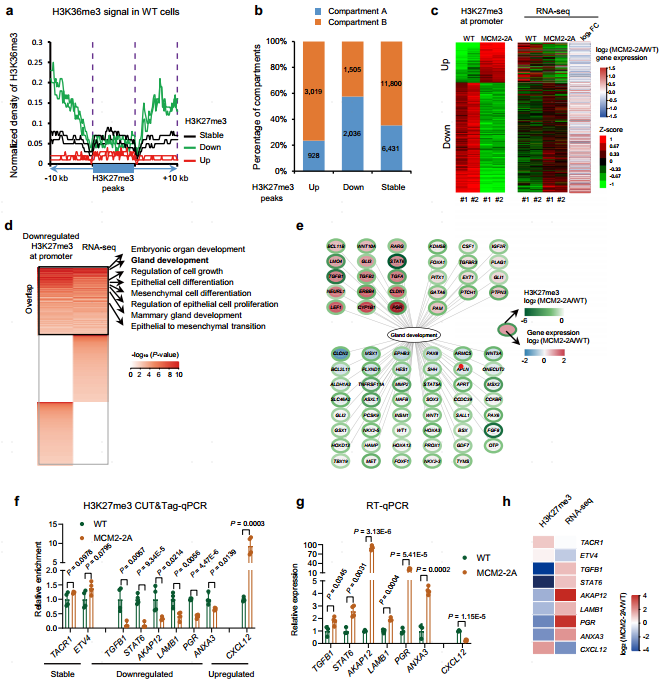
在人类乳腺癌细胞系中通过突变MCM2与组蛋白结合的结构域(MCM2-2A)或敲除POLE3(POLE3 KO MCF-7)成功构建了组蛋白遗传受损的肿瘤细胞模型,并发现破坏肿瘤细胞的组蛋白遗传后,肿瘤细胞的表观遗传谱发生了剧烈的改变,包括组蛋白的表达水平、分布、染色质可及性等。其中,H3K27me3的分布变化最为剧烈。H3K27me3是兼性异染色质的标志,主要负责抑制基因转录。组蛋白遗传失衡后,H3K27me3在基因启动子处出现严重丢失,且其丢失造成大量基因的去抑制,包括上皮细胞增殖、分化以及上皮间质转化(EMT)等大量与肿瘤进展相关的基因,导致这些通路的异常激活。
图1 组蛋白遗传受损导致肿瘤细胞的表观遗传谱剧烈改变
图2 破坏组蛋白遗传重构H3K27me3分布,并导致肿瘤进展相关基因的去抑制
2.组蛋白遗传受损可促进体内肿瘤的生长和侵袭
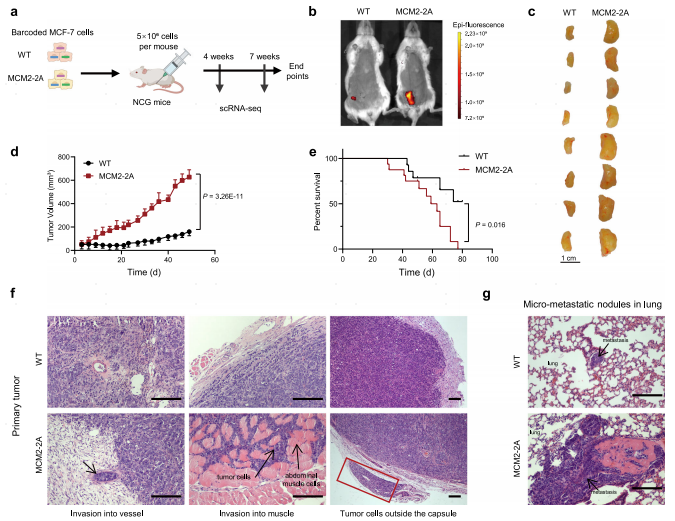
将MCM2-2A突变或WT MCF-7细胞原位移植到免疫功能受损的小鼠乳腺中,发现MCM2-2A突变小鼠肿瘤的生长速度显著增快、侵袭性增强、肺转移显著增多、总存活率显著降低,并在MCM2-2A和POLE3 KO MCF-7类器官中发现了同样的结果,表明亲代组蛋白遗传受损可促进肿瘤生长,促进肿瘤细胞转移。
图3 亲代组蛋白遗传受损促进体内乳腺肿瘤生长和转移
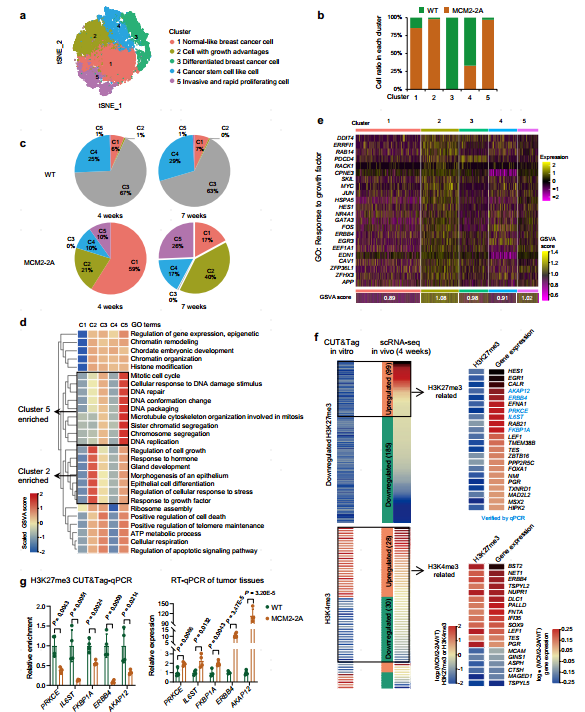
3.组蛋白遗传障碍通过形成不同的亚克隆促进肿瘤发展
为了在单细胞水平上表征MCM2-2A突变肿瘤的进化,对原位移植后4周或7周收集的小鼠肿瘤样本进行了scRNA-seq。细胞分群将肿瘤细胞分成5个亚群,亚群2和5几乎完全由MCM2-2A突变细胞组成。亚群2高表达了调控细胞生长、激素应答、上皮细胞分化和腺体发育的基因;亚群5表达与DNA复制、有丝分裂细胞周期和细胞增殖相关途径相关的基因,且高表达了与乳腺癌患者侵袭、转移相关的基因集,表明这2个亚群是导致肿瘤细胞快速增殖和侵袭性增强的主要因素。
将CUT&Tag数据与scRNA-seq数据进行关联,筛选靶基因与肿瘤生长、增殖和转移相关的H3K27me3下调或H3K4me3失调的启动子,并探讨其对体内基因表达的影响,发现在移植后4周35%因H3K27me3缺失而下调的基因继续上调,大多数因H3K4me3表达失调的基因在移植后4周仍保持其表达模式的变化,显示组蛋白遗传受损通过表观遗传重编程促进肿瘤进展。
图4 组蛋白遗传受损促进肿瘤进化
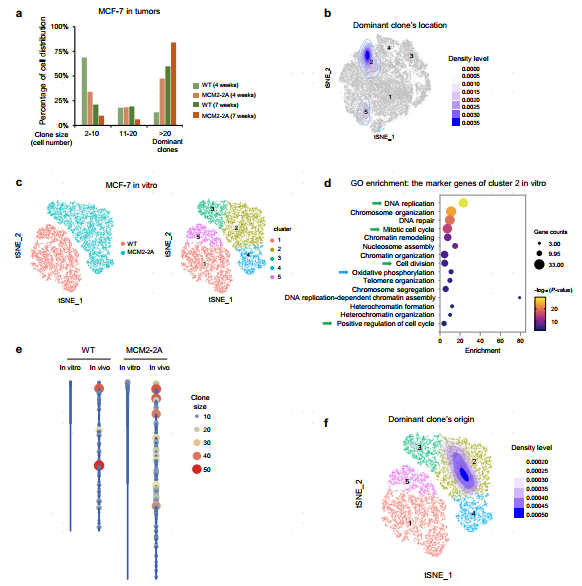
4.组蛋白遗传受损通过形成具有适应度优势的新克隆来驱动肿瘤进化
为了研究MCM2-2A突变细胞在体内的克隆进化,利用原位移植后4周或7周的scRNA-seq数据,基于谱系追踪重建了克隆关系。发现在MCM2-2A突变肿瘤中,优势克隆在移植后7周逐渐取代MCM2-2A突变肿瘤,进一步发现构成优势克隆的细胞主要位于亚群2。
为了进一步研究肿瘤的进化机制,对MCM2-2A突变和WT MCF-7细胞进行scRNA-seq。细胞分成5个亚群,其中WT细胞中有2个亚群,MCM2-2A突变细胞中有3个亚群,这表明MCM2-2A突变细胞的转录多样性更高。亚群2高表达了调控DNA复制、有丝分裂细胞周期和细胞分裂的基因;一些由于H3K27me3缺失而受抑制的促增殖基因在亚群2中高表达。亚群2也高表达了参与染色质重塑和氧化磷酸化的基因。研究表明,氧化磷酸化的增加对人类乳腺癌的肺转移至关重要。谱系追踪结果显示,MCM2-2A肿瘤中能够生长为优势克隆的细胞主要来源于体外培养的亚群2。考虑到亚群2中高表达基因在体外的功能,研究者推测一些MCM2-2A突变细胞可能已经在体外获得了加速增殖的能力。这些结果表明亲代组蛋白的遗传受损可以抑制参与增殖和发育的基因,从而产生高水平表达增殖相关基因的细胞,有利于优势克隆形成和驱动肿瘤生长。
图5 组蛋白遗传障碍驱动肿瘤的显性克隆形成