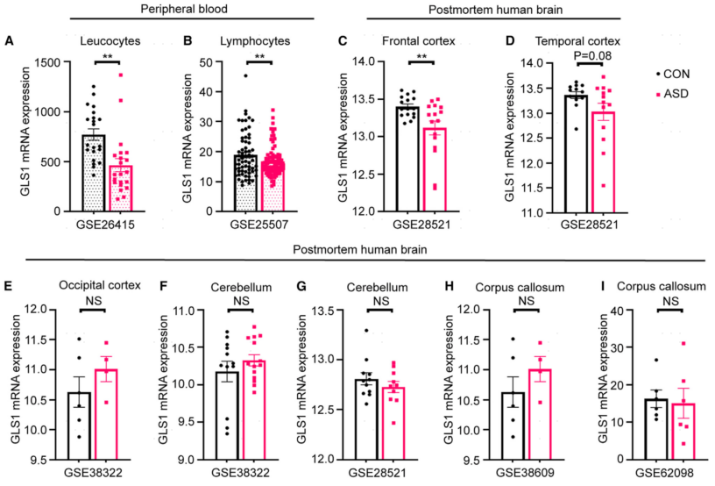
为评估Gls1在自闭症中的作用,作者分析了来自不同队列的ASD患者及其匹配的对照样本中Gls1的转录水平。实验发现:与对照组相比,ASD患者外周血的白细胞和淋巴细胞中的Gls1转录水平显著降低。此外,ASD患者的额叶皮层和颞叶皮层Gls1 转录水平也降低。然而,ASD患者的枕叶皮层、小脑和胼胝体中均未观察到Gls1转录水平的显著变化。这些结果表明ASD患者的额叶组织中Gls1转录水平与ASD的发病有关。
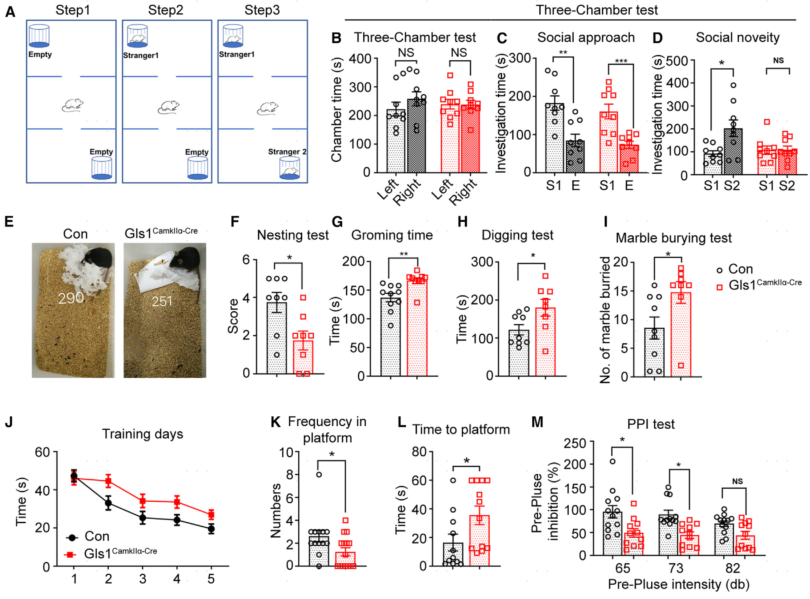
为了研究Gls1缺失是否会出现ASD相关行为,作者进行了一系列自闭症相关的行为学实验,包括三室实验、公共筑巢行为、自我修饰测验、挖掘测验、埋弹测验、Morris水迷宫测试和恐惧条件反射,结果显示:与对照组相比,Gls1CamKIIα-Cre小鼠社交新奇时间减少,筑巢得分明显较低,刻板行为(自我修饰测验、挖掘测验和埋弹测验)增多,Morris水迷宫穿越水下平台的区域次数降低且寻找水下平台时间增加,前脉冲抑制显著降低。这些结果表明:Gls1CamKIIα-Cre小鼠出现新奇社交缺陷、刻板行为、学习记忆下降、感觉运动门控受损。
图3 Gls1CamKIIα-Cre小鼠表现出社会互动缺陷、重复行为、空间学习和记忆受损以及感觉运动门控受损
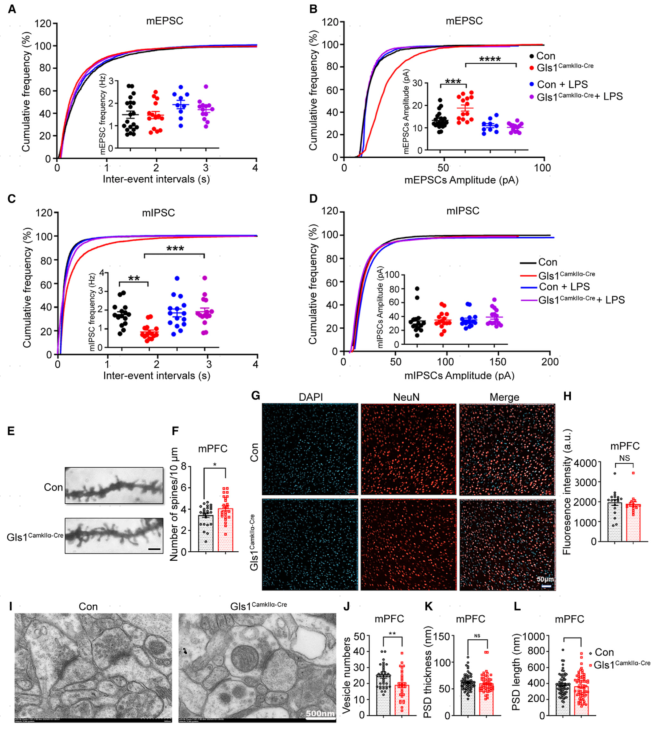
4.Gls1CamKIIα-Cre小鼠内侧前额叶皮层(mPFC)突触神经传递、树突棘密度和突触超微结构异常
为了研究Gls1在调节突触功能中的作用,在内侧前额叶皮层(mPFC)深层谷氨酸能锥体神经元中选择微兴奋性突触后电流(mEPSCs)和微抑制性突触后电流(mIPSCs)进行记录。结果显示:与对照组相比,Gls1CamKIIα-Cre小鼠神经元的mEPSCs振幅显著增加,表明突触后的AMPA受体的功能或数量更高,而突触前的囊泡中谷氨酸的释放不受影响;此外,与对照组相比,Gls1CamKIIα-Cre小鼠的mIPSCs频率显著降低,表明活性可释放囊泡减少或锥体神经元的GABA能输入减少。
使用高尔基-考克斯染色实验评估Gls1CamKIIα-Cre小鼠的Gls1缺失是否会诱导mPFC突触结构的改变,结果显示Gls1CamKIIα-Cre小鼠锥体神经元树突棘密度显著上调。此外,使用电子显微镜对突触进行超微结构分析,结果显示:与对照相比,Gls1CamKIIα-Cre小鼠突触前囊泡数量显著减少,突触后密度的厚度和长度无明显变化。
图4 Gls1CamKIIα-Cre小鼠mPFC突触神经传递、树突棘密度和突触超微结构异常
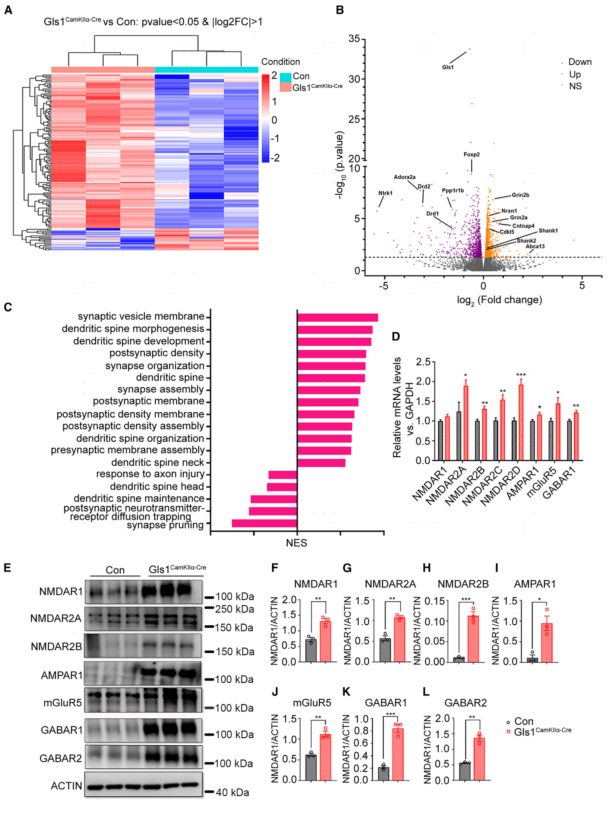
5.Gls1CamKIIα-Cre小鼠PFC突触功能和自闭症相关基因表达水平紊乱
为了剖析Gls1介导的突触功能和结构缺陷以及自闭行为改变的分子机制,对小鼠的PFC组织进行bulk RNA-seq。分析结果显示:与对照小鼠相比,Gls1CamKIIα-Cre小鼠的PFC中有133个基因下调和20个上调基因。基因集富集分析显示Gls1CamKIIα-Cre小鼠PFC组中突触囊泡膜、突触后密度或树突棘密度相关的通路显着上调,突触修剪和突触后神经递质受体扩散捕获等通路显着下调。然后通过RT-PCR和western blot确认关键突触相关基因的转录水平和蛋白水平,分析结果发现:与对照小鼠相比,Gls1CamKIIα-Cre小鼠PFC中突触相关基因转录水平和蛋白表达水平都显著增加。
这些分析表明,Gls1CamKIIα-Cre小鼠PFC突触功能和自闭症相关基因表达水平升高。
图5 Gls1CamKIIα-Cre小鼠PFC突触和自闭症相关基因表达水平紊乱
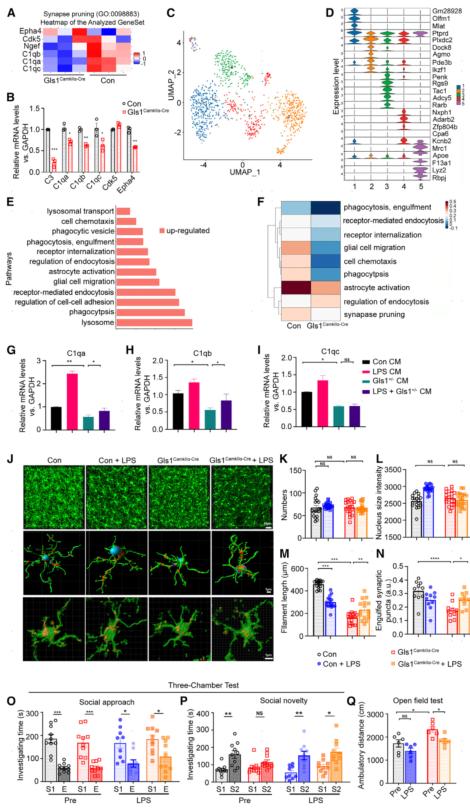
6.低剂量脂多糖(LPS)可挽救Gls1CamKIIα-Cre小鼠的异常小胶质突触修剪、突触功能障碍和行为障碍
为了解释小胶质细胞是如何影响Gls1CamKIIα-Cre小鼠的突触修剪,对Gls1CamKIIα-Cre小鼠和对照小鼠PFC进行了单细胞核转录组测序(snRNA-seq),共鉴定了5种不同的小胶质细胞亚型,它们具有不同的功能细胞特征。发现小胶质细胞亚型2参与突触修剪相关过程的基因显著上调,如吞噬作用、内吞作用、迁移以及溶酶体和溶酶体转运,这表明小胶质细胞亚簇2可能是Gls1CamKIIα-Cre小鼠突触修剪减少的原因,而后作者发现与对照小鼠相比,Gls1CamKIIα-Cre小鼠小胶质细胞亚型2中的突触修剪及其相关生物学过程显著下调。
随后作者探寻LPS处理是否可以改善小胶质细胞的突触修剪功能,作者通过体外神经元-小胶质细胞共培养体系发现:与对照组相比,在与Gls1+/-小鼠神经元共培养的小胶质细胞体系中,与突触修剪相关3个基因(C1qa、C1qb、C1qc)转录水平明显降低,但LPS处理后的C1qa、C1qb转录水平又有所升高。
另外在体实验中作者发现,Gls1CamKIIα-Cre小鼠mPFC中的小胶质细胞数量和胞体的大小并无明显的变化。但是与对照组相比,Gls1CamKIIα-Cre小鼠组的小胶质细胞纤维丝的长度缩短,被小胶质细胞吞噬的突触水平显著降低,并且这种现象可以被LPS处理所修复。
接下来在行为学上进行实验验证,分析发现Gls1CamKIIα-Cre小鼠出现新奇社交缺陷(三室实验中社交新奇时间减少)、刻板行为(露天运动距离增加),但是这种异常行为可以被LPS处理所纠正,即:LPS处理后的Gls1CamKIIα-Cre小鼠三室中社交新奇时间增多,露天运动距离下降。这组实验从分子、行为学水平探究了低剂量LPS可挽救Gls1CamKIIα-Cre小鼠的异常小胶质突触修剪和行为障碍的机制。
图6 低剂量LPS可挽救Gls1CamKIIα-Cre小鼠的异常小胶质突触修剪和形态以及行为障碍