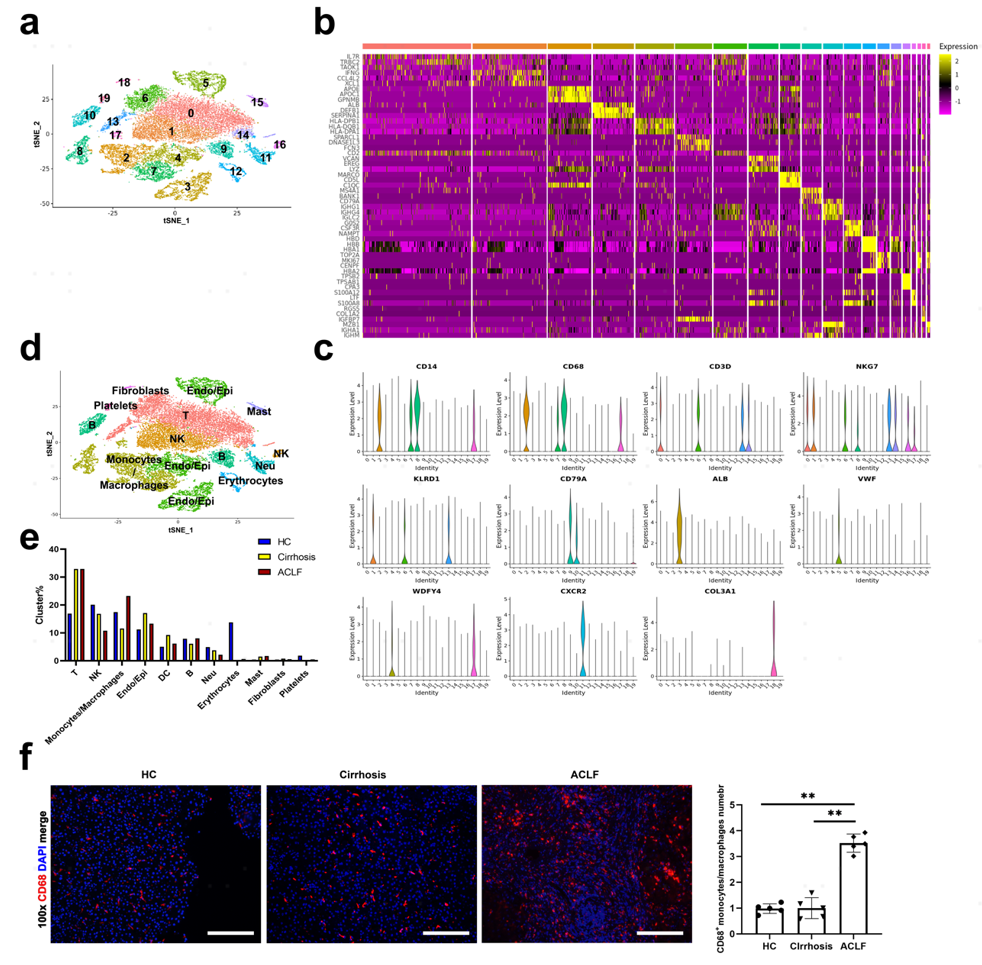
1.scRNA-seq显示ACLF患者肝脏中单核细胞/巨噬细胞浸润显著增加
从2例健康人(HC)、3例肝硬化患者和5例ACLF患者的肝脏样本中分离的肝脏非实质细胞通过scRNA-seq进行分析,联合分析注释后获得T细胞、NK细胞、单核细胞/巨噬细胞(Mono/Mac)、内皮/上皮细胞(Endo/Epi)、树突细胞(DC)、B细胞、中性粒细胞(Neu)、红细胞、肥大细胞、成纤维细胞和血小板。与肝硬化组相比,ACLF组中Mono/Mac显著增加。肝样品的CD68免疫荧光染色进一步证实,与HC和肝硬化组相比,ACLF肝中Mono/Mac浸润显著增加(图1)。
2.ACLF患者肝内Mono/Mac表现出明显的特征
由于ACLF肝脏中Mono/Mac浸润的显著增加,将Mono/Mac亚群细分获得了5个亚群(Mono1-Mono5)。HC和肝硬化患者的肝内Mono/Mac亚群特征相似,而ACLF患者的肝内Mono/Mac亚群特征明显。Mono1和Mono4在ACLF组中特征性富集,而与HC和肝硬化患者相比,ACLF组中Mono2和Mono3的占比降低。
Mono1的特征在于APOC1、TREM2、APOE的富集表达,表明该簇在脂质代谢和免疫调节中起作用。Mono4高表达TFPI、SPP1、JUND,其差异基因以及KEGG和GO分析表明该亚群与氧化应激和细胞凋亡有关。Mono2的特征在于富集表达LYZ、S100A8、S100A9,这与经典单核细胞相似。Mono3是经典Kupffer细胞(KCs)的亚群,具有MARCO、LYVE1、TIMD4等特征。Mono5在三个组中具有相似的比率,其特征在于表达MKI67代表增殖细胞(图2)。
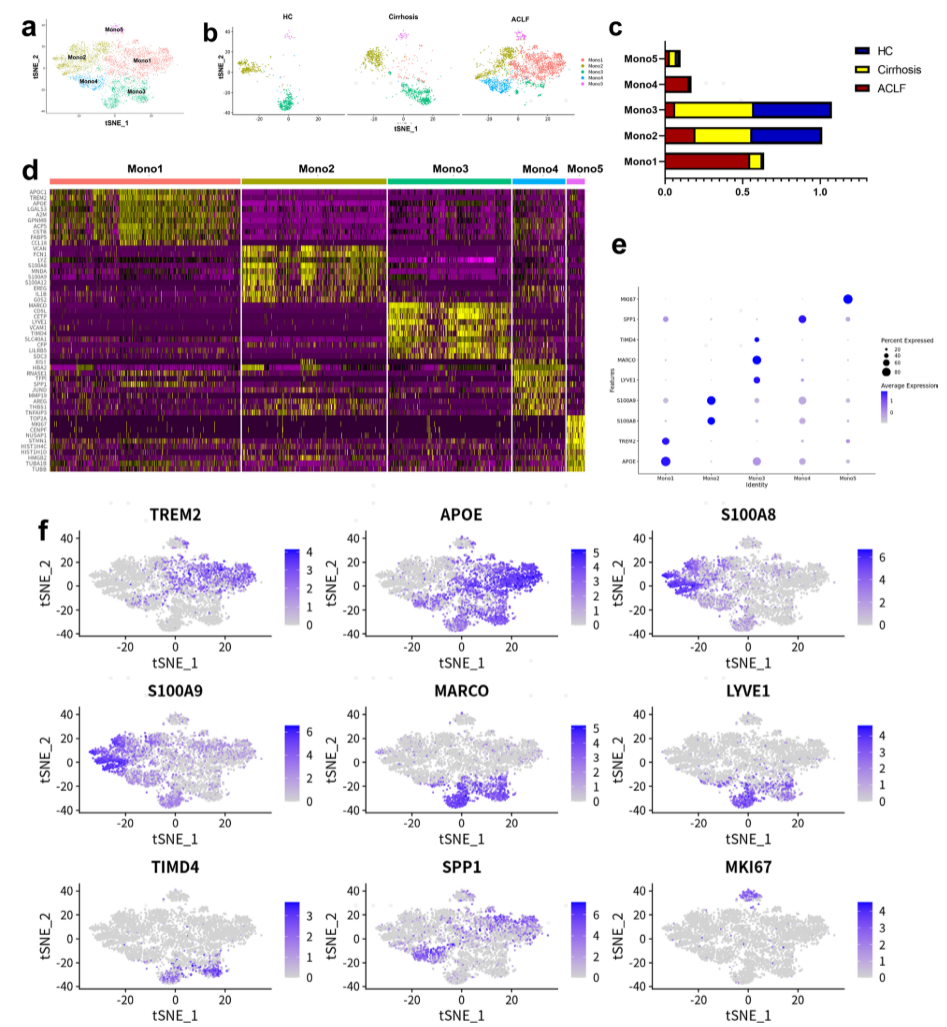
图2:肝脏中单核细胞/巨噬细胞的scRNA-seq分析
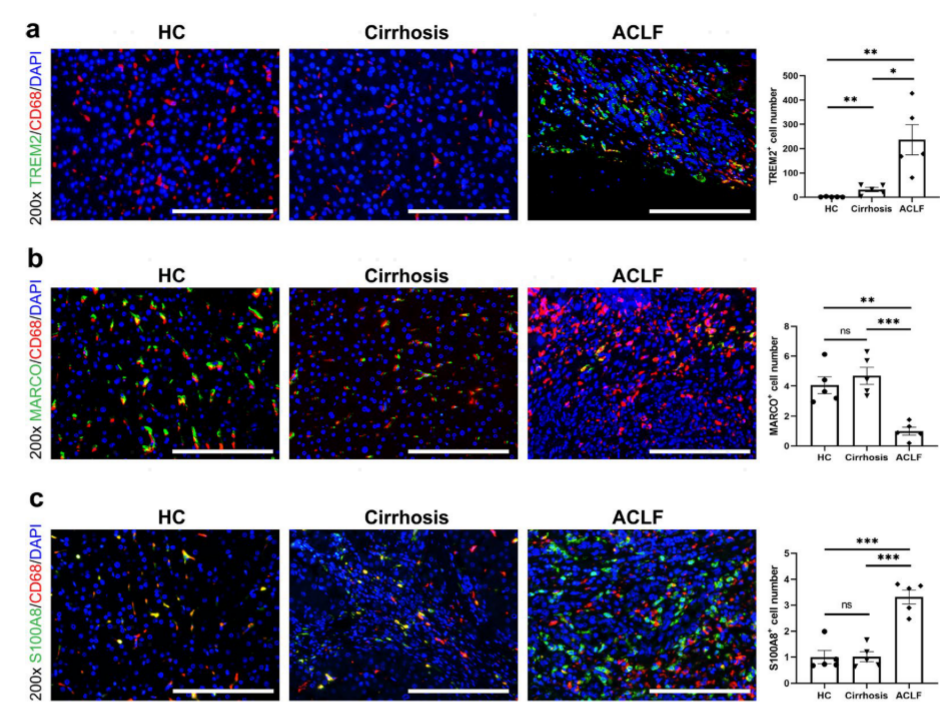
进行免疫荧光染色以进一步确认来自HC、肝硬化和ACLF组的肝脏样品中的Mono/Mac亚群。ACLF组的肝脏中存在显著增加的TREM2+ Mono/Mac浸润。相比之下,ACLF组中的MARCO+KC耗尽,HC和肝硬化组中的KC的细胞计数更高。(图3)。
图3:HC、肝硬化和ACLF患者肝脏单核/巨噬细胞团的典型免疫荧光图像
3.TREM2+ Mono1促进ACLF肝脏中的免疫抑制环境
ACLF的特征是强烈的全身炎症。同时,在对炎症反应的同时诱导免疫抑制,这增加了对感染的易感性。作者在来自ACLF和肝硬化患者的肝脏和血浆样品中检测到一系列炎症相关的细胞因子和趋化因子。ACLF患者血浆中促炎细胞因子和抗炎细胞因子水平均高于肝硬化患者。当比较ACLF组的血液和肝脏样本的结果时,除了TNF-α、MCP-1和IL-8外,肝脏样本也显示出较轻的炎症。
为了探究导致ACLF肝脏中相对免疫抑制环境的潜在因素,对Mono/Mac的功能进行了评估。Mono 2显示出典型的促炎症特征,表明其为炎性单核细胞亚群。与HC组和肝硬化组相比,ACLF组的Mono2占比降低。相比之下,ACLF表征的Mono/Mac亚群Mono 1具有典型的抗炎特征,表明其为免疫抑制表型。
因为Mono 1在ACLF肝脏中占优势,作者进一步评估了TREM2+ Mono1的体外功能。THP-1细胞先用PMA刺激,然后在M1(LPS,IFN-γ)或M2(IL-4,IL-13)条件下诱导。TREM2表达在M2中显著增加,免疫抑制性细胞因子IL-10和M2典型标志物甘露糖受体C-1(MRC-1,CD206)也显著增加。相反,促炎细胞因子TNF-α和IL-1β的表达在TREM2+ M2细胞中低得多。总之,TREM2+ Mono1显示免疫抑制功能,并且Mono1/Mono2比率的增加有助于ACLF肝脏中的免疫抑制环境(图4)。
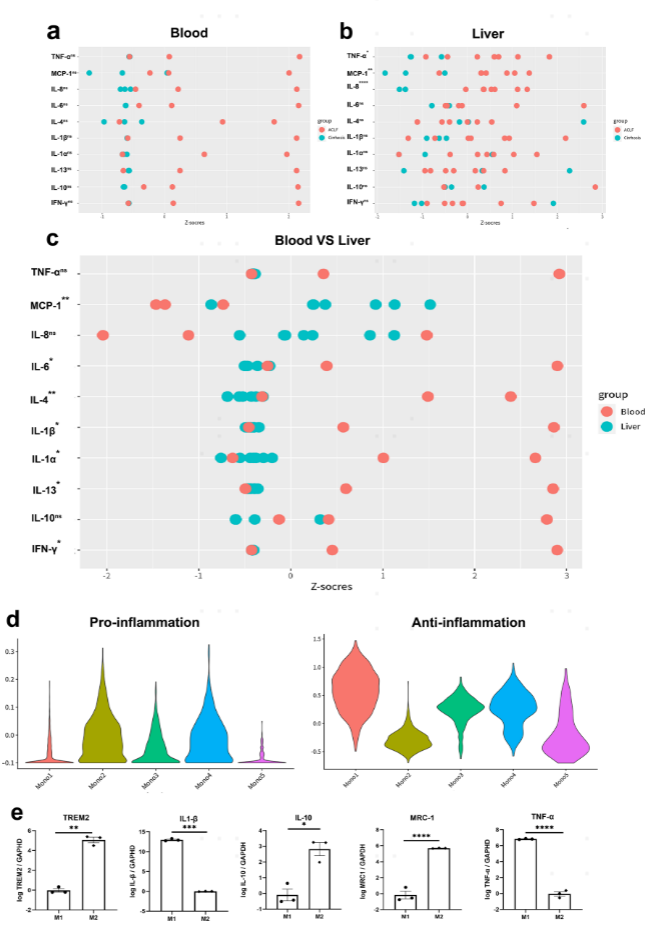
图4:TREM2+单核细胞/巨噬细胞的功能
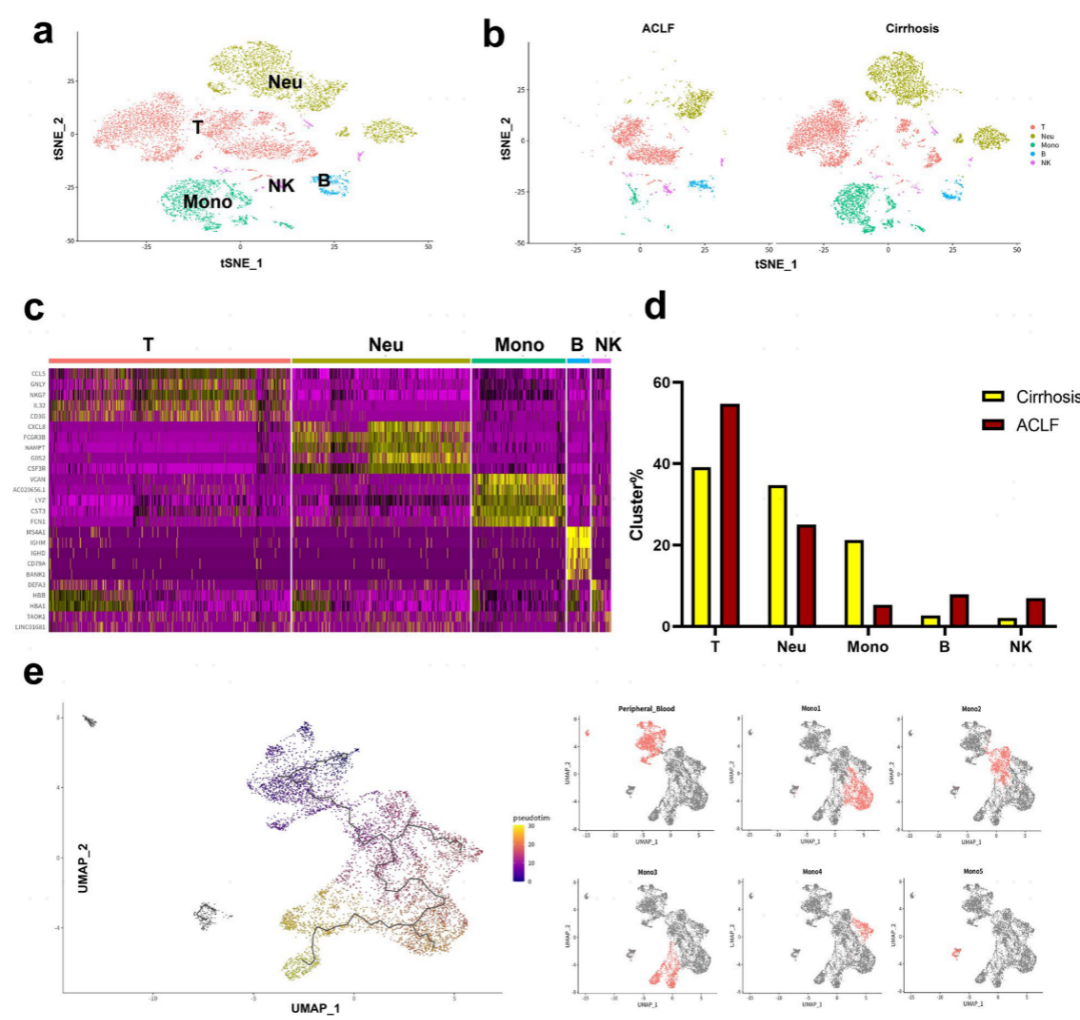
4.ACLF时肝内Mono/Mac的增加是由于外周血单核细胞浸润所致
ACLF肝脏中肝内驻留巨噬细胞,即KCs(Mono 3),显示衰竭,但总体肝内Mono/Mac显著增加。为了研究肝内Mono/ Mac是源自外周血单核细胞还是驻留巨噬细胞,进行了来自2名ACLF患者和1名肝硬化患者的PBMC的scRNA-seq。基于高表达基因,将10268个PBMC注释为T细胞、B细胞、NK细胞、单核细胞和中性粒细胞。有趣的是,与肝硬化患者相比,ACLF患者PBMC中单核细胞的占比降低。进行基于PBMC单核细胞和肝内Mono/Mac的组合数据集的伪时间分析以评估肝内Mono/Mac的起源。分化轨迹显示,Mono2来源于PBMC单核细胞,表明其为组织单核细胞,这与其功能分析一致。Mono 2进一步分化为Mono 1或Mono 4。这些结果表明,肝内Mono/Mac的增加是由于外周血单核细胞的浸润,而不是固有巨噬细胞的增殖(图5)。
图5:肝硬化和ACLF患者外周血scRNA-seq分析
5.不饱和脂肪酸增加促进ACLF肝巨噬细胞重编程
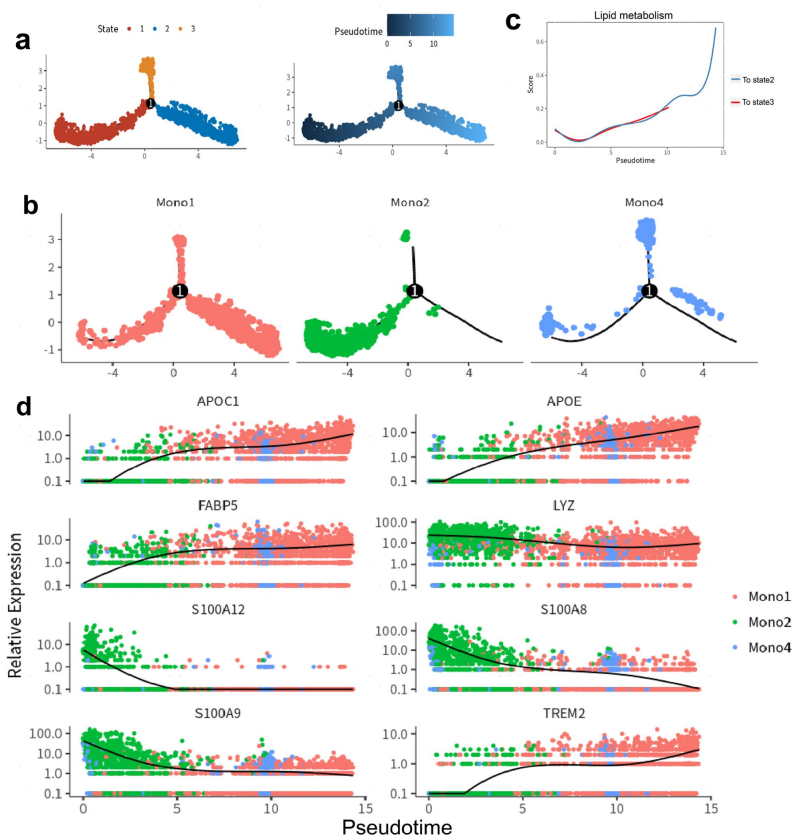
为了进一步表征组织单核细胞的分化,对Mono1、Mono2和Mono4进行伪时间分析。结果显示具有3种不同细胞状态的分支轨迹。Mono2在轨迹路径的开始处,并且Mono1和Mono4的大多数细胞分别在分叉的末端处。沿着分化,与脂质代谢相关的基因的表达在Mono1中显著增加。基因热图详细描述了沿着单核细胞分化的差异表达基因。其显示与脂质代谢相关的基因,包括APOE、APOC1、FABP5和TREM2,沿着从Mono2到Mono1的伪时间轨迹上调,这与基因富集分析一致(图6)。
图6:单核细胞/巨噬细胞的伪时间分析
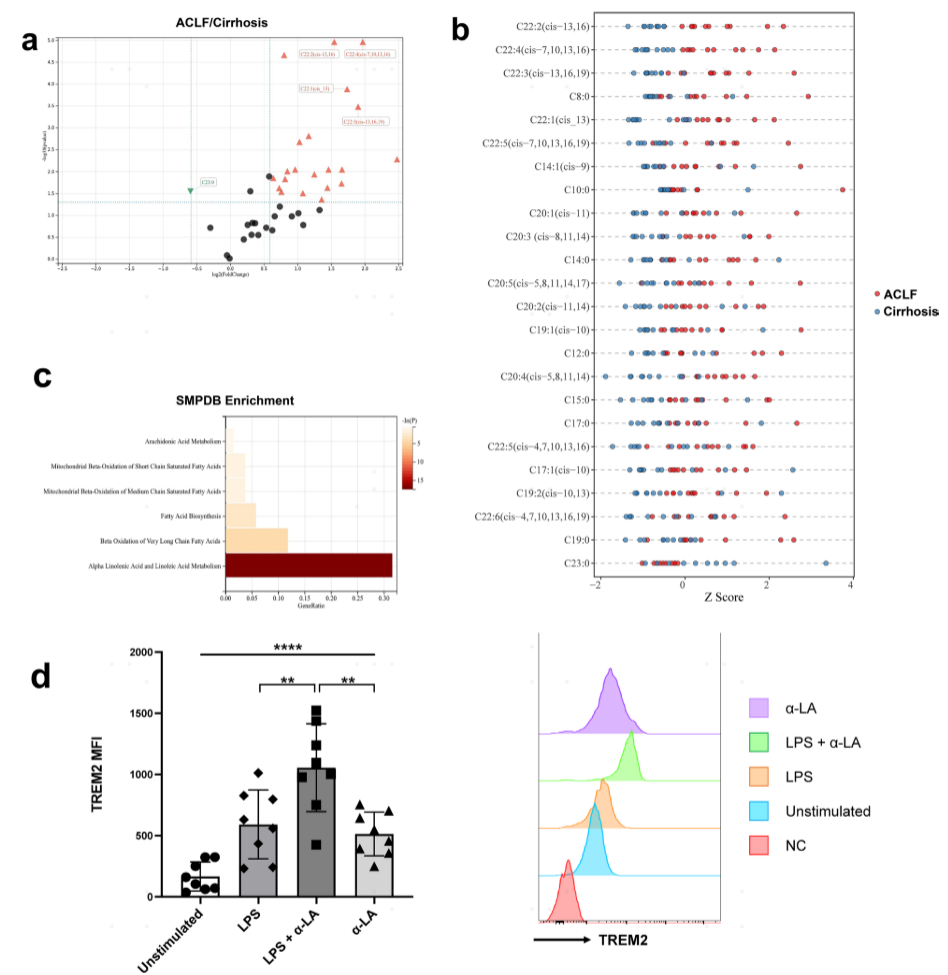
Mono 2分化过程中脂质代谢相关基因的上调表明某些脂质可能促进ACLF中单核细胞重编程。为探讨ACLF患者肝脏是否存在脂质代谢紊乱,采用10例ACLF患者和10例肝硬化患者的肝脏样本,检测了脂质代谢组学靶向FFAs。共检测到41种FFAs。23种FFAs(其中大部分是不饱和FFA)在ACLF肝脏中较高,而仅1种FFA (二十三烷酸)在肝硬化肝脏中较高。其中,二十二碳二烯酸、二十二碳四烯酸和二十二碳三烯酸差异最显著。ACLF肝脏中增加的FFAs的代谢物集富集分析表明,它们与α-LA和α-LA代谢以及超长链脂肪酸的β氧化相关。因此,不饱和脂肪酸的增加和α-LA代谢的紊乱可能促进ACLF肝中TREM2+ Mono/ Mac的分化。
为了验证不饱和FFAs对TREM2表达的潜在促进作用,进行单核细胞的体外刺激测试。阳性选择人外周CD14+单核细胞,并用α-LA、LPS或α-LA+LPS刺激。外周CD14+单核细胞在没有刺激的情况下具有TREM2的低表达。单核细胞经LPS或α-LA刺激后,TREM2表达略有增加,但两组间差异无统计学意义。只有在炎症环境下用α-LA刺激单核细胞时,TREM 2的表达才显著增加。因此,这些结果直接证明了在炎症环境下,α-LA的积累可以促进TREM2在Mono/Mac上的表达(图7)。
图7:肝硬化和ACLF患者肝脏靶向脂质代谢组学及α-LA的激发试验