新格元在该研究中提供了单细胞数据分析服务。
下面和元小新一起来看看吧~
2023年6月,天津市肿瘤医院张会来和王先火教授团队在《British Journal of Haematology》上发表“Integrative genomic and transcriptomic analysis reveals genetic alterations associated with the early progression of follicular lymphoma”的研究文章。通讯作者为贺瑾教授、张会来教授和王先火教授,共同第一作者为高凤华博士、刘恒岐博士和孟祥睿医生。文章中结合大样本滤泡性淋巴瘤(follicular lymphoma, FL)病例临床病理特征分析、WES、RNA-seq和单细胞转录组测序(scRNA-seq),为我们提供了第一项全面的滤泡性淋巴瘤患者与POD24相关的基因组和转录组学研究,描述了伴有POD24的滤泡性淋巴瘤患者明显的临床、遗传和分子特征。
新格元在该研究中提供了单细胞数据分析服务。
下面和元小新一起来看看吧~
研究背景
滤泡性淋巴瘤(FL)是最常见的惰性淋巴瘤,其发病机制至今尚未完全阐明。20%-30%的FL患者在一线治疗的2年内会出现疾病进展(progression within 24months of first-line therapy,POD24)。这些患者通常预后较差,其5年总生存率(OS)为34%-50%,而无早期疾病复发的患者生存率为90%。随着高通量测序技术的发展,越来越多的基因突变和表达异常被发现与FL的发生和发展密切相关。然而,目前对于FL的分子发生机制,特别是在早期进展的FL中,仍存在许多争议。多年来人们努力探索预测生存率或早期进展风险的生物学和遗传学因素,但迄今为止还没有明确的生物标志物常规应用于临床。本文旨在探究早期进展的滤泡性淋巴瘤(POD24 FL)的临床指征,识别与POD24 FL相关的基因组改变,以及相关的分子机制和特征,为FL的早期诊断和治疗提供新的思路和方法。
方法流程

scRNA-seq:收集6例FL患者的新鲜组织标本进行单细胞转录组测序(scRNA-seq)。
全外显子测序(WES):102例病例(POD24 FL患者29例,non-POD24 FL患者73例)的冷冻肿瘤活检和石蜡包埋组织;
RNA-seq:在102例有WES数据的组织样本中,从41例样本中提取RNA进行RNA-seq。
研究结果
1.POD24相关患者的临床特征
从2002年到2020年,共有926名患者在天津肿瘤医院被诊断为FL,最终纳入分析的患者共415名,临床特征见表1。

表1. 与POD24相关患者的临床基线特征
在407例病例的多变量逻辑回归模型中,高危FLIPI 评分是预测POD24的最重要变量(表2)。在308例接受利妥昔单抗免疫化疗的患者亚组中,高危FLIPI评分同样与POD24风险增加相关,包括在102例有WES数据的FL患者亚组中也是如此。

表2. POD24的回归模型
为进一步评估POD24对OS的影响,作者使用24个月为界标,进行了landmark生存分析。正如预期,POD24与较差的OS有关,前24个月内疾病进展的患者的3年和5年生存率分别为89.2%和78.6%,而未进展患者分别为98.5%和96.2%。校正B症状和β2-M并按FLIPI分层的多变量Cox模型显示,POD24与后续OS较差相关(图2A)。此外,与POD24队列相比,24个月时无进展的患者更有可能对一线治疗表现出完全缓解(CR)。
2.编码SNV与POD24的关联
研究中共得到102例患者(29例POD24和73例non-POD24)的基因突变和CNAs信息。在所有突变中,错义突变是优势类型。在SNV中,C>T碱基转换的突变所占比例最高。在所有体细胞发生的非沉默突变中,23个基因被认为是癌症驱动因素。中国FL患者的突变特征与西方FL略有不同[1],在中国患者中HIST1H1D、ARID1B和STAT6突变频率较高,而BCL2频率较低。突变分析显示,POD24亚群中最常改变的基因(>19%的患者)与FL中几个重要通路相关,包括表观遗传调控和染色质重塑(KMT2D、CREBBP、NCOR2和ARID1A)、免疫逃避(IGLL5和TNFRSF14)、BCR和NK-κB(CARD11)、细胞凋亡抑制、细胞周期(BCL2)和JAK–STAT信号转导 (STAT6)(图2B,C);但重要的信号通路相关基因突变频率在两个亚组之间无显著差异。值得注意的是,参与核小体结构形成的HIST1H1D基因的突变频率,在 POD24亚群中显著高于non-POD24亚群。此外,POD24亚组中所有癌症驱动基因的总突变频率较高,但未达到统计学显著性。共突变和互斥同突变分析确定了14个具有统计学显著性的相互作用基因对,其中STAT6 突变与CREBBP和TNFRSF14突变显著共存,但与ATP6V1B2突变不共存。
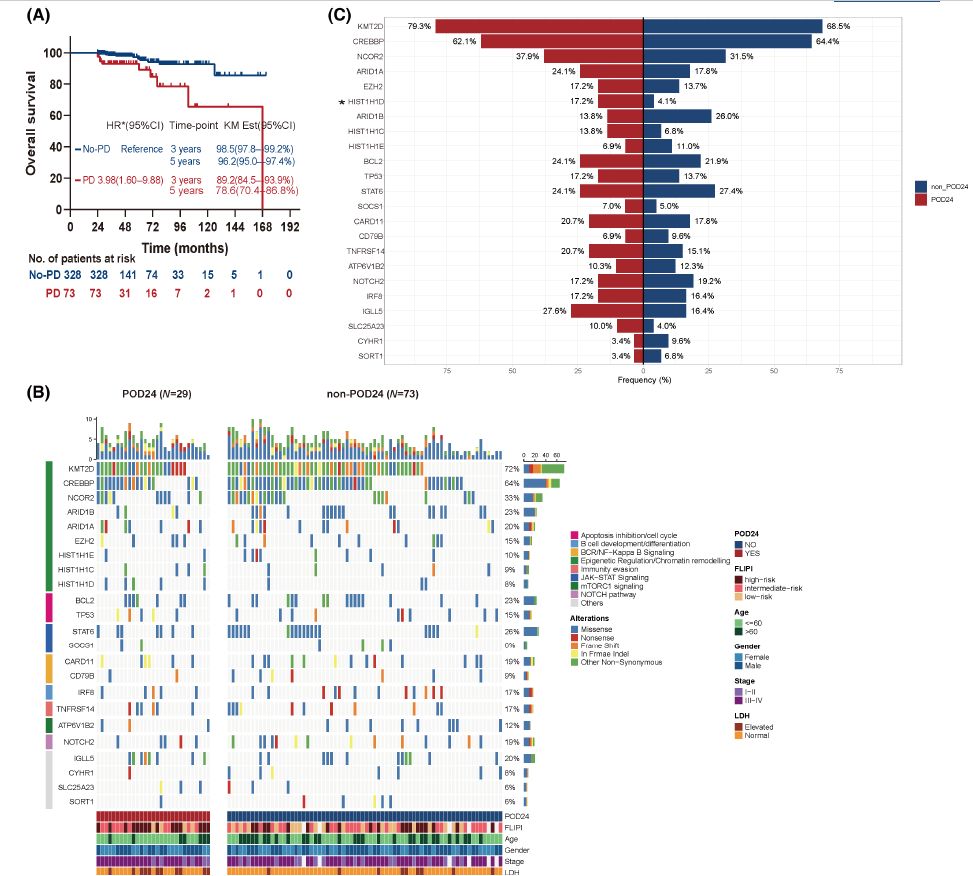
图2. POD24对FL患者预后的影响及伴有或不伴有POD24的FL患者中涉及的驱动基因突变
3.CNAs与POD24的关联
为了确定FL中的常见CNAs,作者对102例FL样本进行了分析,并用癌症显著靶标基因组识别(GISTIC)算法对这些数据进行了评价。此后,使用Circos图比较了POD24亚型与non-POD24亚型的常见CNAs(图3A,B)。在基因水平拷贝数增加分析中,大多数与POD24相关的基因在p<0.05时聚集在5个染色体区域,与POD24相关性最强的区域包括6p21.1-6p22.2、6q12-6q24.2和18q11.2-18q22.2(图3C)。同样,在基因水平拷贝数丢失分析中,尽管检测到微小改变,但发生染色体丢失的大多数基因聚集成三个区域(图3D)。为了评估部分CNAs是否可独立于FLIPI预测POD24,将它们与FLIPI一起逐个纳入logistic回归模型中,结果发现gain 6p22.2(HIST1H1D)和18q21.33(BCL2)和loss 1p36.13(NBPF1)可独立于FLIPI而预测POD24。
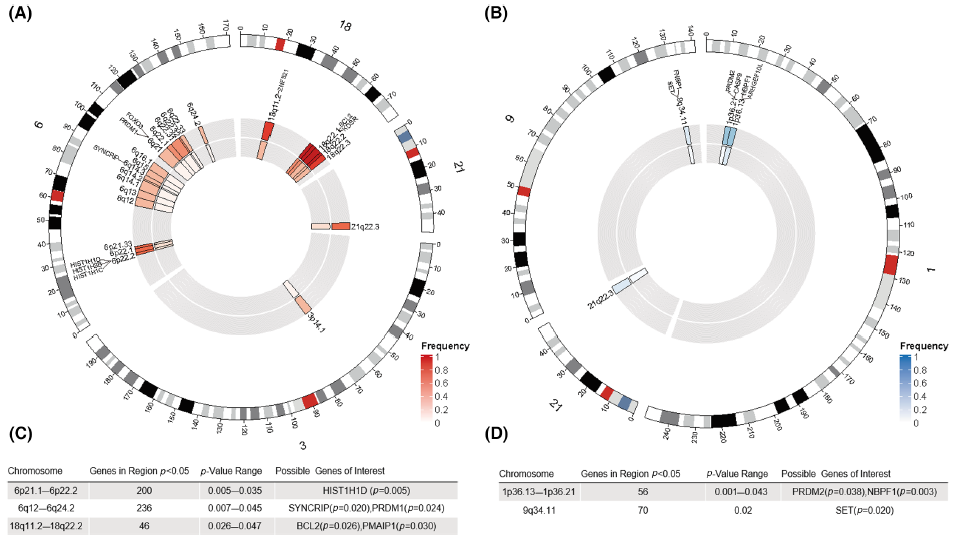
图3. 与POD24相关的CNA情况
4.基因改变与临床的关联
可独立于FLIPI和驱动基因(HIST1H1D)突变状态预测POD24的CNAs(gains in 6p22.2 and 18q21.33 and loss in 1p36.13)与较差的PFS显著相关(图4A-D)。既往研究表明,治疗对POD24有显著影响,对本研究最初纳入的415例患者和102例接受全外显子测序的患者进行分析,发现治疗并非POD24的显著危险因素。原因可能是纳入患者的偏倚:大多数患者接受了R-chemo作为一线治疗,而接受其他治疗方案的患者较少。为防止偏倚,而对接受R-chemo患者进行生存分析,显示所有4种变异(驱动基因突变和CNAs)也与较差的PFS显著相关。整合CNAs和驱动基因突变状态发现,76%的POD24患者同时存在4种变异(HIST1H1D突变,gain 6p22.2和18q21.33,loss 1p36.13;图4E)。然而在本队列中,m7-FLIPI识别POD24的敏感性和特异性分别仅为56%和41%。

图4. CNAs和突变与FL进展时间的关联
5.POD24和non-POD24 FL样本的基因表达分析
对41个FL样本(POD24,n=11,non-POD24,n=30)的转录组数据进行分析。与non-POD24亚型相比,在POD24亚型中观察到独特的基因表达谱,包括一组上调基因(n=434),如MME、CXCR1、CD5L、HLA-G、IL27、ZNF365和几种主要组织相容性复合体I类(MHC I)分子相关基因,以及一组下调基因(n=840),如CCND1、CXCL8、TP73和组蛋白家族成员基因(图5A)。GSEA分析显示,POD24亚型显著富集与炎症反应(由干扰素和肿瘤坏死因子介导)、细胞周期调控(转录、复制和增殖)和PI3K-AKT–mTOR信号转导相关通路(图5B)。
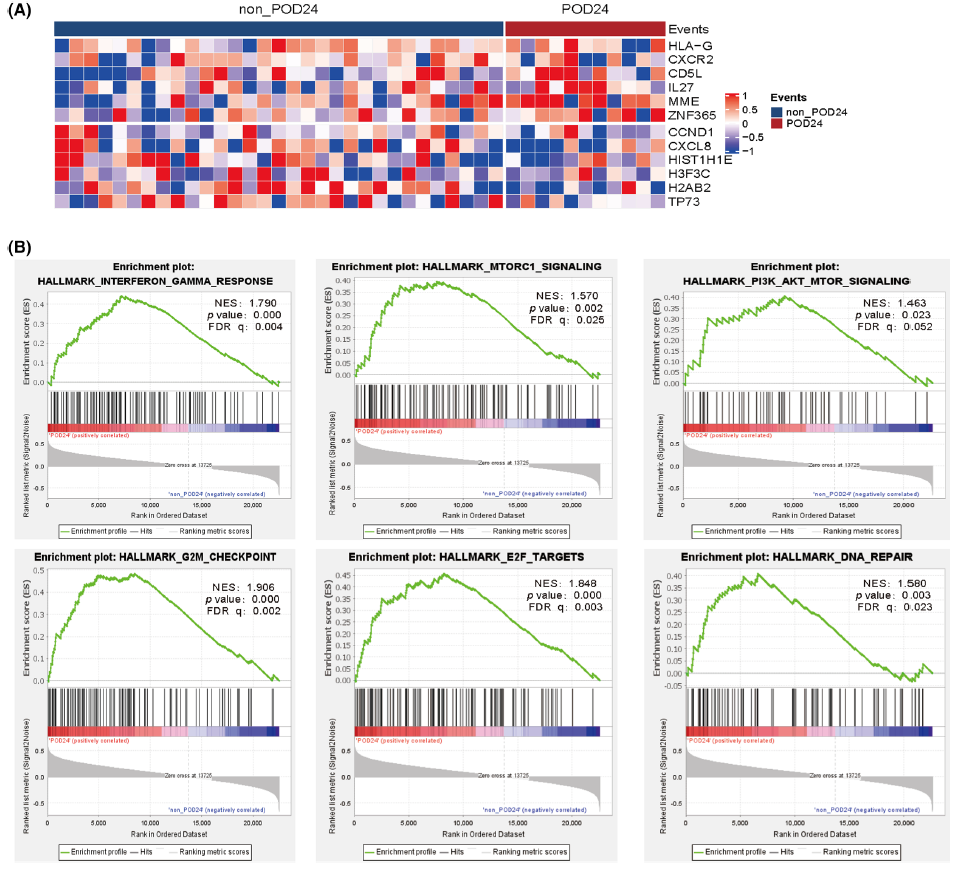
图5. 伴有POD24的FL患者表现出独特的基因表达模式
6.POD24患者肿瘤细胞异质性和肿瘤相关标志信号的演变
为进一步验证bulk RNA-seq数据的结果,对6例FL患者的肿瘤样本进行scRNA-seq(图6A–C)。对33940个细胞进行聚类(图6D)。共鉴定出恶性B细胞、肿瘤浸润 B 细胞、T细胞、单核吞噬细胞、NK 细胞、浆细胞样树突状细胞和基质细胞。此外,恶性 B 细胞呈患者和治疗反应分组(POD24和non-POD24)聚集(图6C),表明其高度的肿瘤间细胞异质性。为了评估肿瘤细胞的肿瘤间异质性是否会影响单细胞分辨率下癌症特征的表现和早期进展,作者评估了50个来自MSigDB的基因集活性。总体而言,在早期进展患者(POD24)的 FL 细胞中,25个通路基因集上调,包括IFN-γ反应、PI3K/AKT/mTOR、DNA修复、细胞周期和mTORC1信号转导(图6E)。结果与bulk RNA-seq结果一致,进一步证实了从单细胞分析中得出的结论。

图6. 单细胞分辨率下的转录组异质性
结论
本研究是第一项与FL患者POD24相关的全面基因组和转录组学研究,发现POD24 FL患者具有明显的临床、遗传和分子特征。通过分析415例FL患者的临床生物学特征,以确定与POD24相关的变量。CNA分析发现6p22.2(HIST1H1D),18q21.33(BCL2)和1p36.13(NBPF1)的Gain和Loss可独立于 FLIPI预测POD24。FL样本的RNA-seq结果显示,POD24队列显著富集了炎症反应、细胞周期调节和PI3K-AKT–mTOR信号转导通路。最后通过scRNA-seq进一步验证RNA-seq分析结果。本研究对象为大样本FL患者队列,强调了与疾病诊断和早期进展相关的独特的基因改变和基因表达。本研究中确定的基因改变可能为开发新型治疗策略提供机会,也需要对POD24 FL患者的更大队列进行进一步研究,以确定和验证这些肿瘤中的候选驱动基因和CNAs。
参考文献
[1] Ma, Man Chun John et al. “Subtype-specific and co-occurring genetic alterations in B-cell non-Hodgkin lymphoma.” Haematologica vol. 107,3 690-701. 1 Mar. 2022, doi:10.3324/haematol.2020.274258
[2] Gao, Fenghua et al. “Integrative genomic and transcriptomic analysis reveals genetic alterations associated with the early progression of follicular lymphoma.” British journal of haematology, 10.1111/bjh.18974. 16 Jul. 2023, doi:10.1111/bjh.18974
电 话:025-58165529
业务咨询:025-58165526
售后电话:025-58862675
电子邮件:singleron@singleronbio.com
售后邮箱:product-service-support@singleronbio.com
地 址:南京市江北新区药谷大道11号加速器二期06栋3-5层
Copyright © 2021 新格元生物科技 | 隐私政策
网站建设:华科互动