项目文章 | 单细胞测序探索猪不同品系间等位基因特异性表达
发布时间:2023-11-22 10:41:05
2023年9月,四川农业大学李明洲研究团队在《Giga Science》杂志在线发表题为“Allele-specific regulatory effects on the pig transcriptome”的研究论文,探索了等位基因特异性表达(Allele-specific expression, ASE)对猪遗传调控的影响。通过对欧洲巴克夏猪(European Berkshire)和亚洲藏猪(Asian Tibetan)进行交叉繁殖模型的研究,研究人员鉴定了印记(imprinting)和序列依赖(sequence-dependent)两种ASE类型,并对其进行了特征描述。本研究涵盖了蛋白编码基因(PCGs)、长非编码RNA(lncRNAs)以及未知编码潜力转录本(TUCPs)等3种转录类型,覆盖了由交叉繁殖产生的混合猪的7个典型体细胞组织。
新格元在该研究中提供了SCelLiVe®组织解离液、GEXSCOPE®单细胞核转录组测序等。
下面和元小新一起来看看吧~
研究背景
哺乳动物基因组为二倍体,每个基因座包含来自父母的两份拷贝。等位基因特异表达(ASE)在二倍体基因组中出现,会使得一个等位基因比另一个更倾向于表达。ASE可分为印记性和序列依赖性。印记性受表观遗传调控,依赖于父系或母系等位基因的优先表达,约占基因组的1%,而序列依赖性则基于核苷酸相似性导致不同品种间的表达差异。这些差异受顺式和转调节元件的影响,可通过遗传变异或转作用因子引起。
研究结果
1.猪组织中的ASE表达谱分析
为了研究猪的ASE表达情况,研究人员利用欧洲巴克夏猪和亚洲藏猪之间的互换交叉模型,共收集了来自24个F1后代的7种体细胞组织的163个RNA-seq文库进行分析。通过结合前期研究的蛋白编码基因和转录本注释信息,分析了近2万个编码蛋白编码基因(PCGs)、约1.8万个lncRNAs和约2千个TUCPs。利用高密度的杂合SNVs进行等位基因特异性RNA-seq分析,发现了约11.02百万个杂合SNVs,并成功分型了约95.35%的SNVs。研究成功构建了巴克夏猪和藏猪间3种转录本类型在7种组织中的等位基因特异性表达谱,深入探索了不同品种间表达变化背后的调控机制。
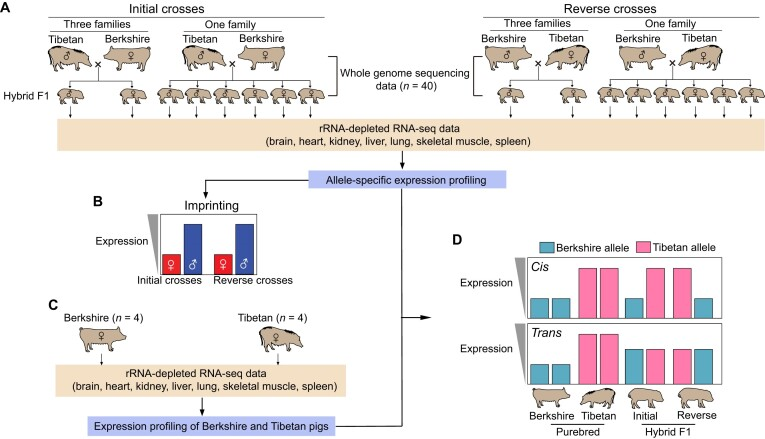
图1 实验设计流程
2.猪基因组中的印记转录本情况
研究人员通过对7种组织中每个亲本等位基因的显著表达差异进行严格校正的P值分析,构建了猪基因组中印记转录本的全面分类。发现每种组织中有13到22个(约16.43个)潜在印记PCGs,4到15个(约9.71个)lncRNAs和1到4个(约2.14个)TUCPs。综合考虑三种转录本类型时,父源等位基因明显多于母源。研究发现了44个潜在的PCGs、39个lncRNAs和9个TUCPs,其中超过75%首次在脊椎动物中描述。此外,超过50%(92个中的47个)位于13个簇中,这也是已知印记基因的典型特征,并进一步证明了印记识别的可靠性。与先前在杂交小鼠中的发现一致,作者观察到印记呈组织依赖性,59.09%的PCGs和74.36%的lncRNAs仅在单个组织中鉴定,表明印记影响着组织特异功能。
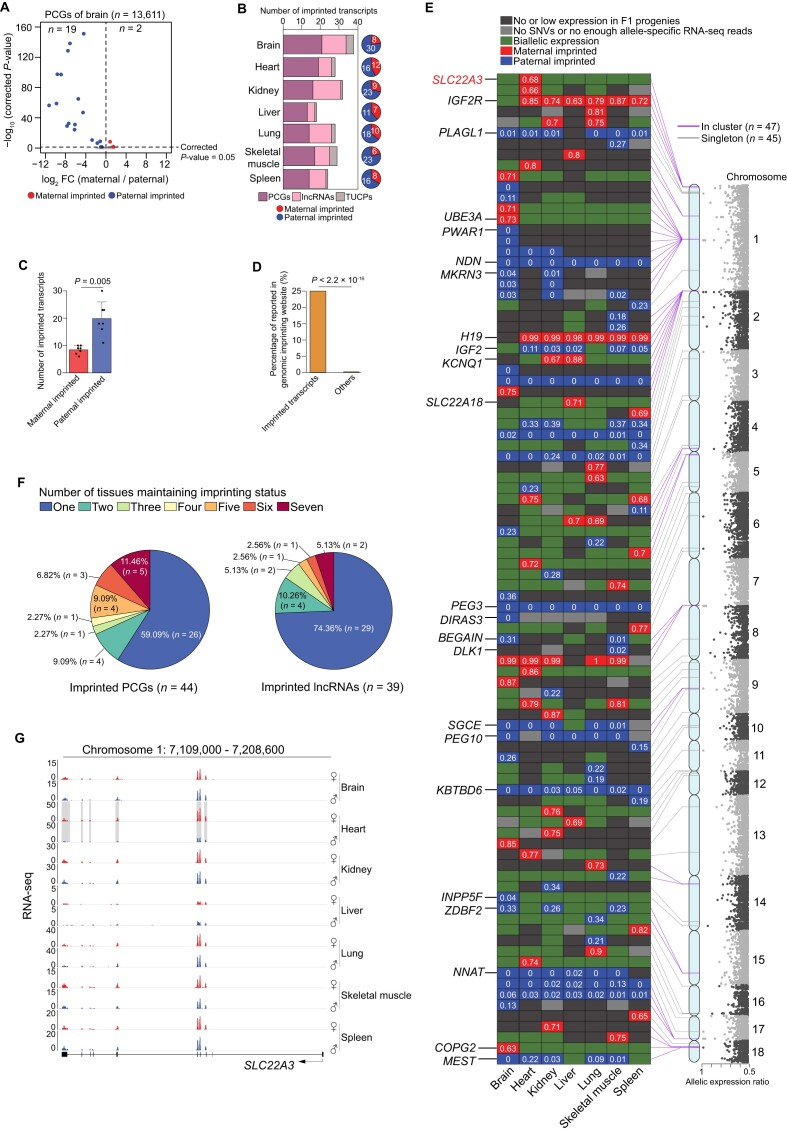
图2 跨组织的印迹转录本景观
3.两种猪品种间反式调控差异及其对适应性表型差异的影响
为了识别顺式和反式调控效应,研究人员对纯种巴克夏猪(n=4)和藏猪(n=4)在上述7种组织(n=54)中进行了rRNA去除的RNA-seq分析。针对每种组织,作者使用约12,803个非印记PCGs,约3,535个非印记lncRNAs和约577个非印记TUCPs,分别检查了F0(即纯种巴克夏猪和藏猪的表达)和F1群体(即来自互换交叉的F1后代中的巴克夏猪和藏猪等位基因的表达)中的品种间表达差异。作者观察到反式调控PCGs数量显著高于顺调控PCGs,lncRNAs和TUCPs呈相反趋势。这些反式调控效应突显了两种猪品种之间适应性表型差异。藏猪在脾脏组织中展现出了显著的适应性,反映了其在高原环境中克服低氧的能力。相反,巴克夏猪展示了长期人工选择的证据,尤其在与猪肉产量和品质相关的骨骼。

图3 猪品种间表达调控类别的分类
4.骨骼肌中的反式调控效应与不同细胞类型相关
为了确定某些细胞类型是否更多地影响了骨骼肌中的反式调控效应,研究人员对两种猪的骨骼肌进行了snRNA-seq测序分析,并提取了24,683个细胞的转录组(其中巴克夏猪12,074个,藏猪12,609个)。这些细胞被细分为12种不同的细胞类型,它们在品种间的组成差异显著,尤其是对于3种肌纤维(Ⅰ型、ⅡA型和ⅡB型)。接着,作者研究了不同细胞类型的组成是否与骨骼肌中品种间反式调控差异相关联。研究结果发现,巴克夏猪和藏猪骨骼肌中的反式调控基因数分别为67至267个(约166.33个)和25至305个(约143.42个),特异表达于特定细胞类型。值得注意的是,作者还发现藏猪骨骼肌中反式调控基因的高表达主要富集于Ⅰ型肌纤维和肌卫星细胞的特异表达基因中。相比之下,巴克夏猪骨骼肌中反式调控基因的高表达主要富集于ⅡA型肌纤维的特异表达基因中。这些结果表明,骨骼肌中的反式调控效应是由不同细胞类型的组成所导致的。
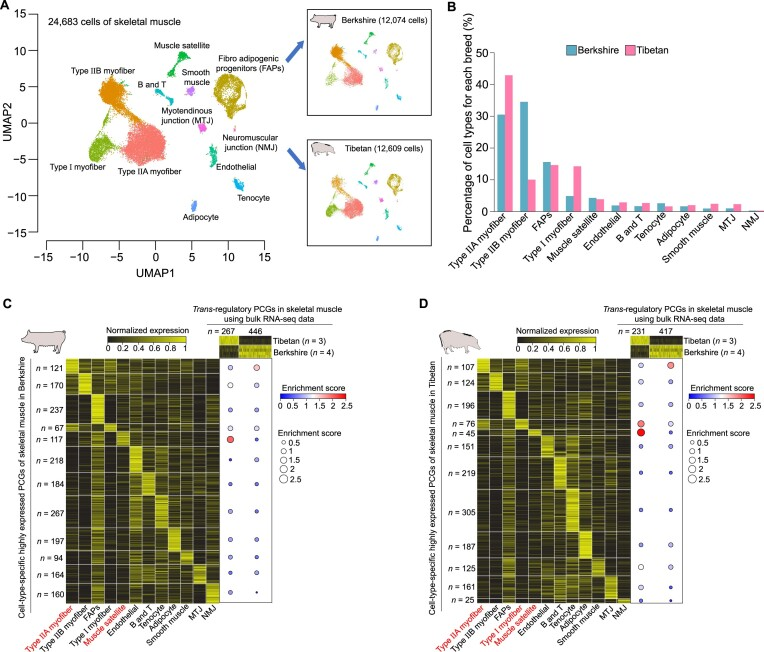
图4 骨骼肌中反式调控效应与细胞类型组成之间的相关性
5.顺式调控效应呈现更大的序列差异
尽管转式调控效应是由扩散性组分(例如转录因子)的突变引起的,但顺式调控效应主要是由于在顺式调控元件(通常是启动子和增强子)处的遗传变异而产生的。为了调查遗传变异与顺式调控效应之间的关联,作者利用每个F1后代检测到的杂合SNV和indel评估了启动子序列(即PCGs、lncRNAs和TUCPs的转录起始位点的上游2kb区域)之间的品种间序列差异。研究发现,顺式调控效应在猪基因组中表现出较大的序列差异,主要由于启动子区域的遗传变异引起。与反式调控效应相比,顺式调控基因显示较低的保守水平,并表现出更高的表达差异。特别是lncRNAs和TUCPs表现出较低的序列保守性,但在表达上显示出更大的差异。这些结果为深入理解猪基因组中的调控机制提供了重要线索。
同样,作者发现大多数顺式调控效应(PCGs的75.38%,lncRNAs的75.85%,TUCPs的76.42%)和转式调控效应(PCGs的65.55%,lncRNAs的89.25%,TUCPs的89.47%)仅在单一组织中检测到,突出显示了对同一调控变异的组织依赖性反应。此外,相同调控模式的转录本在不同组织中显示出相似的表达差异,暗示着相同的调控元件可能在不同组织中导致品种间相似的差异表达。
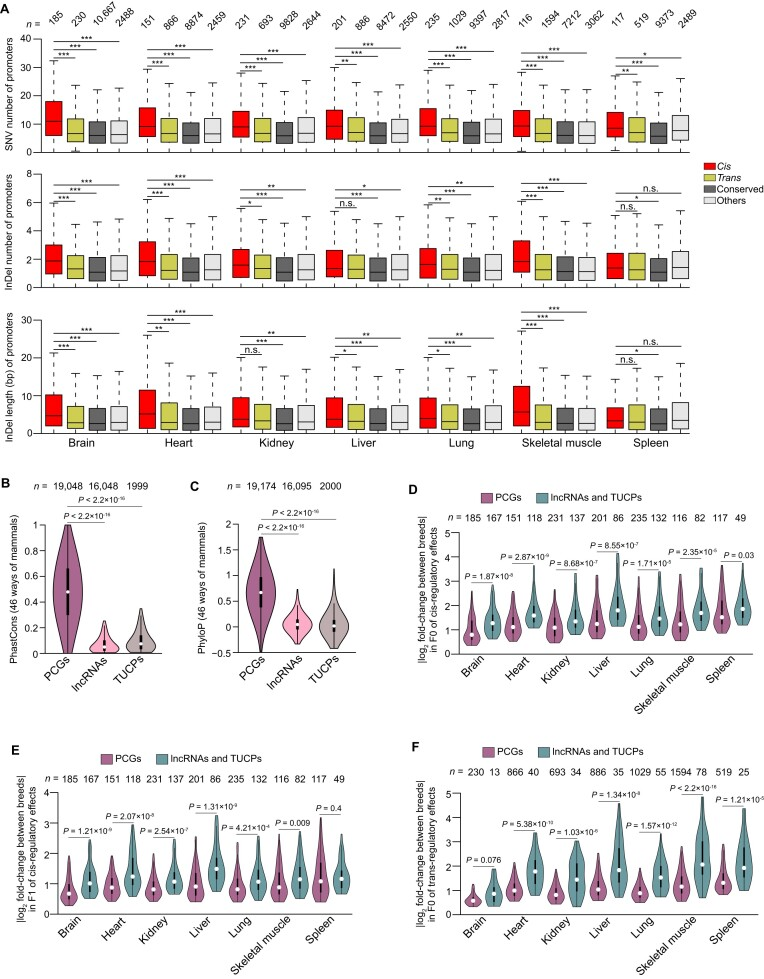
图5 顺式调控效应显示更大的序列差异
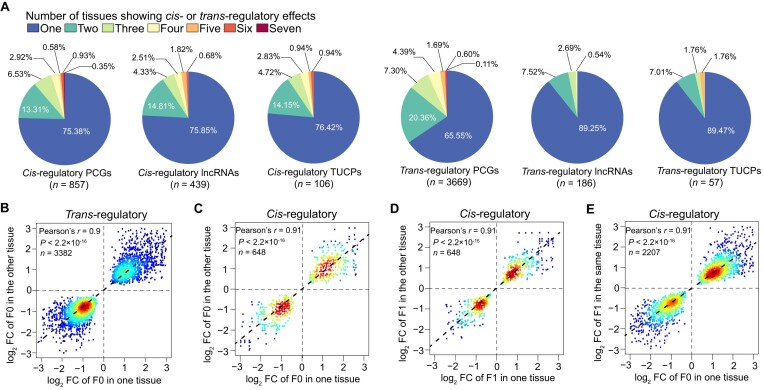
图6 顺式和反式调控效应的组织特异性模式
结论
本文研究显示欧洲巴克夏猪和亚洲藏猪的互交叉模型中,杂合SNV的比例相对较高,显示出这一模型在研究品种间等位基因特异性表达差异方面的潜力。此外,文章借助scRNA-seq技术为猪基因组中可能的印记基因提供了全面的注释,确定两种猪品种间顺式和反式调控差异及其对适应性表型差异的影响。功能通路的富集进一步支持了这一观点,发现骨骼肌中的反式调控效应与不同细胞类型相关,强调了转式调控效应在驯化动物中塑造品种特定特征和特性方面的重要性。通过对转式调控和顺式调控效应的研究,有望深入理解猪等位基因特异性表达的分子机制,为猪遗传改良和品种选育提供有益的指导。
参考文献
Lin Y, Li J, Chen L, et al. Allele-specific regulatory effects on the pig transcriptome. Gigascience. 2022 Dec 28;12:giad076. doi: 10.1093/gigascience/giad076. PMID: 37776365; PMCID: PMC10541795.








