项目文章 | 单细胞(核)测序揭示周围神经损伤压后皮质细胞类型依赖性转录变化
发布时间:2023-12-21 09:43:59
2023年11月,浙江大学医学院李相尧研究团队在Cell Reports期刊上发表了题为“Single-cell RNA sequencing uncovers the cell type-dependent transcriptomic changes in the retrosplenial cortex after peripheral nerve injury”的研究成果。该研究揭示了压后皮质(Retrosplenial Cortex,RSC)在小鼠神经损伤疼痛中的作用,通过单细胞/单核转录组测序预测神经损伤引起的RSC中兴奋性突触传递增强,表明了RSC对调节神经病理性疼痛至关重要,细胞类型特异的转录组变化为我们理解神经病理性疼痛的分子基础提供新的观点。
该研究中,新格元承担了单细胞核转录组测序(GEXSCOPE®)工作。
下面和元小新一起来看看吧~
研究背景
压后皮质(Retrosplenial Cortex,RSC)是大脑记忆存储的关键区域之一。以往研究表明,RSC整合了多种感官信息,并有助于储存恐惧和空间记忆;同时RSC也处理有害信息,并在生理条件下对伤害性刺激做出反应。周围神经损伤(Peripheral nerve injury)会诱导RSC发生广泛变化,包括其中不同类型细胞的转录组变化,对脑功能的发展和维持产生影响。单细胞转录组测序(scRNA-seq)和单细胞核转录组测序(snRNA-seq)已被广泛用于研究细胞类型的异质性。由于神经元细胞结构的特殊性,snRNA-seq可以高效捕获神经元细胞并从中获得转录组信息。通过结合scRNA-seq和snRNA-seq检测周围神经损伤小鼠RSC的转录组学变化,将有助于阐明神经病理性疼痛和记忆存储的分子和细胞机制。
方法流程

图1 研究设计
研究结果
1.周围神经损伤改变了RSC的细胞反应模式
周围神经损伤会导致RSC的代谢改变,表明神经元活动异常。为了证实这一点,研究者使用了腓总神经(CPN)结扎的神经病理性疼痛小鼠模型,用0.4g von Frey纤维丝进行机械刺激后,检测了RSC中c-Fos(一种即刻早期基因)的表达。结果显示,在CPN结扎后的第7天,机械刺激后观察到更多数量的c-Fos+神经元(图2A-D);同时在几乎所有层的RSC中都检测到c-Fos的增加(图2E),并且超过一半的c-Fos+神经元表达钙/钙调蛋白依赖激酶IIα(CaMKIIα)(图2B-G)。相比之下,在机械刺激后,几乎没有γ-氨基丁酸(GABA)能神经元表达c-Fos(图2F,G)。此外,c-Fos的表达在对疼痛调节至关重要的前扣带回皮质(ACC)中出现了类似变化,但在海马中没有出现类似变化。这些数据表明,周围神经损伤改变了RSC中CaMKIIα+神经元对机械刺激的反应模式。
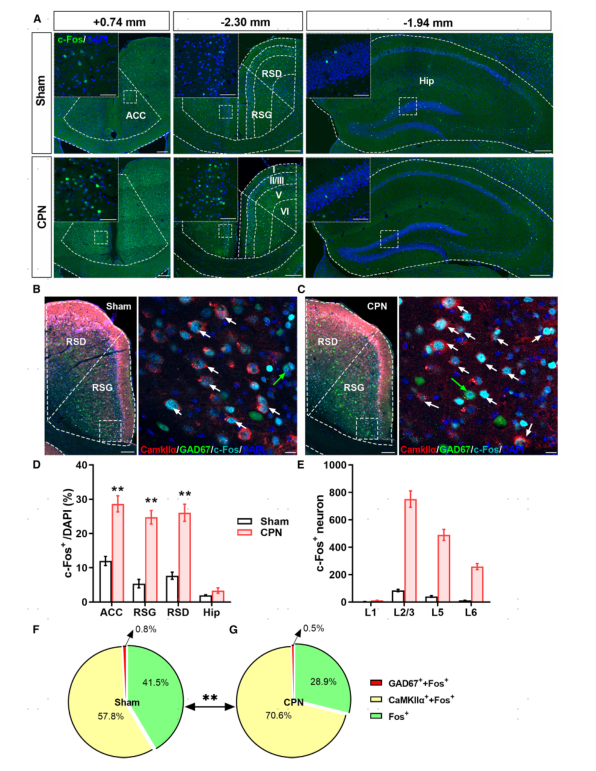
图2 机械刺激激活CPN结扎小鼠RSC中神经元
2.提高naïve小鼠RSC中CaMKIIα+神经元活性能够改善CPN结扎后疼痛反应
c-Fos表达增多表明RSC中激活的神经元越多。为了评估CaMKIIα+神经元在RSC中过度激活的影响,研究者通过化学遗传学方法增加CaMKIIα+神经元的活性,使用腺相关病毒9(AAV9)在RSC中CaMKIIα+神经元中表达一种专为设计药物激活的毒蕈碱受体hM3Dq 受体(AAV9-CaMKIIα-hM3Dq-mCherry),以AAV9-CaMKIIα-mCherry作为对照(Ctrl),氯氮平-氧化物(CNO)与该受体的结合会增加神经元的兴奋性,在注射病毒3周后,使用全细胞膜片钳技术检测了CNO的影响。
结果显示,CNO(10mM)显著增加了hM3Dq表达神经元中动作电位(APs)的数量。在行为学上,全身应用CNO(1mg/kg,腹腔注射)可降低机械缩足阈值(PWT),且这种效应持续不到24小时(图3D,E)。此外,随着hM3Dq受体的表达,CNO可缩短小鼠的热退缩潜伏期(TWL)(图3F)。由此可见激活RSC中CaMKIIα+神经元可以增强机械和热敏感性。
RSC中的神经元活动是厌恶性记忆所必需的,研究者使用条件性位置偏好行为实验(Conditioned Place Behavioral Approach)来测试激活CaMKIIα+神经元是否会诱发厌恶情绪(图3G)。在预处理阶段,有或无hM3Dq表达的小鼠探索小室的时间相同;在测试阶段,与Ctrl小鼠相比,hM3Dq小鼠在CNO作用室内停留的时间更短(图3H)。这些数据表明,激活RSC中的CaMKIIα+神经元足以诱导厌恶情绪,同时CNO也增加了hM3Dq小鼠RSC中c-Fos+神经元的数量(图3I,J)。
上述结果表明,通过化学遗传学方法激活RSC中的CaMKIIα+神经元可使naive小鼠的机械和热敏感性敏感,并诱导厌恶情绪。
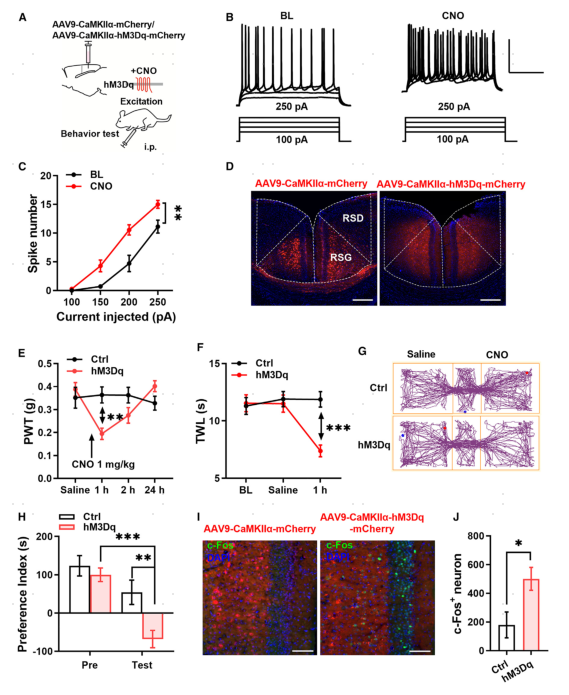
图3 激活RSC中的ExNs改变小鼠行为学
3.CPN结扎诱导RSC的转录组改变
为了探究神经损伤后RSC中神经元活跃的分子机制,研究者使用scRNA-seq和snRNA-seq分析了CPN结扎小鼠RSC细胞的转录组学特征。在CPN结扎或Sham处理后的第7天进行取材并进行单细胞测序实验,过滤后得到32,525个单细胞数据和66,672个单核数据用于后续分析。根据经典细胞类型标记的表达,鉴定出11种细胞类型,包括:内皮细胞(ECs)、小胶质细胞、少突胶质前体细胞(OPCs)、少突胶质细胞(OLGs)、星形胶质细胞(ASCs)、CamkIIα+神经元(ExNs)、血管平滑肌细胞(vSMCs)、GABA能神经元(InNs)、脉络丛上皮细胞、巨噬细胞和周细胞,在此基础上鉴定出每种细胞类型的差异表达基因。
Sham组和CPN组细胞类型进行降维展示,并对两组间不同细胞类型平均基因表达的相关性分析,评分越低代表差异越显著(图4D)。在scRNA-seq数据中分析各细胞类型由神经损伤引起的差异基因DEGs改变,一些DEGs在不同的细胞类型中均被检测到,表明细胞类型之间共享一些DEGs,例如ASC和EC中上调基因Lars2,ExNs和InNs中下调基因PTN等(图4E)。在至少两种细胞类型中检测到了约23.71%上调DEGs和38.36%下调DEGs(图4F,G)。在scRNA-seq和snRNA-seq混合数据中也检测到类似DEGs。这些结果显示,CPN结扎诱导了RSC中细胞类型依赖性的转录组改变。
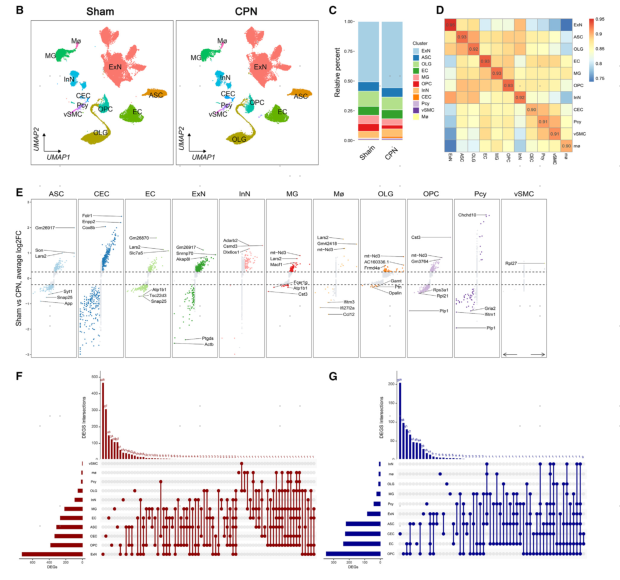
图4 CPN结扎手术改变了RSC细胞的转录谱
4.CPN结扎引起RSC广泛的功能障碍
为了进一步了解细胞功能变化,研究者对scRNA-seq数据中每种细胞类型DEGs进行了GSEA分析(图5A-J)。在ExNs中,初级活性跨膜转运蛋白活性通路被抑制,而离子型谷氨酸受体活性通路被上调(图4A)。此外,CPN结扎可能抑制了ExNs焦磷酸酶和三磷酸核糖核苷磷酸酶的能力(图5B);提高InNs中跨膜信号受体活性,抑制了蛋白复合物结合通路活性(图5C)。当综合snRNA-seq和scRNA-seq数据时也观察到了类似的结果。由此可见,跨膜信号通路在ExNs和InNs中上调,而其他分子功能通路如代谢、蛋白结合和催化活性则受到抑制。

图5 不同细胞类型差异基因GSEA分析结果
5.转录组学分析预测神经损伤后RSC中兴奋性突触传递增强
scRNA-seq数据的GSEA结果表明,在ExNs和InNs中,传递细胞原始信息和调节兴奋性的配体门控通道的表达发生了变化,核心富集基因包括Gria1、Gria2和Gria4;在snRNA-seq和scRNA-seq混合数据中也有类似的Gria3和Gria4表达上调。为了评估配体门控通道的变化,研究者检测了编码神经递质离子型受体的基因的表达包括乙酰胆碱(Ach)、GABA、谷氨酸、IP3、ATP和Ryanodine,这些受体基因显示出细胞类型依赖的表达模式(图6A)。其中,ExNs和InNs主要表达GABA受体、谷氨酸受体亚基、Itpr1和Ryr2基因。OLGs主要表达Glrb、Gria2和Gria4;OPCs和ASCs高表达Gria2、Grid2、Grik5和Glrb,表明这两种细胞类型均受谷氨酸和IP3的调控。vSMC和ECs表达ItpR亚基,因此可能对IP3有反应。以上scRNA-seq和snRNA-seq数据表明不同细胞类型的主要调节基因是多样的。
接下来,研究者发现CPN结扎主要改变了RSC中对GABA、谷氨酸、IP3和Ryanodine的细胞反应。在ExNs的scRNA-seq数据中检测到Gria1、Gria2、Gria3、Gria4和Ryr2的高表达,在混合数据库中也检测到Gria3和Gria4的高表达。同时,在InNs中检测到Gria2、Grin2a、Grik2和Grik4的高表达。此外,Gria2在OPCs、OLGs和ASCs中的表达及Grin2c在ASCs中的表达也上调。这些结果表明,谷氨酸介导的突触调节可能在InNs、OPCs和ASCs中增强。与之相反,ExNs中Gabra1和Glrb水平降低,表明抑制性突触传递减少(图6B)。
为了进一步确认该结果,研究者使用流式细胞仪分离AAV9-CaMKIIα-hM3Dq-mCherry感染细胞,这些细胞中有较高的Gria1表达(图6D),证实了ExN中Gria1的上调。在CPN结扎小鼠的bulk RNA-seq结果中也检测到Gria1和Ryr2的增加,而非Gabra1(图6E)。RNA原位杂交实验进一步观察到,在ExNs(Slc17a7+)中Gria1增加,而Gabra1未增加(图6F-M)。这些数据均显示出神经损伤后RSC的兴奋性突触传递增强。
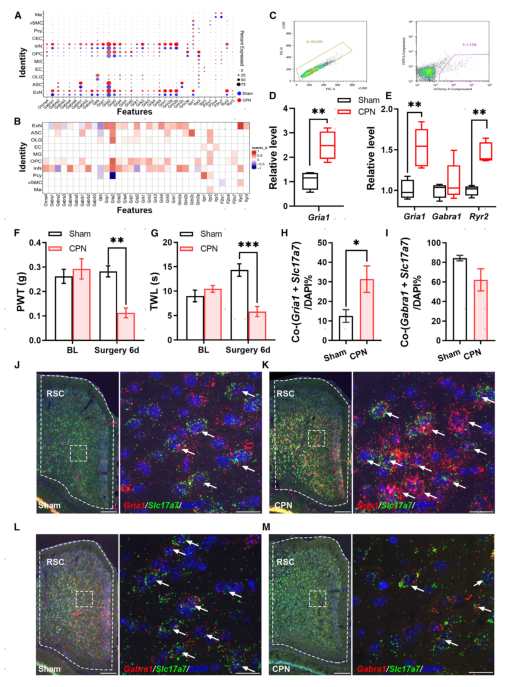
图6 CPN结扎影响配体门控离子通道的表达
6.兴奋性突触传递增强是外周神经损伤后异常疼痛的原因之一
为了证实兴奋性突触传递的变化,研究者对RSC的锥体神经元进行了全细胞膜片钳记录。分别将膜电位保持在-70mV或0mV,记录自发性兴奋性突触后电流(sEPSCs)和抑制性突触后电流(sIPSCs)。与转录变化一致,观察到sIPSCs的频率较低(图7A,B)。此外,在锥体神经元中检测到较高的sEPSCs振幅和较低的sIPSCs振幅(图7A-C)。综上所述,这些数据表明,RSC锥体神经元能够接收到更稳健的信号输入,这可能导致了神经损伤后RSC神经元的过度兴奋性。
AMPARs是由4个同源核心亚基(GluA1-4)组成的异四聚体复合物。增加Gria1、Gria3和Gria4的表达可能增加AMPARs GluA2缺失的比例,而这些AMPARs具有钙通透性(CP-AMPARs)。应用CP-AMPA受体拮抗剂NASPM(100mM)后能够阻断CP-AMPARs的活性,并降低了AMPARs介导的电流(图7D-F)。当微量注射NASPM(2mL,每侧10mM)到雄性或雌性小鼠的RSC时,能够显著提高了CPN结扎小鼠的PWT,延长了TWL,但在假手术小鼠中则没有明显变化(图7H,I)。CP-AMPAR介导的突触传递增加可能参与了疼痛厌恶情绪的产生,而条件性位置偏好行为实验显示NASPM的应用显著导致了对NASPM区域的偏好(图7J,K),表明CP-AMPAR参与了疼痛厌恶。因此,通过NASPM减少RSC的兴奋性突触传递可以改变CPN结扎引起的痛觉过敏。
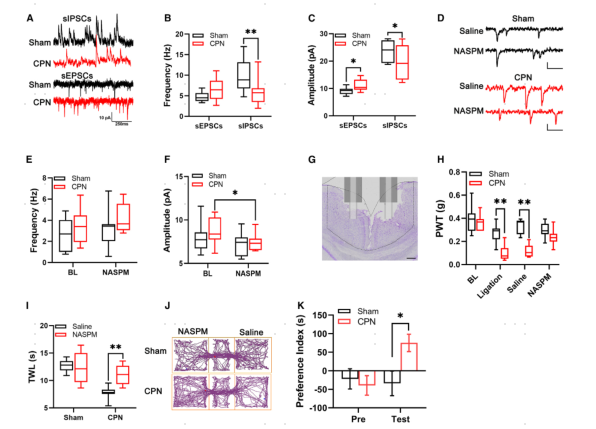
图7 RSC中兴奋性或抑制性突触传递失衡导致机械痛敏和热痛敏
7.抑制RSC中ExNs可逆转CPN结扎小鼠的痛觉过敏
前面的研究结果表明,周围神经损伤增强了RSC ExNs的兴奋性突触传递,导致了痛觉过敏的产生。这促使研究者进一步探索RSC的神经元活动是否对神经损伤后的痛觉过敏反应是必需的。通过AAV9在小鼠RSC CaMKIIα+神经元中表达hM4Di(AAV9-CaMKIIα-hM4Di-mCherry),CNO结合hM4Di能够抑制神经元活性,并在CPN小鼠中检测机械痛敏和热痛敏。CNO使用后,动作电位APs数量减少(图7B,C)。与Ctrl小鼠相比,CNO增加了hM4Di小鼠的PWT,延长了TWL(图8H, F),但没有表现出位置偏好(图8G,H)。上述结果表明,抑制RSC中ExNs可逆转神经损伤小鼠的痛觉过敏。
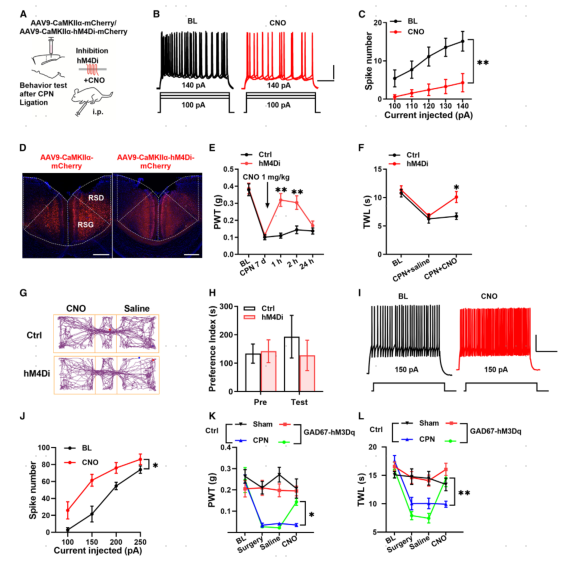
图8 抑制RSC中ExNs改变小鼠疼痛反应
8.增强RSC中InNs的活性可以改变CPN结扎小鼠痛觉过敏
考虑到可以通过增加RSC中InNs的活性来减少过度活跃,因此研究者通过改变InNs的活性来验证这一假设。通过AAV9在小鼠RSC GAD67神经元中表达hM3Dq(GAD67-hM3Dq-mCherry),AAV9-GAD67-mCherry作为Ctrl。电生理结果显示,CNO处理(10mM)增加了GAD67神经元中的动作电位数量(图8J);免疫染色分析显示,CNO处理导致了更多神经元中c-Fos+的表达;行为学上,全身应用CNO(1mg/kg,腹腔注射)增加了PWT和延长了TWL(图8K,L)。由此可见,激活RSC中InNs会降低对机械刺激和热刺激的敏感性。
结论
本文中研究者探索了RSC在疼痛调节中的可能作用以及周围神经损伤导致的RSC转录组学变化。通过scRNA-seq和snRNA-seq整合数据,发现CPN小鼠RSC中细胞依赖型的转录组学变化,从而导致了兴奋性或抑制性突触传递变化。此外,通过NASPM减少兴奋性突触传递可以缓解CPN结扎小鼠的痛觉过敏。这些结果都将进一步帮助理解RSC的转录变化在神经病理性疼痛和记忆存储中的分子机制。
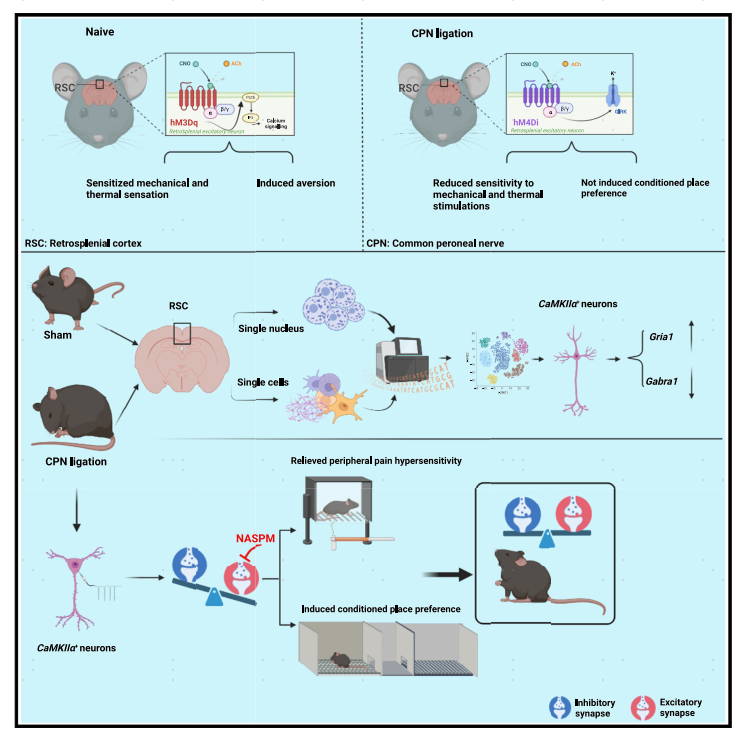
图9 增加RSC中CamkIIα+神经元的活性可使naive小鼠痛觉过敏;周围神经损伤诱导细胞类型依赖的转录组学改变;神经损伤后RSC中兴奋性/抑制性突触传递失衡;降低RSC中钙通透性AMPARs的活性可缓解神经病理性疼痛
参考文献
[1] Jing-Hua Wang, Cheng Wu, Xiang-Yao Li, et al. Single-cell RNA sequencing uncovers the cell type-dependent transcriptomic changes in the retrosplenial cortex after peripheral nerve injury. Cell Reports. 2023; 42,113551.
[2] Lacar, Benjamin et al. Nuclear RNA-seq of single neurons reveals molecular signatures of activation. Nat Commun. 2016;7:11022








