项目文章 | 慢性干皮病细胞图谱中一种新型基底细胞状态及其功能
发布时间:2024-01-15 09:41:37
浙江大学基础医学院杨巍教授、浙江大学公共卫生学院卫生毒理学系余沛霖副教授及浙江大学医学院附属第四医院神经内科李相尧教授团队在J Pharm Anal期刊上发表了题为“Cux1+proliferative basal cells promote epidermal hyperplasia in chronic dry skin disease identified by single-cell RNA transcriptomics”的研究成果。研究中使用单细胞转录组测序(scRNA-seq)鉴定了一种新的增殖型基底细胞(PBC)状态,该状态特异性高表达转录因子CUT-like homeobox 1(Cux1)。进一步的体外研究表明,Cux1通过调节一系列细胞周期蛋白依赖性激酶(CDKs)和细胞周期蛋白,对角质形成细胞增殖至关重要。本研究描绘了慢性干皮病小鼠模型的皮肤单细胞转录组特征,并为干性皮肤相关皮肤病的治疗提供了潜在的治疗靶点。
该研究中,新格元承担了单细胞核转录组测序(GEXSCOPE®)工作。
下面和元小新一起来看看吧~
研究背景
皮肤干燥是许多皮肤病(如银屑病、特应性皮炎(AD))和全身性疾病(如慢性肾病或肝病、糖尿病)的常见临床并发症,患者的皮肤会出现上皮增生和严重瘙痒。已有研究报道了银屑病和特应性皮炎的单细胞转录组研究,但对干燥皮肤小鼠模型(丙酮/乙醚/水(AEW)处理)的scRNA-seq分析仍然缺乏。
方法流程
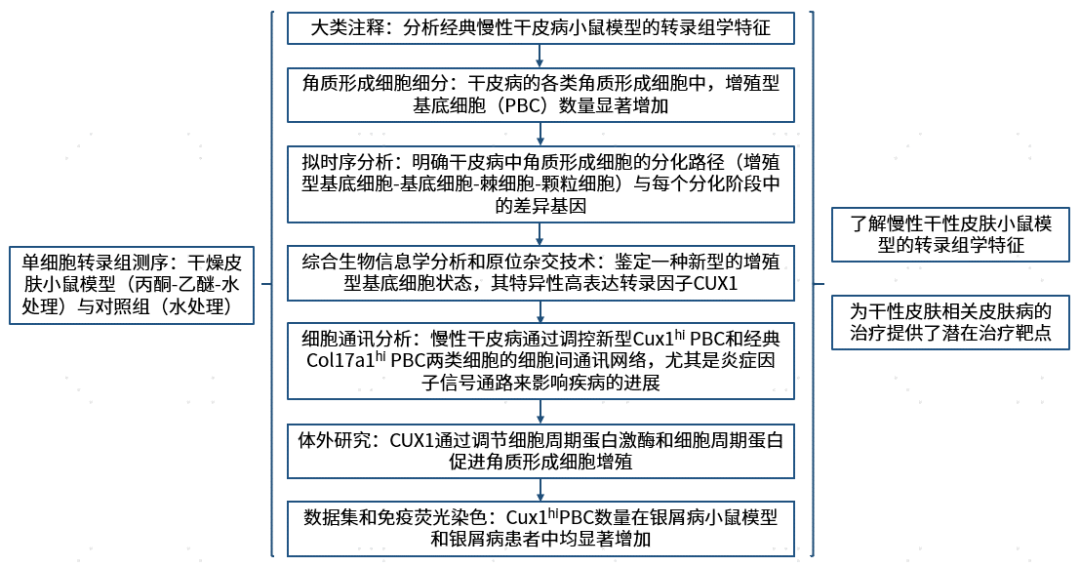
研究结果
1.基于scRNA-seq的AEW小鼠模型细胞类型鉴定
作者为了在单细胞水平上分析正常皮肤和慢性干皮病之间的转录组差异,每组混合三只小鼠进行scRNA-seq。使用UMAP将高质量细胞划分为8个簇,分别为成纤维细胞(FIB),角质形成细胞(KC),骨髓细胞(MYL), T细胞(TC),脂肪细胞(ADI),内皮细胞(ENDO),肥大细胞(MC)和血管平滑肌细胞(vSMC)。AEW组与对照组相比没有出现新的细胞群, AEW组MYL的细胞占比增加,但KC和vSMC的占比下降。
作者进一步分析各细胞类型的差异基因,发现FIB、MYL和KC特有的基因水平上调最多,分别为100、70和61个。相比之下,TC、KC和MYL的下调基因个数最多,分别为34、32和20个。GO分析显示,AEW处理增加了与炎症反应调节和上皮细胞增殖调节相关的差异基因,而减少的差异基因与皮肤发育和细胞外基质组织有关。另外,与干皮病相关的差异基因主要在KC和MYL中发现,强调了这类细胞类型在干皮病中的作用。
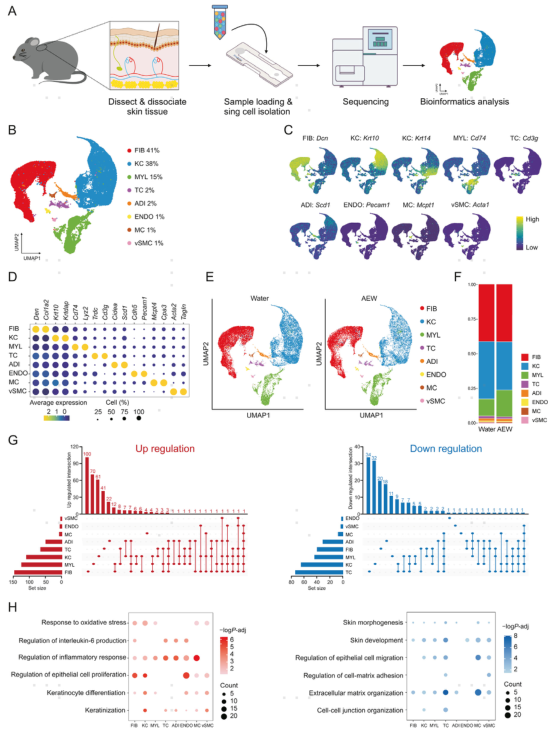
图1 通过单细胞转录组测序分析小鼠干皮病模型的细胞类型
2.小鼠角质形成细胞分为五个亚群
角质形成细胞(KC)在干燥情况下的功能障碍是干皮病的诱因。因此,作者接下来对KC进行进一步分析,所有KC被分为5个亚群,包括棘细胞(SC)、基底细胞(BC)、皮脂腺细胞(SGC)、增殖型基底细胞(PBC)和颗粒细胞(GC)。对照组和AEW组都具有5个KC亚群,作者发现与对照组相比,AEW组PBC占比增加,SC和SGC占比下降。KC中差异基因的上调主要与调节经皮水分流失、调节上皮细胞增殖、皮肤角化和表皮发育等功能有关。因此,皮肤角化和调节经皮水分流失相关的基因在GC得分最高,且显著增加。与KC增殖和细胞周期正调控相关的基因在PBC中得分最高,且显著增加。
进一步分析KC上调的差异基因,发现AEW干皮病模型与其他皮肤病具有许多相似的转录特征。Fabp5是一种对化学诱导的皮肤炎症和肿瘤发生有反应的脂肪酸结合蛋白。巨噬细胞迁移抑制因子(MIF)受体Cd74在硬皮病的KC中增强,并可能与促炎途径有关。Il33是众所周知的Ⅱ型炎性细胞因子,在AD的KC中表达率较高。以上基因表达的增加说明AEW模型小鼠的皮肤发生了严重的炎症反应。KC增殖、分化和迁移相关基因,包括Krt6a、Hes1、Ctnbp1、Cebpb、Aqp3和Mafb,在AEW模型中也上调,揭示了加速细胞发育的潜力。
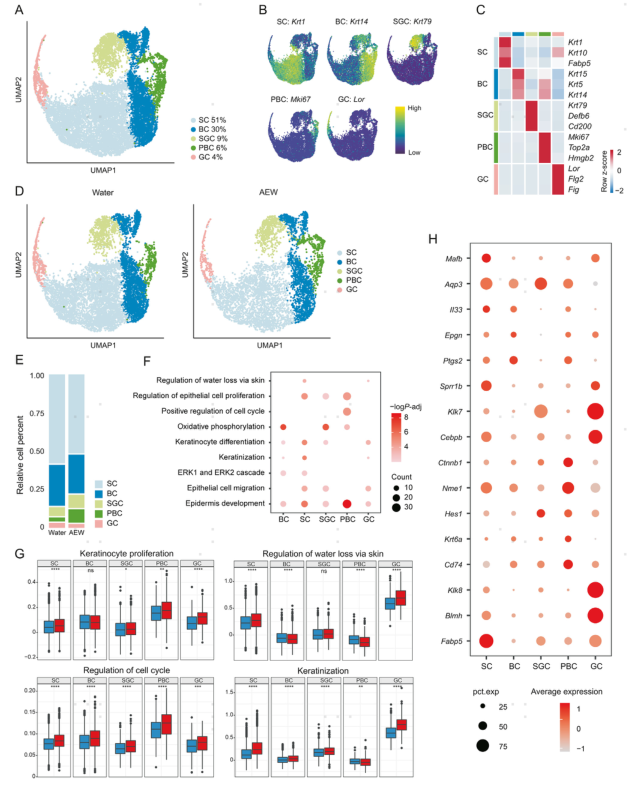
图2 根据小鼠角质形成细胞的转录特征分为5个亚群
3.拟时序分析揭示了干皮病中角质形成细胞的分化动态
为了研究干皮病是否影响表皮发育,作者利用轨迹分析揭示KC分化途径。AEW组中KC的所有五个亚群都排列在一条轨迹上,从PBC、BC、SC到GC。细胞增殖标志物Mki67主要分布在轨迹的开始,角蛋白基因Krt14和Krt1分布在中间,Loricrin基因Lor分布在末端。作者从AEW组的所有KC中鉴定出327个在不同阶段发生了显著变化的基因,PBC由1群基因定义,与DNA包装、细胞对DNA损伤刺激的反应和细胞周期过程有关;BC由2群基因定义,与皮肤发育、ECM组织和细胞迁移的正调控有关;SC由3群基因定义,与皮肤发育、调节经皮水分丢失和伤口反应有关;GC由4群基因集定义,与表皮发育、角质包膜形成和皮肤屏障的建立有关。作者还发现,在AEW组的KC中,58个上调的差异基因和31个下调的差异基因是在拟时序过程的高变基因。综上所述,拟时序分析为探索AEW模型中KC分化调控程序奠定了基础。
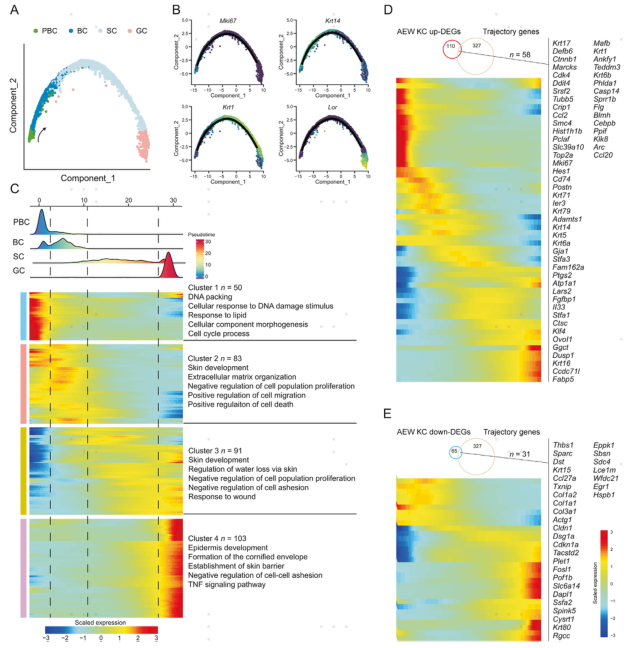
图3 拟时序轨迹分析揭示干皮病中角质形成细胞分化动态
4.干皮病中Cux1+ PBC的新状态
作者重新将PBC分为两种状态(Col17a1hi和Cux1hi),Col17a1hi状态由编码细胞表面膜联蛋白的基因Anxa2和表皮干/祖细胞的标记基因Col17a1表征。Cux1hi状态的特征是编码锌离子跨膜转运蛋白的基因Slc39a1和编码细胞周期相关转录因子的基因Cux1。Cux1hi PBC主要存在于AEW组。作者使用原位杂交技术研究表皮中两种PBC状态的存在,Col17a1 RNA探针与Ki67蛋白共定位分析显示大约40%的PBC表达Col17a1,但AEW处理不影响Col17a1hi PBC的细胞百分比。Cux1 RNA探针与Ki67蛋白的共定位分析显示,大约28%的PBC表达Cux1,但AEW处理显著提高了Cux1hi PBC的细胞百分比。不同的拟时序分析方法显示Col17a1hi PBC比Cux1hiPBC具有更高的发育潜力,意味着在AEW模型中Col17a1hi状态发展到Cux1hi状态。因此,数据显示了一种新的干燥皮肤刺激Cux1hi PBC状态。
两种PBC状态有不同的转录特征。GO和GSEA分析表明,Col17a1hi PBC中富集了细胞运动的正向调节和对损伤通路的反应,而Cux1hi PBC中富集了mRNA加工和mRNA剪接。Col17a1hi PBC在分化、发育和迁移方面得分更高,而Cux1hi PBC在增殖方面得分更高。作者进一步分析PBC的细胞周期,发现G1期Cux1hi PBC显著减少,S期Cux1hi PBC显著增加。细胞周期相关基因如Ccna2、Ccnb2、Ccnd1、Ccnd2、Cdk1和Cdk4在Cux1hi PBC中表达水平较高。综上所述,这些数据表明Cux1hi PBC具有较强的增殖活性,这可能是导致干皮病表皮增生的原因。
由于转录因子在细胞增殖中起关键作用,作者接下来对两种PBC状态进行了SCENIC分析,发现Klf2、Klf4和Klf6是Col17a1hi PBC的主要转录因子,而Cux1、Dlx3和Lef1是Cux1hi PBC的转录因子。因此,数据显示Cux1hi PBC中的主要转录因子可能是AEW模型中PBC过度增殖的关键调节因子。
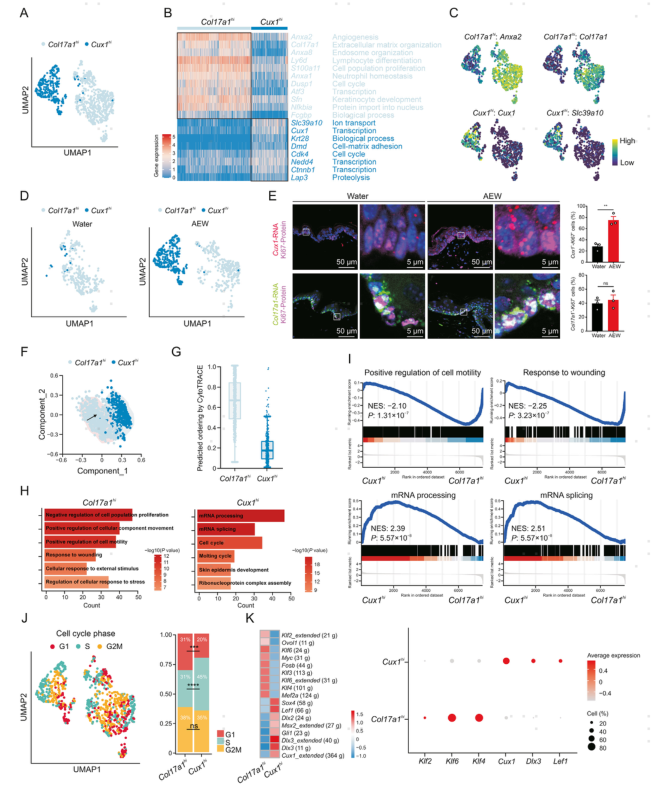
图4 干皮病中新型Cux1+增殖型基底细胞亚群
5.干皮病中PBC与其他细胞之间潜在的互作
为了研究PBC与其他细胞类型之间潜在的细胞间通信模式,作者进行了CellChat分析,检测到AEW组和对照组中22条重要的分泌信号通路。包括C-X-C基序趋化因子配体(CXCL)、胰岛素样生长因子(IGF)、蛋白S(PROS)、多营养因子(PTN)、颗粒蛋白前体(GRN)、CeC基序趋化因子配体(CCL)、成纤维细胞生长因子(FGF)和生长抑制特异性基因(GAS),共8个信号通路在水和AEW组之间结果相似,表明在两种处理下的皮肤生物学功能中起着相同的作用。与水组相比,AEW组其他14条信号通路发生显著变化:肿瘤坏死因子(TNF)、内脂素、血管内皮生长因子(VEGF)、白细胞介素-6 (IL6)、骨形态发生蛋白(BMP)、kit补体、MIF、转化生长因子(TGFb)、表皮生长因子(EGF)、凝集素等信号通路增加;集落刺激因子(CSF)、降钙素受体(CALCR)和血管生成素样蛋白(ANGPTL)等途径减少。接下来,作者分析了Col17a1hi PBC和Cux1hi PBC在TNF、VEGF、BMP和EGF信号通路中的作用。Col17a1hi PBC和Cux1hi PBC均表达受体Tnfrsf1a接受来自MC的Tnf信号,Col17a1hi PBC是Vegfa的主要来源,ENDO中唯一的受体是Flt1。Bmp2和Hbegf均以自分泌和旁分泌方式起作用。Col17a1hi PBC同时是发送者和接收者,而Cux1hi PBC仅通过表达Bmpr1a、Bmpr2和Egfr作为接收者。综上所述,AEW处理可能通过调节细胞信号网络影响PBC的生物学功能。
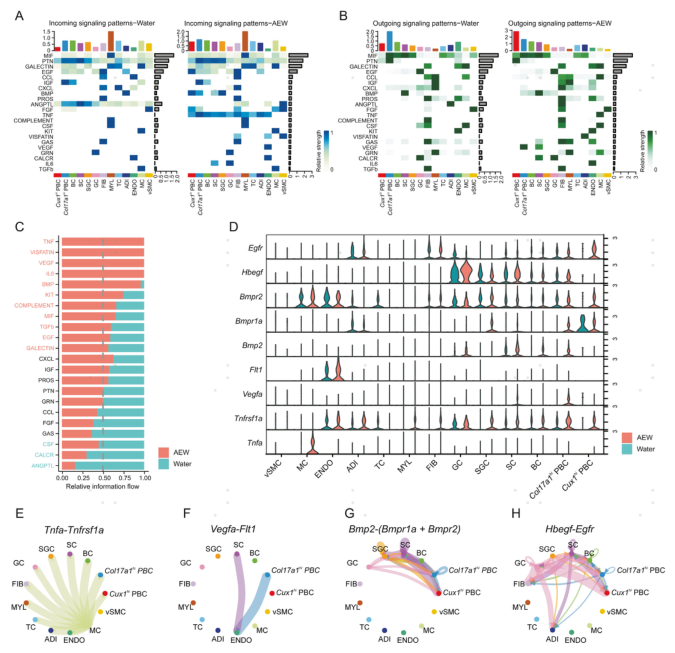
图5 增殖型基底细胞与其他细胞之间潜在的配体受体相互作用
6.转录因子Cux1促进角质形成细胞增殖
Cux1hi PBC在AEW增生皮肤中升高,提示其对细胞增殖有正向调节作用。为了验证这一假设,在慢病毒转染CUX1靶shRNA和阴性对照shRNA后,HaCaT细胞的CUX1 mRNA水平显著降低。CUX1基因敲除显著降低HaCaT细胞的活力和集落形成。此外,CUX1基因的敲除导致G1期占比升高,S期占比降低。因此,为了评估CUX1对细胞周期调节蛋白的调控作用,qPCR结果显示CUX1的敲除降低了CDK2、CCND1、CCND2和CCNE1 mRNA水平,但不影响CDK4和CDK6。综上所述,这些结果表明CUX1促进了KC细胞的增殖。
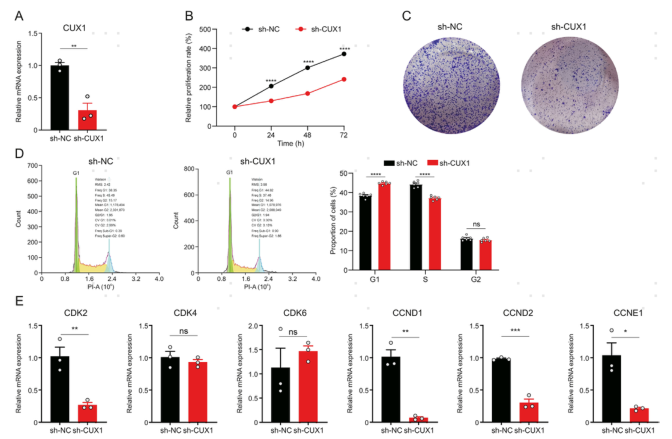
图6 转录因子CUX1促进角质形成细胞的细胞增殖
7.银屑病患者Cux1+ PBC升高
银屑病是成人中最常见的慢性皮肤病,其特征是皮肤干燥和KC过度增殖。为了检验研究结果的适用性,作者进一步探索最近发表的小鼠和人类银屑病研究的scRNA-seq数据。使用增殖标记物Ube2c、Top2a和Mki67来区分PBC和其他类型的KC,发现无论是银屑病模型小鼠还是患者,PBC的细胞占比都比对照组显著增加。
此外,scRNA数据和免疫荧光染色结果均表明银屑病患者PBC中CUX1 mRNA和CUX1蛋白升高。这些结果共同表明,过多的Cux1+ PBC可能是银屑病表皮增生的常见过程。
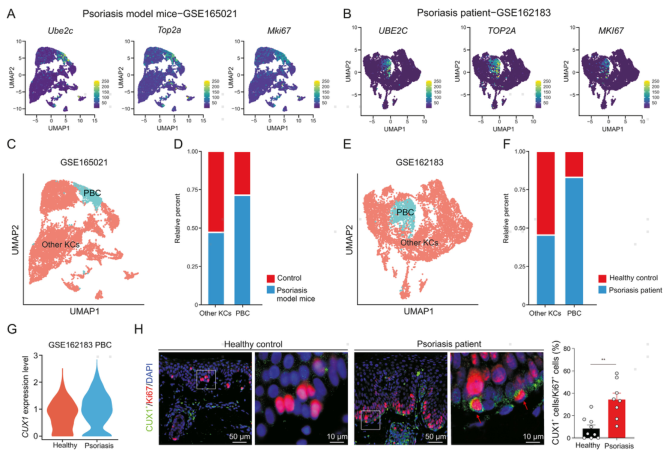
图7 银屑病患者中Cux1+增殖型基底细胞增多
结论
作者构建了典型的慢性干皮病小鼠模型,AEW模型的单细胞转录组图谱,并揭示了一种可能导致表皮增生的Cux1hi PBC状态。这些发现将有助于了解干皮病的发病机制,并为治疗与干性皮肤相关的疾病提供新的治疗靶点。
参考文献
Huang M, Hua N, Zhuang S, et al. Cux1+ proliferative basal cells promote epidermal hyperplasia in chronic dry skin disease identified by single-cell RNA transcriptomics. J Pharm Anal. 2023 Jul;13(7):745-759. doi: 10.1016/j.jpha.2023.04.004. Epub 2023 Apr 11. PMID: 37577389; PMCID: PMC10422139.








