项目文章 | 多组学分析揭示瘢痕疙瘩微环境特点
发布时间:2024-01-15 10:29:48
2023年12月,北京协和医院整形外科王友彬教授课题组在eBioMedicine上发表“Multi-omics analyses reveal bacteria and catalase associated with keloid disease”的研究文章。该研究利用微生物组学、宏蛋白组学、代谢组学、单细胞转录组学和细胞源性异种移植(CDX)小鼠模型等方法来探索细菌在瘢痕疙瘩疾病中的作用,发现特定类型细菌和过氧化氢酶有助于瘢痕疙瘩疾病的发展,可能为瘢痕疙瘩疾病新的治疗策略找到新的靶点。
新格元在该研究中提供GEXSCOPE®单细胞转录组测序实验及单细胞测序数据分析服务等。
下面和元小新一起来看看吧~
研究背景
瘢痕疙瘩是一种以真皮内大量胶原纤维沉积为特征的良性皮肤肿瘤,常由损伤或感染后炎症引起,伴有疼痛、瘙痒等症状,严重影响患者的身心健康和生活质量。由于缺乏有效的药物,且手术切除或皮质激素注射后的高复发率,其治疗仍然是皮肤科医生和整形外科医生面临的一大挑战。既往研究表明,细菌多样性与多种皮肤病相关,如脂溢性皮炎、痤疮、银屑病等。细菌感染后微环境的改变和炎症已被证实在这些皮肤病中起重要作用。
据报道,在瘢痕疙瘩成纤维细胞中,活性氧(ROS)水平增加,ROS促进了瘢痕疙瘩的炎症和氧化应激反应。过氧化氢酶(CAT)是细胞和微生物有氧代谢中重要的抗氧化酶。它在清除ROS和维持氧化还原状态的平衡中起重要作用。之前的一些研究发现,某些类型的细菌会产生CAT,而另一些则不会。因此,明确微生物在瘢痕疙瘩中的作用可能为瘢痕疙瘩的治疗和预防找到新的靶点。
方法流程
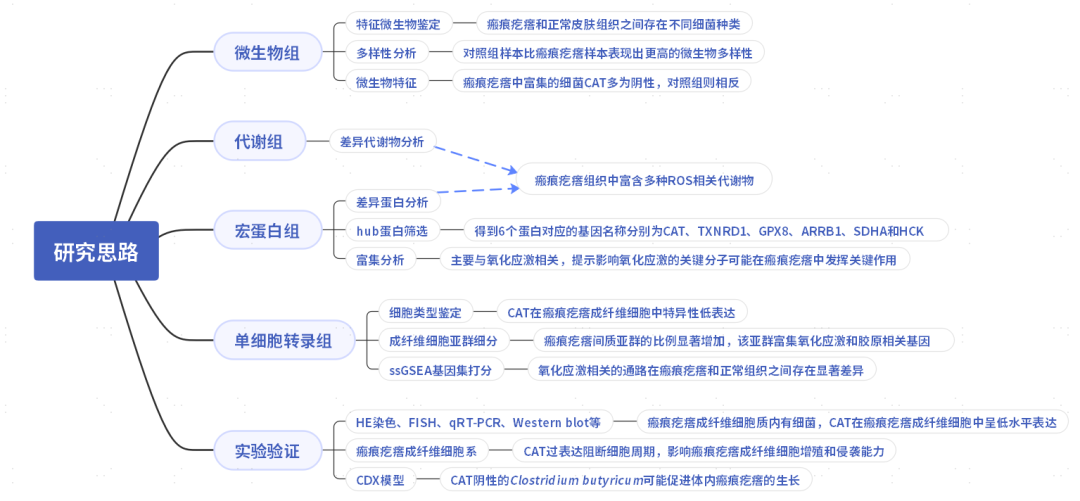
研究结果
1.瘢痕疙瘩中的特定细菌类型
对20例瘢痕疙瘩和19例正常全层皮肤组织进行了微生物组测序,以探究瘢痕疙瘩和正常皮肤组织之间细菌种类的差异。在属水平上,瘢痕疙瘩中Clostridium、Oxalobacteraceae、Ralstonia、Burkholderiales、Succinivibrio、Enterococcus数量较多,而对照组中Gammaproteobacteria、Firmicutes、Actinobacteria、Propionibacterium、Lysinibacillus数量较多。在种水平上,瘢痕疙瘩中Clostridia、Roseburia、Brucellaceae、Burkholderiales数量较多,而对照组中Desulfovibrionaceae、Methylophilaceae、Comamonadaceae、Lysinibacillus等丰度较高。瘢痕疙瘩中富集的细菌经CAT试验多为阴性,而对照组则相反。对照组样本比瘢痕疙瘩样本表现出更高的微生物多样性。宏蛋白质组学测序数据显示,C. Clostridia、F. Lachnospiraceae、G. Roseburia在瘢痕疙瘩中增加。
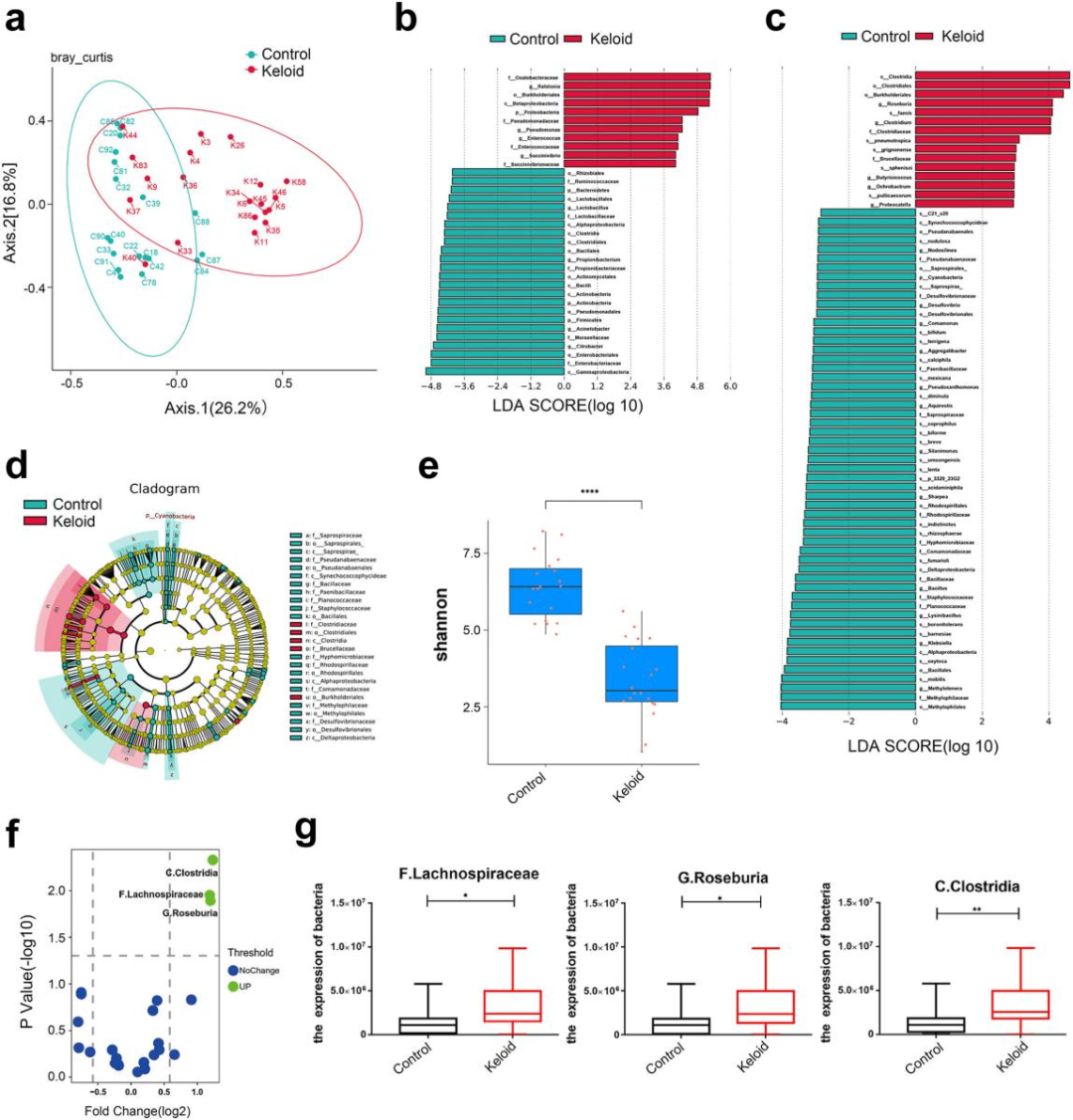
图1.瘢痕疙瘩的微生物组学分析
2.瘢痕疙瘩中特定细菌的验证与分离
形态学上,瘢痕疙瘩的表皮较正常皮肤明显增厚。瘢痕疙瘩的真皮层纤维束异常粗大致密,血管数量较多,而正常皮肤真皮层组织的纤维束较小稀疏。对皮肤样本的真皮层和脂肪层进行荧光原位杂交(FISH)分析,瘢痕疙瘩和对照组真皮细菌染色呈阳性,对照组细菌较多。然而,两组的两个脂肪层几乎没有阳性细菌染色。电镜结果证实瘢痕疙瘩成纤维细胞质内有细菌。
采用基于液滴微流控培养细菌,共分离出7种细菌,包括Bacillus subtilis、Clostridium butyricum、Staphylococcus epidermidis、Propionibacterium acnes、Propionibacterium Avidum、Staphylococcus capitis和Staphylococcus aureus。由于发现Clostridium butyricum和Bacillus subtilis分别是瘢痕疙瘩组和对照组的特异性优势菌,因此选择这两种细菌与瘢痕疙瘩成纤维细胞共培养。Clostridium butyricum的存在刺激了成纤维细胞的增殖、H2O2和ROS的产生,而Bacillus subtilis则产生了相反的现象。这说明CAT阴性菌的存在可能通过增加H2O2和ROS来促进成纤维细胞的生长。此外,患者瘢痕疙瘩组织中H2O2和ROS水平均明显升高,提示H2O2和ROS可能在瘢痕疙瘩组织的生长中也起着重要作用。
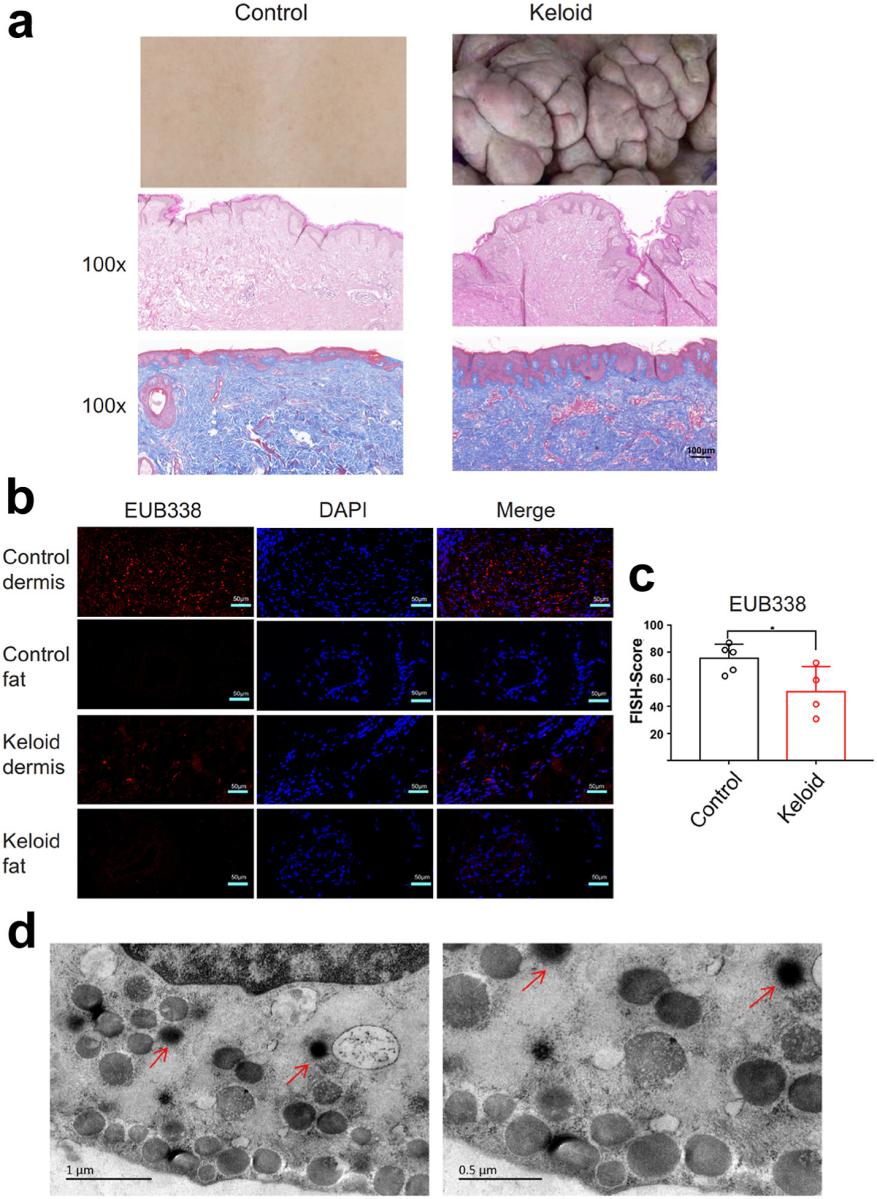
图2.瘢痕疙瘩真皮内可见细菌
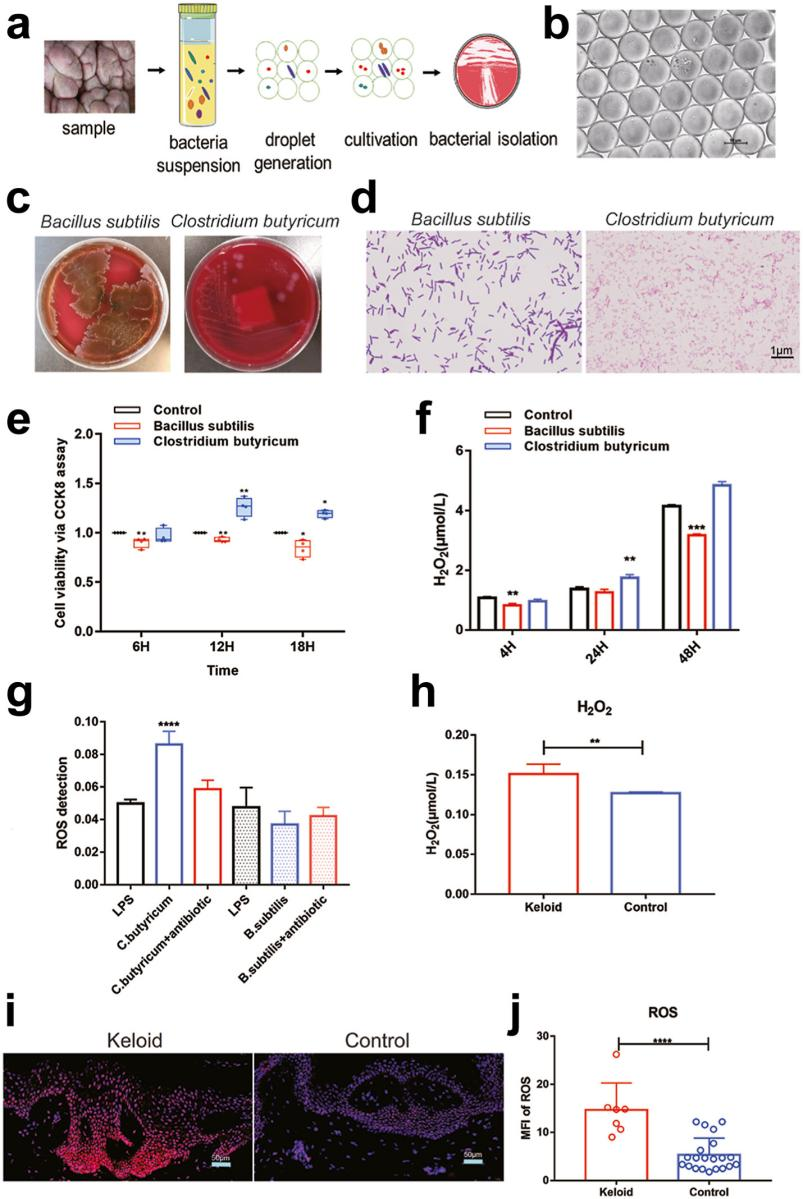
图3.分离细菌并与瘢痕疙瘩原代成纤维细胞共培养
3.蛋白质组学显示CAT是瘢痕疙瘩的一种特殊蛋白
18个瘢痕疙瘩组织和12个正常皮肤组织的宏蛋白组学显示两组共有775个差异表达蛋白,包括516个上调差异蛋白和259个下调差异蛋白。利用MNC、MCC、EPC、BottleNeck和degree共5种算法在差异蛋白中筛选hub蛋白,并使用维恩图找到五种算法计算出的交叉蛋白,共得到6个蛋白,对应的基因名称分别为CAT、TXNRD1、GPX8、ARRB1、SDHA和HCK。功能富集主要与氧化应激相关,提示影响氧化应激的关键分子可能在瘢痕疙瘩中发挥关键作用。
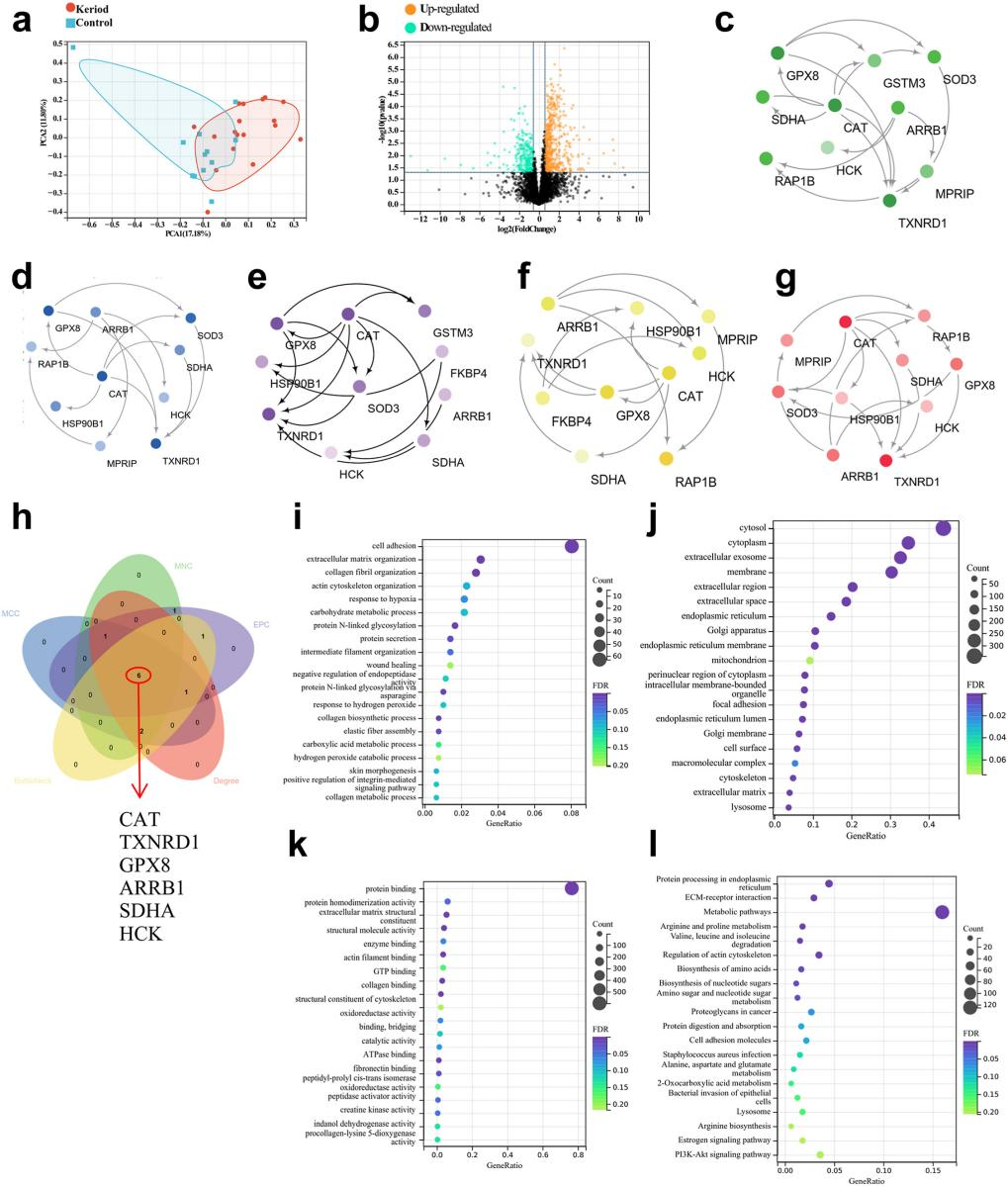
图4.瘢痕疙瘩样本的宏蛋白质组学分析
4、CAT在瘢痕疙瘩成纤维细胞的病理过程中起重要作用
CAT、超氧化物歧化酶1(SOD1)和一氧化氮合酶(iNOS)在氧化应激中起重要作用。免疫组化表明CAT和SOD1在正常皮肤组织中显著增高,而iNOS在瘢痕疙瘩组织中显著升高。qRT-PCR、蛋白质印迹法和免疫荧光检测证实瘢痕疙瘩组织中CAT表达水平降低。
人体内产生的H2O2由CAT清除,CAT是人成纤维细胞中H2O2的主要清除酶。为了确定CAT在瘢痕疙瘩成纤维细胞功能中的作用,从瘢痕疙瘩组织中分离培养原代成纤维细胞用于后续实验。qRT-PCR、CAT活性检测试剂盒和荧光共聚焦显微镜也证实了CAT在瘢痕疙瘩成纤维细胞中呈低水平表达。
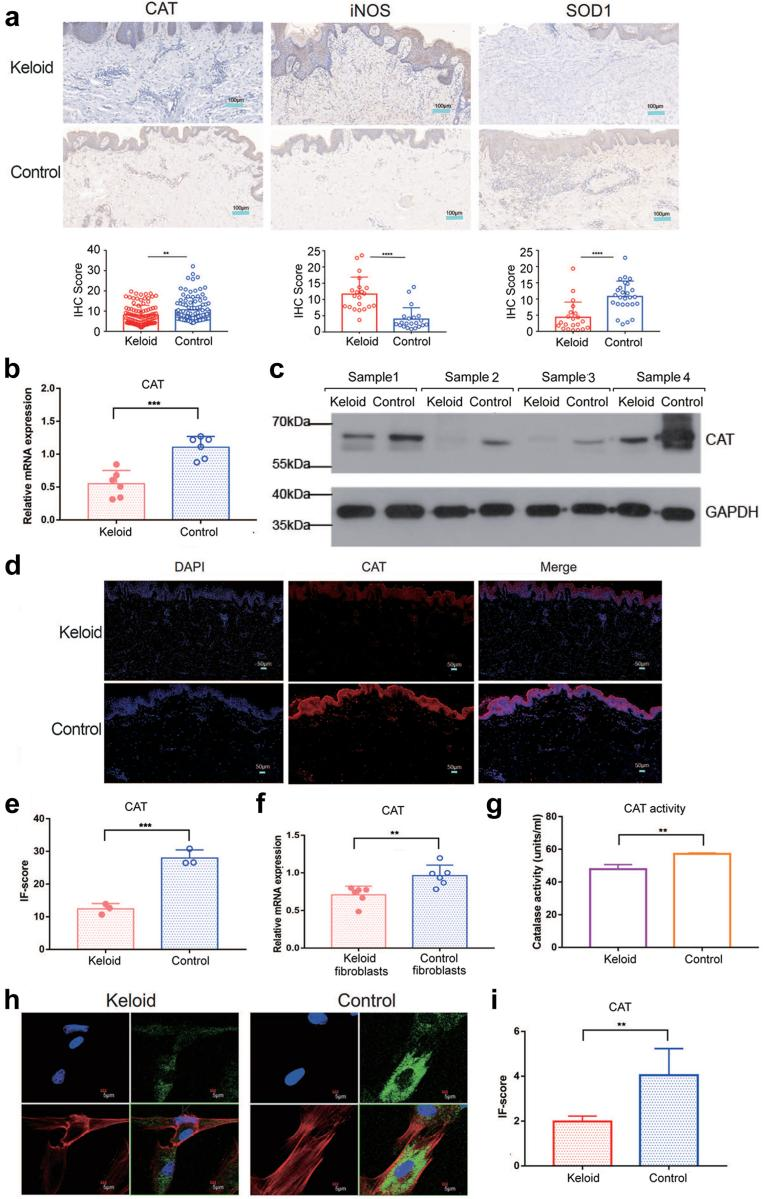
图5.瘢痕疙瘩中ROS相关基因的表达
5、单细胞转录组分析和瘢痕疙瘩成纤维细胞中CAT功能研究
对6例瘢痕疙瘩组织和6例匹配的癌旁正常组织进行单细胞转录组测序,得到215795个细胞,分为11个细胞类型。瘢痕疙瘩组织中的成纤维细胞比例显著高于正常组织。对成纤维细胞进行亚群细分,分为4个亚群,包括促炎细胞(PF)、间质细胞(MF)、分泌乳头状细胞(SPF)和分泌网状细胞(SRF)。瘢痕疙瘩中MF的比例显著增加,而对照组中SPF和SRF比例显著增加。MFs中富集氧化应激相关基因和胶原相关基因。瘢痕疙瘩中成纤维细胞氧化应激导致的细胞死亡评分高于正常组织,与氧化应激相关的通路在瘢痕疙瘩和正常组织之间存在显著差异,包括细胞的氧化解毒和对低氧、氧、缺氧的反应。
单细胞转录组测序显示,CAT在瘢痕疙瘩成纤维细胞中特异性低表达。使用慢病毒与原代瘢痕疙瘩成纤维细胞建立CAT敲低或过表达稳定细胞系。CAT敲低的成纤维细胞产生了更多的胶原Ⅰ和胶原Ⅲ,这两者都是瘢痕疙瘩中ECM成分的持续积累所需要的。重要信号通路蛋白NF-κB和AKT的表达水平在CAT敲低的细胞中升高,而在CAT过表达的细胞中降低。敲低CAT后成纤维细胞的增殖能力增加,G1/S期成纤维细胞比例降低,而CAT过表达后成纤维细胞的增殖能力下降,G1/S期成纤维细胞比例升高。CAT过表达阻断细胞周期,影响瘢痕疙瘩成纤维细胞增殖。敲低CAT的成纤维细胞的侵袭能力也增加,而CAT过表达的成纤维细胞侵袭能力下降。
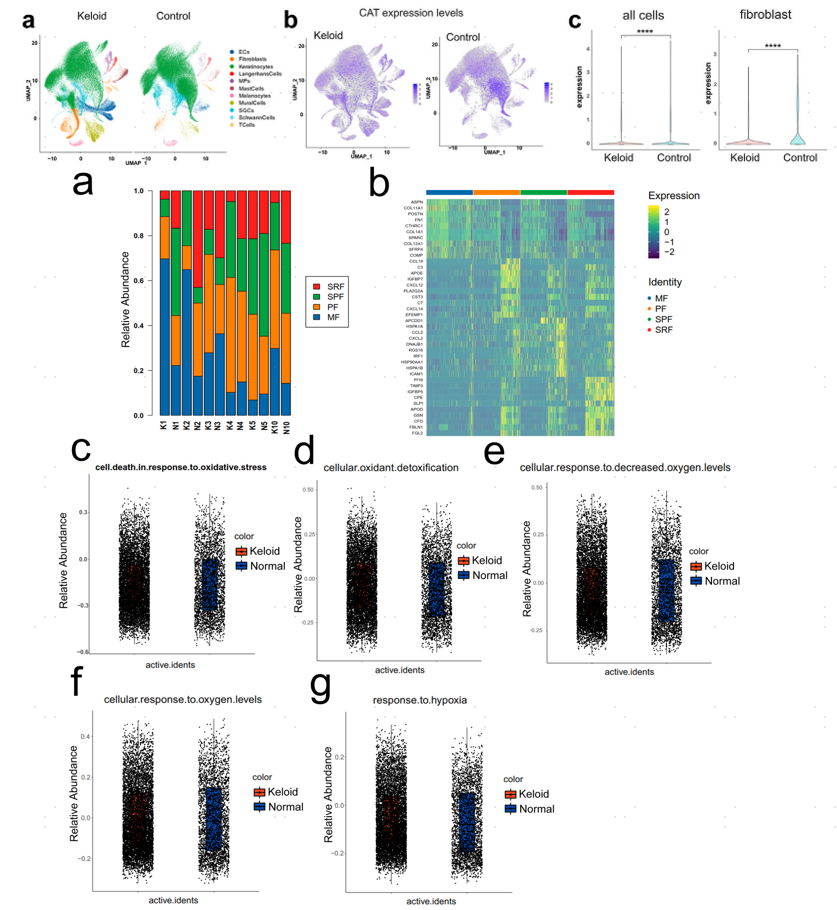
图6.瘢痕疙瘩成纤维细胞的单细胞转录组分析
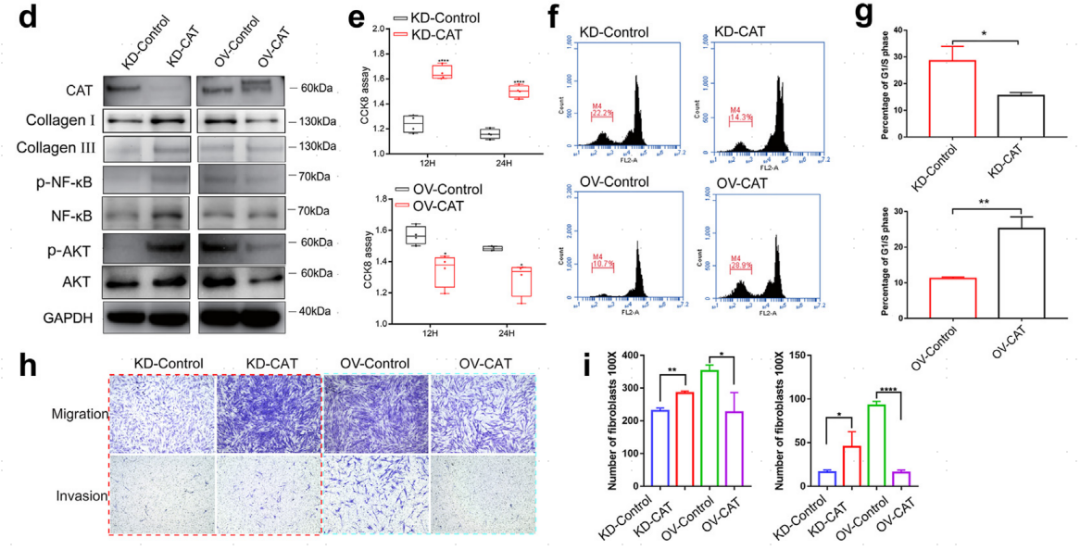
图7.瘢痕疙瘩成纤维细胞中CAT的功能研究
6、利用细胞来源的异种移植(CDX)模型研究特定细菌在瘢痕疙瘩生长中的作用
目前尚无用于瘢痕疙瘩生理研究的动物模型。使用CDX模型模拟体内的瘢痕疙瘩生长。在裸鼠下腹部注射患者成纤维细胞1个多月后形成清晰的白色组织块,裸鼠中CAT过表达抑制瘢痕疙瘩的形成和生长。解剖组织块发现在注射过表达CAT成纤维细胞的组织中CAT和SOD1较高,而Collagen III和TGF-β较低,ROS也显著降低。
将Clostridium butyricum和Bacillus subtilis分别与原代瘢痕疙瘩成纤维细胞混合,注射到裸鼠下腹部皮下,发现Clostridium butyricum可以显著促进瘢痕疙瘩成纤维细胞的增长,而Bacillus subtilis则表现出一定的抑制作用。FISH实验证实组织中存在相当数量的细菌。Clostridium butyricum组CAT和SOD1表达较低,而Bacillus subtilis组TGF-β和NF-κB表达较高。这些结果共同表明,CAT阴性的Clostridium butyricum可能促进体内瘢痕疙瘩的生长。
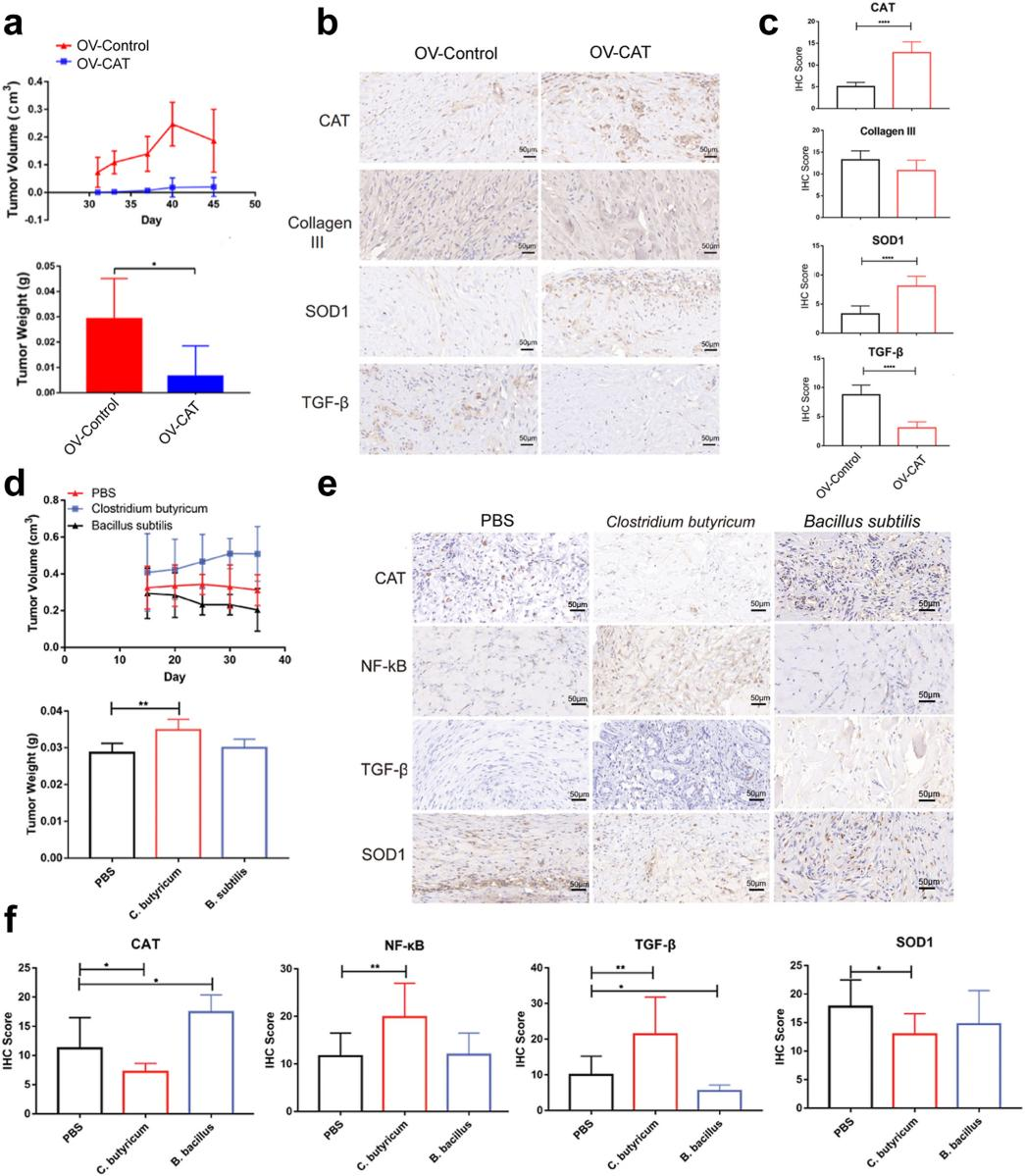
图8.CDX模型显示CAT在瘢痕疙瘩形成中起重要作用
结论
该研究系统地探索了细菌多样性及其在瘢痕疙瘩疾病中的作用。使用CDX动物模型来研究瘢痕疙瘩在体内的生长。特定类型的细菌影响瘢痕疙瘩中CAT的表达,进而导致ROS的清除,影响瘢痕疙瘩的增殖,该研究的发现可能为瘢痕疙瘩的治疗提供新的策略。
参考文献
Shan M, Xiao M, Xu J, et al. Multi-omics analyses reveal bacteria and catalase associated with keloid disease. EBioMedicine. 2023 Dec 6;99:104904. doi: 10.1016/j.ebiom.2023.104904. dd








