项目文章Nat. Biotechnol | 突破性单细胞测序技术揭示表达IL-10的CAR-T细胞持久抗癌之奥秘
发布时间:2024-01-19 11:28:09
2024年1月,来自瑞士洛桑联邦理工学院及合作机构的科学家们在Nature Biotechnology杂志上发表题为“IL-10-expressing CAR-T cells resist dysfunction and mediate durable clearance of solid tumors and metastases”的论文。研究制备IL-10自分泌CAR-T细胞(IL-10-HER2-CAR-T),通过自分泌IL10使CAR-T细胞在肿瘤微环境中维持线粒体结构和功能完整性,并以线粒体丙酮酸转运体(mitochondrial pyruvate carrier, MPC)依赖的方式增强氧化磷酸化代谢促进细胞增殖和效应功能。实验结合黑色素瘤模型、乳腺癌肺转移肿瘤模型、结肠癌皮下肿瘤模型以及人胰腺癌NSG小鼠原位模型等多个肿瘤模型,证实这种代谢增强型IL10-HER2-CAR-T细胞可以实现原位实体病灶和转移灶完全消退。更重要的是,IL10-HER2-CAR-T细胞可以诱导干细胞样免疫记忆反应,经其治愈的荷瘤小鼠可以完全抵抗第二次肿瘤细胞接种,实现持久免疫保护。
新格元在该研究中提供GEXSCOPE®单细胞转录组测序服务。
下面和元小新一起来看看吧~
研究背景
嵌合抗原受体(CAR)T细胞治疗在治疗B细胞恶性肿瘤方面取得了显著的临床成功。然而,CAR-T细胞迄今为止对实体肿瘤的疗效有限。阻碍CAR-T细胞治疗效果的主要因素之一是由于细胞衰竭导致的肿瘤浸润T细胞功能障碍。代谢健康是维持T细胞生存和功能的必要条件。作者团队前期研究发现在体内给药IL-10-Fc融合蛋白可使肿瘤内T细胞代谢向氧化磷酸化方向改变,增加线粒体呼吸能力,诱导终末耗竭CD8+肿瘤浸润淋巴细胞(TILs)的扩张和效应功能显著增强。因此本研究基于代谢重编程策略设计了代谢装甲型CAR-T细胞,可自分泌IL-10,防止与T细胞衰竭相关的功能损伤,增强增殖能力和效应功能,以更好地治疗实体肿瘤。
方法流程
研究结果
1.表达IL-10降低CAR-T细胞在肿瘤微环境中潜在的高耗竭风险
首先作者合成了表达小鼠IL10的HER-CAR-T功能细胞,使用自裂解2A样肽串联二代anti-HER2 CAR分子和小鼠IL-10(图1a)。通过静脉注射分别将两种CAR-T细胞过继到皮下荷瘤小鼠模型中,来治疗小鼠结肠腺癌肿瘤(图1b)。流式分析结果,一方面表明IL-10表达显著增强了CAR-T细胞的增殖,另一方面表明IL-10 HER2 CAR-T细胞分泌的IL-10富集在肿瘤中,并主要作用于肿瘤浸润的CAR-T细胞(图1c-i)。有趣的是,CAR-T表达密度最高的HER2 CAR-T细胞显示细胞因子产量减少,PD-1和TIM-3表达增加(图1j-l),这表明CAR-T细胞通过强烈的抗原刺激可能导致肿瘤内CAR-T细胞衰竭。
为了将这一策略推广到人源CAR-T(hCAR-T)细胞,作者制备了IL-10表达CD19靶向T细胞抗原受体-α常量(TRAC)缺陷的hCAR-T细胞。与小鼠CAR-T细胞相似,IL-10 CD19 hCAR-T细胞在PANC1-CD19荷瘤的免疫缺陷NOD scid γ(NSG)小鼠中,与传统的CD19 hCAR-T细胞相比,颗粒酶B和干扰素-γ(IFNγ)的产生增强(图1m-o),再次证明IL-10通过促进CAR-T细胞的增殖和效应功能来抑制肿瘤中的CAR-T细胞功能障碍。
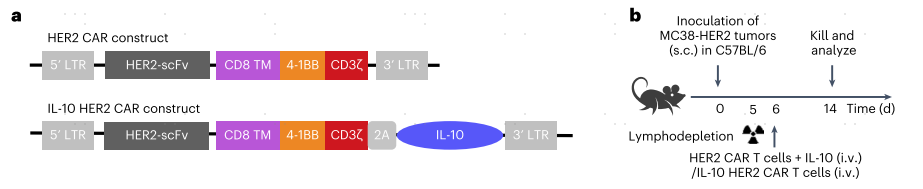
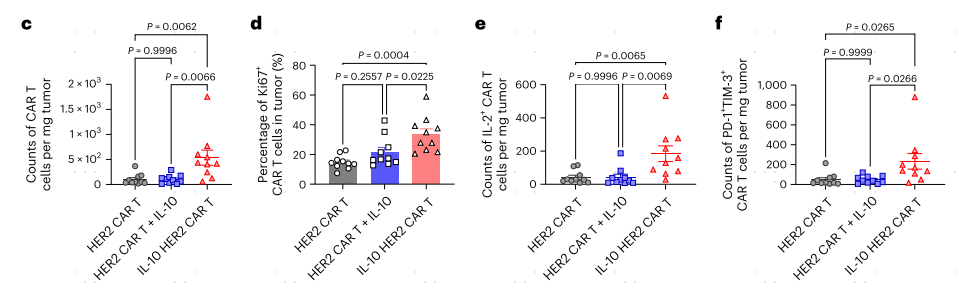
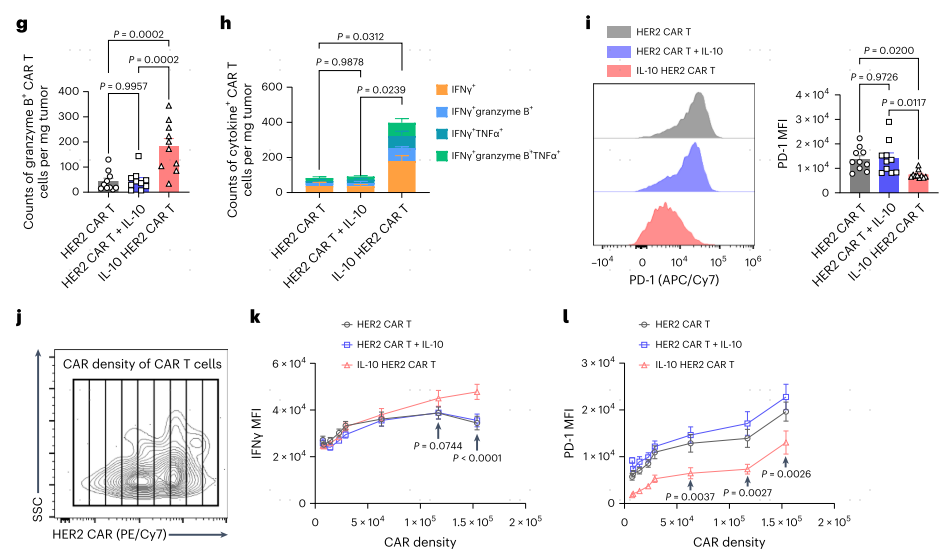
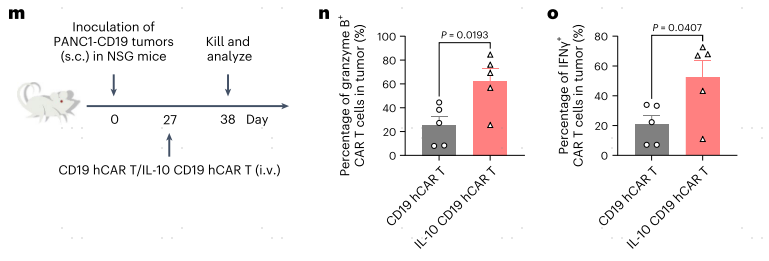
图1 通过表达IL-10,CAR-T细胞抵御抗肿瘤功能障碍
2.IL-10通过维持CAR-T细胞线粒体适应性抵御功能失调和抗原过度激活导致的细胞耗竭
接下来,作者分别用MitoTracker Green(MG)和MitoTracker Deep Red(MDR)染色检测CAR-T细胞的线粒体质量和膜电位。线粒体功能失调的CAR-T细胞(定义为MDR/MG的低比率;MDR/MGlo)在肿瘤中比在脾脏中明显富集(图2a,b)相比HER2 CAR-T细胞单药和HER2 CAR-T细胞联合外源性IL-10,肿瘤浸润的IL-10 HER2 CAR-T细胞维持了线粒体的适合度,线粒体功能障碍的频率显著降低(5.5%,图2f,g)。IL-10的表达也增加了IL-10 HER2 CAR-T细胞中MDR与MG的比值(图2h),线粒体呈管状,嵴结构良好,嵴数量和长度增加(图2i-1)。由于CAR表达密度增加意味着CAR-T细胞可能相应强烈的抗原刺激导致细胞衰竭,作者进一步比较了CAR表达密度增加的CAR-T细胞表现出更高频率的线粒体功能障碍,结果显示相比HER2 CAR-T,IL-10 HER2 CAR-T细胞中线粒体功能障碍明显减少(图2m)。同样,与CD19 hCAR-T细胞相比,IL-10 CD19 hCAR-T细胞在肿瘤中线粒体功能失调的细胞频率降低,MDR/MG比例增加(图2n,o)。这些结果表明,抗原刺激可能导致CAR-T细胞线粒体功能障碍,而IL-10的表达可以维持CAR-T细胞的线粒体适应性,特别是那些经历强烈抗原刺激的细胞。
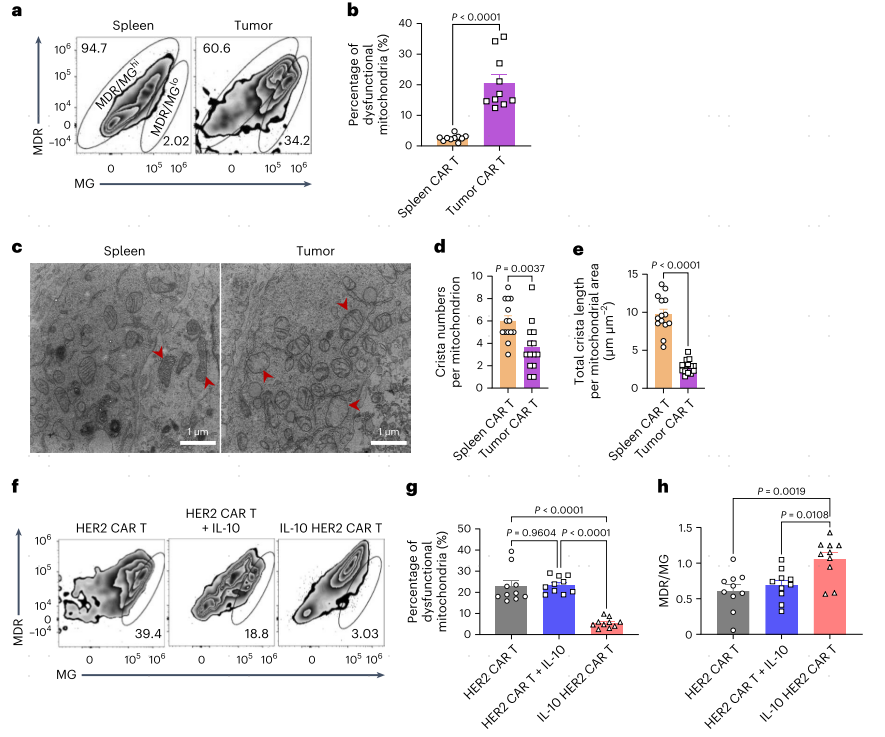
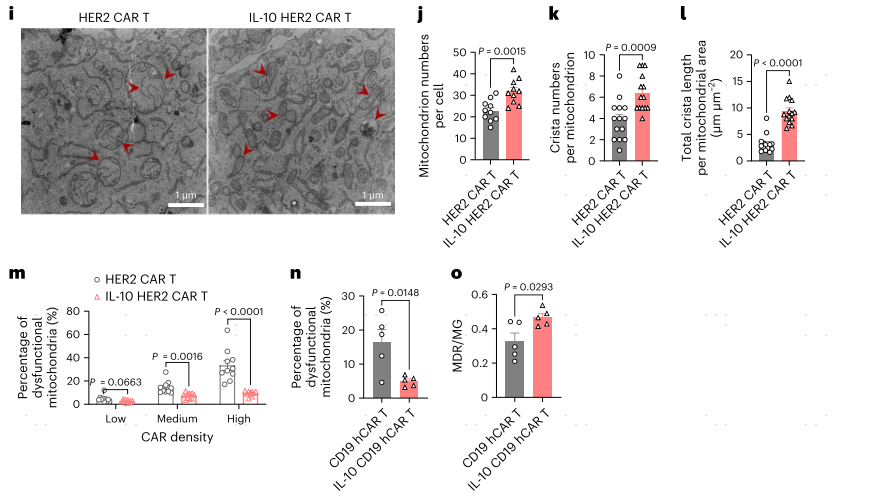
图2 IL-10的表达维持了CAR-T细胞的线粒体适应性
3.表达IL-10促进了CAR-T细胞的氧化磷酸化
为了模拟TME中持续的肿瘤抗原刺激,作者将MC38-HER2细胞和CAR-T细胞共培养。在抗原刺激后,IL-10 HER2 CAR-T细胞与单独的HER2 CAR-T细胞相比,基线和最大耗氧率(OCRs)显著升高(图3a,b),因此,IL-10的表达增加了OCR和胞外酸化率(ECAR)的比值,并重新编程了CAR-T细胞的代谢(图3c)。外源性IL-10的添加也增加了HER2 CAR-T细胞的基础OCR(图3b)。IL-10-Fc通过MPC(线粒体丙酮酸载体)在终末耗竭CD8+TIL中促进氧化磷酸化(OXPHOS)。通过使用MPC抑制剂UK5099阻断丙酮酸转运可以完全消除IL-10 HER2 CAR-T细胞中OXPHOS的增加(图3d)。IL-10 HER2 CAR-T细胞与MC38-HER2细胞共培养时,与HER2 CAR-T细胞相比,IL-10 HER2 CAR-T细胞的靶细胞增殖、多功能性和杀伤效率显著增强(图3e-g)。使用Mpc1敲除(Mpc1KO)T细胞生成IL-10 HER2 CAR-T细胞,与野生型(WT)T细胞生成的IL-10 HER2 CAR-T细胞相比,IL-10 HER2 CAR-T细胞表现出累积的功能失调线粒体频率增加,OCR与ECAR比值降低(图3h-j)。此外,与WT IL-10 HER2 CAR-T细胞相比,Mpc1KO IL-10 HER2 CAR-T细胞未能诱导改善的增殖、多功能或肿瘤细胞杀伤能力(图3k-m)。总的来说,IL-10的表达以MPC依赖的方式促进CAR-T细胞的OXPHOS代谢。
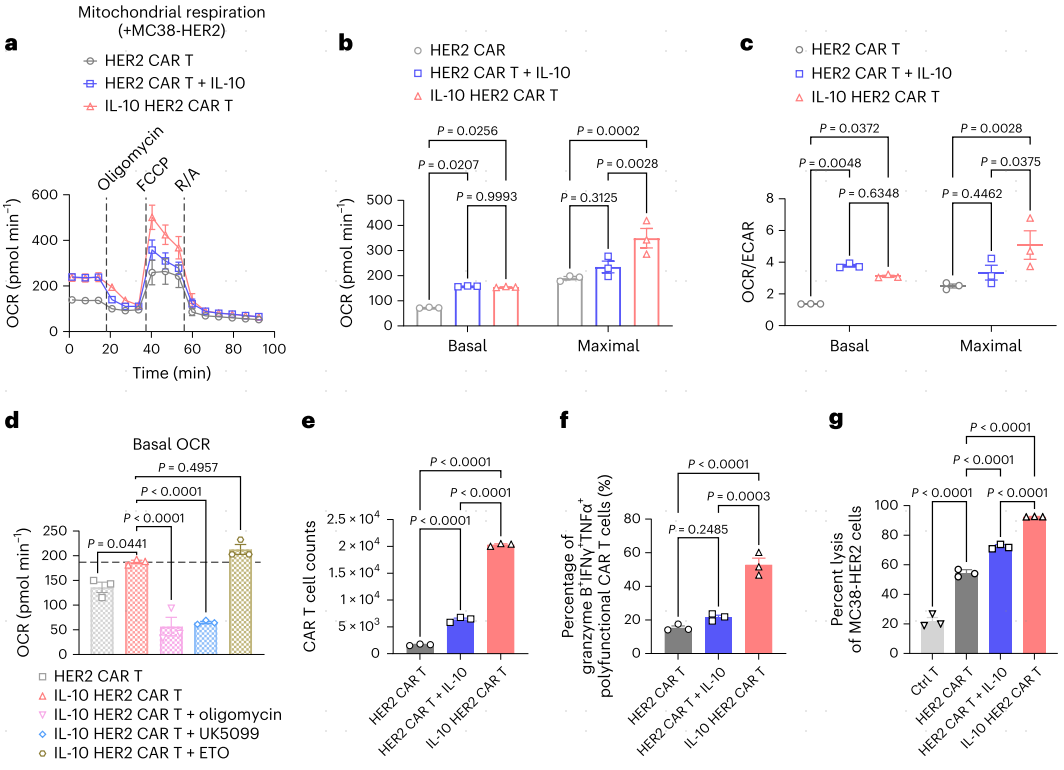
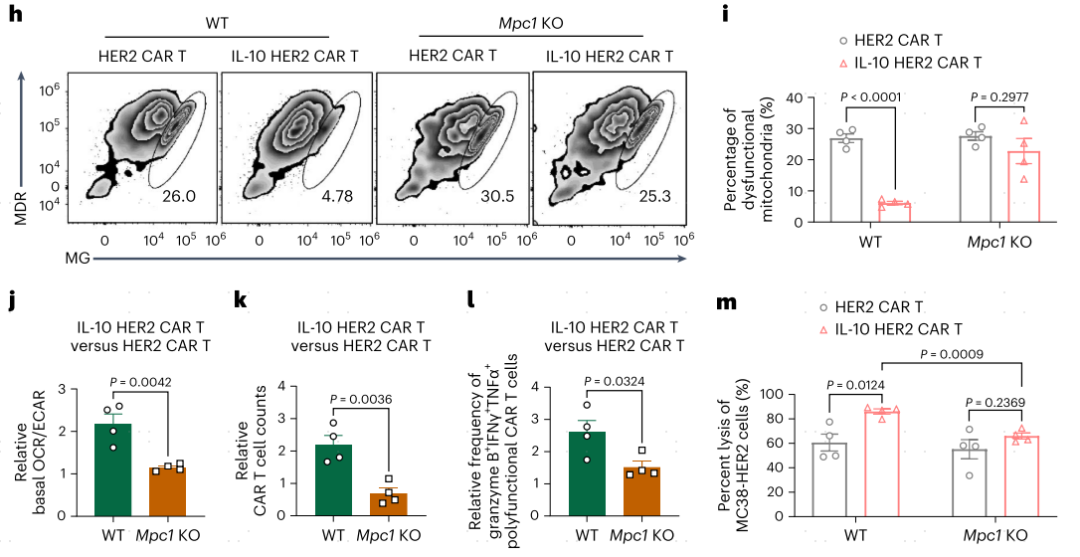
图3 IL-10以MPC依赖的方式增强CAR-T细胞中的OXPHOS
4、IL-10的表达改变了CAR-T细胞的转录,有助于恢复耗竭CAR-T细胞活性
为了在转录水平上研究IL-10表达对TME中CAR-T细胞命运的影响,作者对MC38-HER2肿瘤中的HER2 CAR-T细胞或IL-10 HER2 CAR-T细胞进行了单细胞转录组测序(scRNA-seq)分析。在无监督聚类之后,根据基因表达谱识别出四个cluster(图4a)。值得注意的是,cluster1主要富集在IL-10 HER2 CAR-T细胞中,而HER2 CAR-T细胞主要富集在cluster0中(图4b,c)。与cluster0相比,cluster1的细胞毒性和效应分子Gzmb、Gzmc、Prf1、Gzmf和Ifng以及转录因子Jun、Junb和Fos的表达均高于cluster0(图4d,e)。GSEA富集分析表明,cluster1与线粒体OXPHOS密切相关(图4f)。IL-10-Fc通过丙酮酸增强线粒体呼吸,因此cluster1比cluster0显示了更丰富的丙酮酸代谢途径(图4f)。此外,与细胞增殖和循环基因高表达水平相关的cluster2(图4d)也在IL-10 HER2 CAR-T细胞中富集(图4a-c),表明IL-10 HER2 CAR-T细胞具有更高的增殖能力。这些结果表明IL-10表达使耗竭CAR-T细胞恢复活力,维持细胞毒性增强、效应功能和增殖能力增强的状态,这与线粒体OXPHOS的代谢重编程有关。
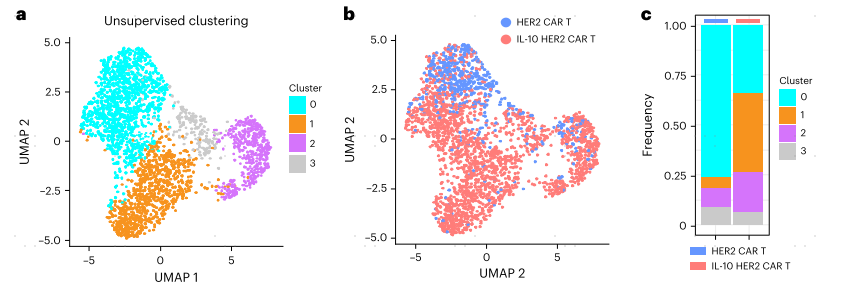
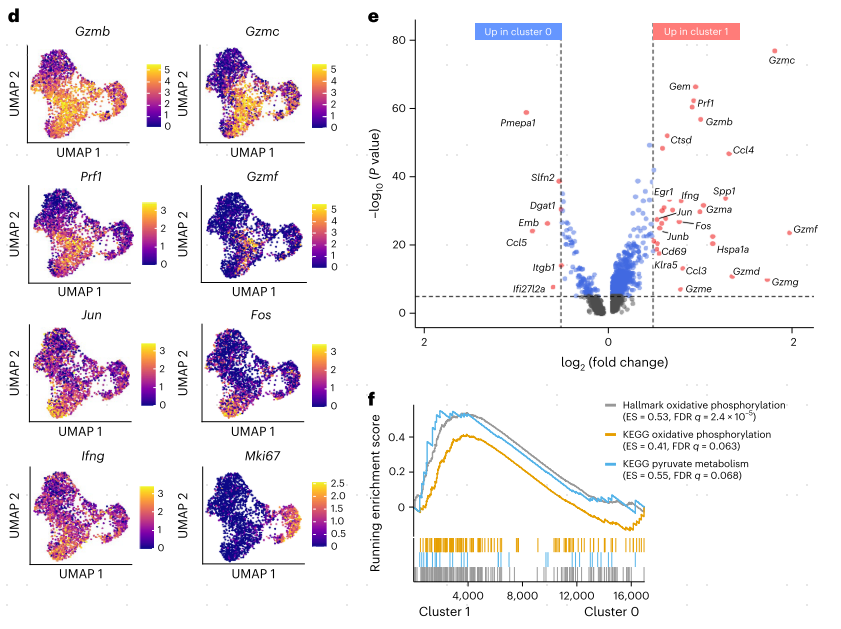
图4 IL-10的表达调节CAR-T细胞的转录,增强细胞毒性,增殖和线粒体OXPHOS
5、IL-10 CAR-T细胞可实现100%根除实体瘤原发灶和转移灶
在预先建立的MC38-HER2肿瘤治疗环境中,IL-10 HER2 CAR-T细胞过继在90%的治疗小鼠中诱导实体肿瘤完全消退和持久治愈(图5a-c)。相比之下,HER2 CAR-T细胞单独或联合单次或多次静脉注射本地IL-10可暂时控制肿瘤生长,但未能诱导任何持久的肿瘤消退。为了治疗免疫原性差和高度侵袭性的小鼠B16F10黑色素瘤肿瘤,作者通过静脉给药过继IL-10 TRP-1 CAR-T细胞,在没有体重下降的情况下,使下肿瘤模型的肿瘤清除率和疗效达到60%(图5a,d,e)。作者进一步制备了表皮生长因子受体变异III(EGFRvIII)-靶向IL-10表达的CAR-T细胞来评估IL10表达的CAR-T细胞是否可以控制转移性癌症。为了建立转移样肿瘤模型,BALB/c小鼠静脉注射4T1-EGFRvIII-Luc细胞。对肺部出现转移性结节的小鼠进行亚低温淋巴去势,然后单独或在输注IL-10或IL-10 EGFRvIII CAR T细胞的支持下接受EGFRvIII CAR T细胞过继(图5a),通过生物发光成像监测肿瘤生长(图5f)。值得注意的是,IL-10 EGFRvIII CAR-T细胞表现出了卓越的抗转移活性,并导致了100%的治疗小鼠的持久治愈,而IL-10输注或不输注EGFRvIII CAR-T细胞只显示了适度的肿瘤负担控制(图5f-h)。
带有皮下Raji或PANC1-CD19肿瘤的免疫缺陷小鼠中,过继常规CD19 hCAR T细胞分别导致最小或短暂的肿瘤生长抑制,但最终未能控制肿瘤进展(图5i-l),相比之下,所有使用IL10表达的CD19 hCAR T细胞治疗的小鼠在两种模型中均表现出完全的肿瘤消退,无复发(图5i-l)。这表明IL-10表达的hCAR T细胞在异种移植模型中对实体瘤具有更强的抗肿瘤能力。
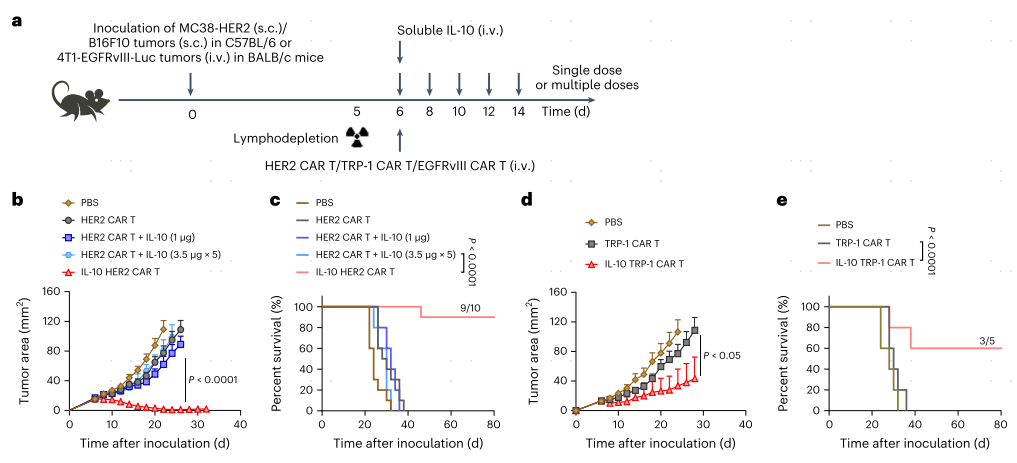
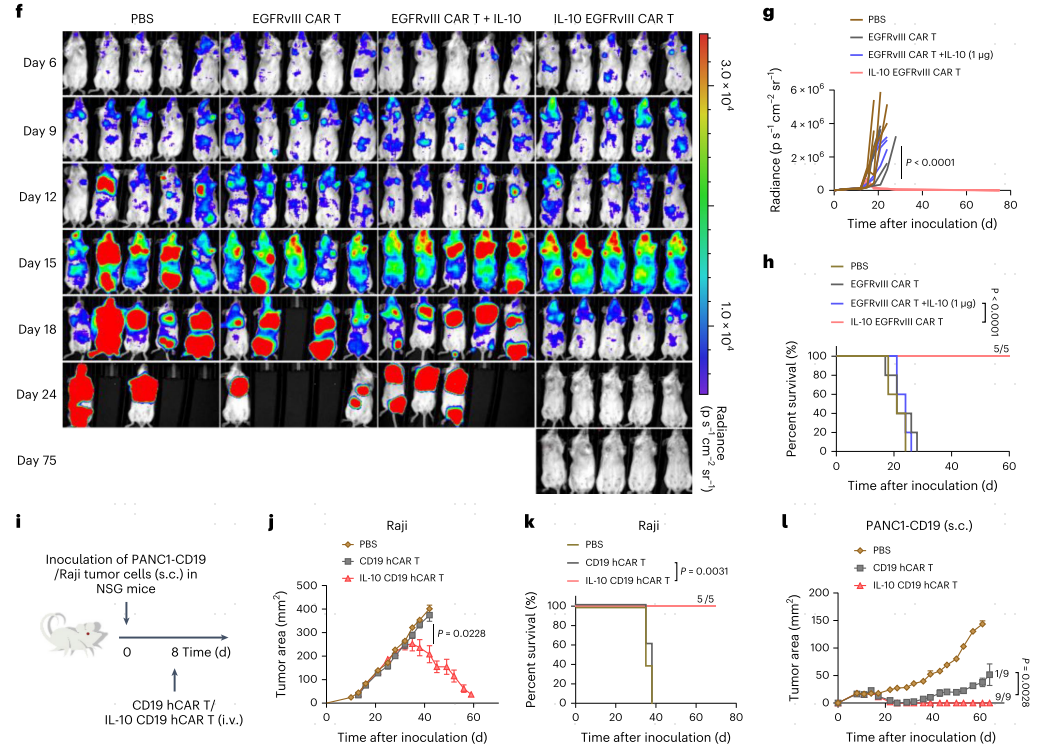
图5 在多种同基因和异种移植模型中,IL-10 CAR-T细胞输注介导实体肿瘤清除
6、IL-10表达通过诱导干细胞样记忆抵御肿瘤复发
为了研究IL-10表达的CAR-T细胞是否发展了抗肿瘤免疫记忆,作者在过继CAR-T细胞移植3个月后再次刺激存活的小鼠。所有使用IL-10 HER2 CAR-T细胞、IL-10 TRP-1 CAR-T细胞或IL-10 EGFRvIII CAR-T细胞治疗的长期幸存小鼠都抵抗住了原始肿瘤细胞的第二次挑战(图6a-c)。因此作者检测了淋巴组织和循环系统中IL10表达的CAR-T细胞的记忆表型(图6d)。治疗后12天的CAR-T细胞(最初过继的CAR-T细胞均为CD44hi)的流式细胞术分析显示IL-10 HER2 CAR-T细胞在脾脏和外周血中富集具有Tscm细胞表型(定义为CD62Lhi CD44lo和Sca-1+CD122+)(图6e,f)。脾脏IL-10 HER2 CAR-T细胞显示CD62Lhi CD44lo T细胞的频率比单独的HER2 CAR-T细胞高约3.2倍,其中大多数(约71.2%)是Sca-1+CD122+ Tscm细胞(图6e,f)。此外,在所有CD62Lhi CD44lo CAR-T细胞中,IL-10 HER2 CAR-T细胞显示了显著增加的Sca-1表达水平,相比于单独的HER2 CAR-T细胞或HER2 CAR-T细胞加外源IL-10(图6g)。IL-10 HER2 CAR-T细胞由脾脏和血液中IL-7Rα+KLRG1−长寿命记忆前体T细胞组成比例分别比HER2 CAR-T细胞高3.7和2.6倍,进一步证实了这一发现(图6h)。脾IL-10 HER2 CAR-T细胞表现出明确的“Stemness/Memory”(干性/记忆性)转录组状态(由小鼠Sell、Tcf7、Lef1、Il7r和Ccr7鉴定),并高度富集Tscm细胞相关基因,包括Id2、Ly6a、Cxcr3、Eomes和Bcl2(图6i、j)。GEXSCOPE® single cell RNA sequencing实验证实,脾脏中IL-10 CD19 hCAR T细胞具有“Stemness/Memory”(由人类TCF7、CCR7、LEF1和SELL鉴定)基因标记的细胞比例明显更高,并表达更高水平的Tscm细胞相关基因,包括IL7R和CXCR3,比传统的CD19 hCAR T细胞(图6k-n)。这些结果证明IL-10信号转导可能诱导小鼠和人类Tscm CAR-T细胞的形成,有助于长期抗肿瘤免疫。
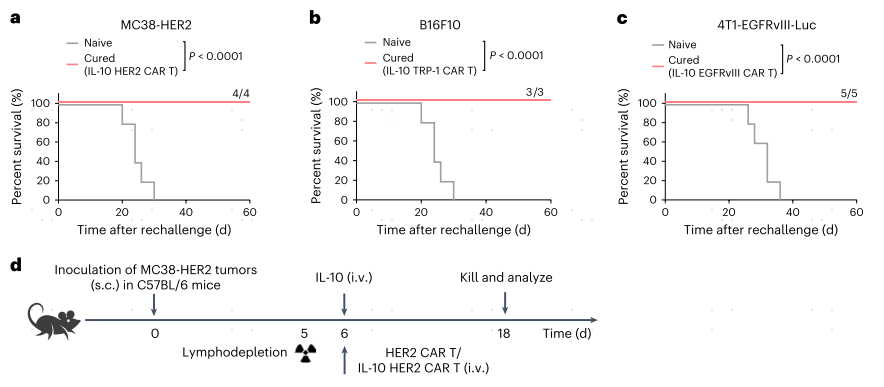
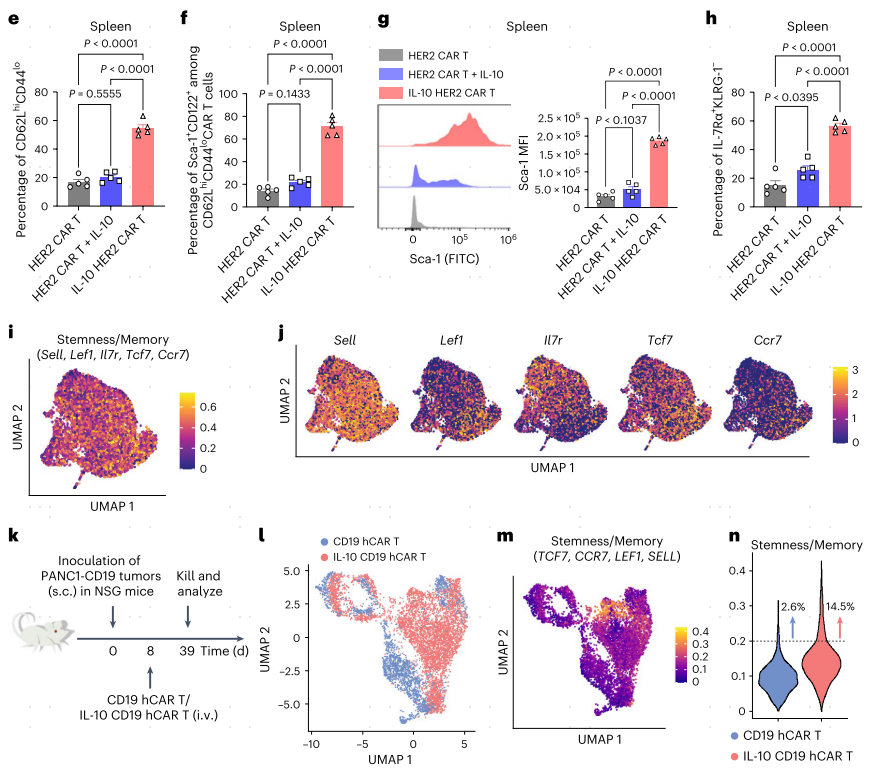
图6 IL-10表达的CAR-T细胞提供了对肿瘤再挑战的记忆反应,并在淋巴细胞中表现出干细胞样记忆表型
结论
在TME中,表达IL-10的CAR-T细胞可以防止与T细胞衰竭相关的功能损伤,增强增殖能力和效应功能。IL-10的表达以线粒体丙酮酸载体(MPC)依赖的方式改善了CAR-T细胞的线粒体适合度并增加了OXPHOS。注射小鼠和人源表达IL-10的CAR-T细胞,分别根除了多个同种和异种移植小鼠模型中建立的实体瘤,并诱导干细胞样记忆细胞(Tscm cell)来控制肿瘤复发。代谢装甲CAR-T细胞是一种很有前途的治疗策略,可以对抗T细胞耗竭相关的功能障碍,并诱导有效和长期的抗肿瘤免疫。
参考文献
Yang Zhao, Jiangqing Chen, Massimo Andreatta,et al.IL-10-expressing CAR T cells resist dysfunction and mediate durable clearance of solid tumors and metastases.Nat Biotechnol. 2024 Jan 2. doi: 10.1038/s41587-023-02060-8. Online ahead of print.








