项目文章 | 单细胞绘制间质多脏器结直肠癌的谱系与位置依赖细胞景观
发布时间:2024-01-23 10:00:05
2023年12月,德国弗赖堡大学Philipp A Holzner 教授在The Journal of Clinical Investigation上发表“Single-cell deconvolution reveals high lineage- and location-dependent heterogeneity in mesenchymal multivisceral stage IV colorectal cancer”的研究文章。该研究通过单细胞转录组技术研究了来自小鼠多脏器结直肠癌样本,发现免疫检查点抑制剂可重建腹膜瘤的效应T细胞的功能,为IV期结直肠癌提供了一种有利的位置特异性免疫调节治疗方法。
新格元在该研究中提供GEXSCOPE®单细胞转录组测序服务。
下面和元小新一起来看看吧~
研究背景
转移性结直肠癌(CRC)与预后不良和疾病进展迅速有关。除肝转移外,腹膜癌是IV期CRC患者的主要死亡原因,最常发生在CRC的间质亚型中,与共识中得分子亚型CMS4相似。CMS4分子亚型的特点是生存率最低,约占CRC患者得1/4,并表现出免疫耐受、炎症性微环境的特征。而对不同位置肿瘤细胞以及相应微环境的解析,仍缺乏相应研究。迫切需要了解结直肠癌转移到不同转移部位的分子景观及细胞景观。
研究结果
1.小鼠原发性结直肠癌、肝转移和腹膜癌的独特细胞及功能景观
为了阐明多脏器CRC的细胞景观,通过scRNA-seq分析了原发灶(PT)、肝转移(LM)和腹膜转移(PM)样本中的细胞。注释得到6种大类细胞类型,包括肿瘤细胞、B细胞、T细胞、髓系细胞、肿瘤相关成纤维细胞(CAF)和内皮细胞。
转移灶(LM和PM)的细胞组成和原发灶PT有很大的不同:髓系细胞在LM和PM中都占比增加,而B细胞和T细胞在LM中占比降低,在PC中T、B细胞则几乎完全被排除。同时,在PC中CAF占比最高,在LM转移中内皮细胞占比增多。通过CD45和PDGFRB免疫组化验证,同样证实了转移组织中免疫细胞浸润的减少和腹膜瘤中基质细胞的增加。
对于上皮细胞进一步细分鉴定出四个亚群:肿瘤干细胞(CSC、Lgr5+和Prom1+)、循环祖细胞(CP,Prom1+和Ccnd1+),由于CP同时表达干细胞marker,因此CSC和CP细胞定义为STEM区室。高度增殖的细胞定义为TA细胞(Mki67+)。分化细胞(DIFF)表现出Krt20的高表达。这些上皮亚群的分布模式具有肿瘤位置特异性:DIFF亚群是原发灶中最大的细胞群,增殖性的TA则在两个转移部位占主导地位。且在CRC转移时,观察到了肿瘤干细胞的失调。
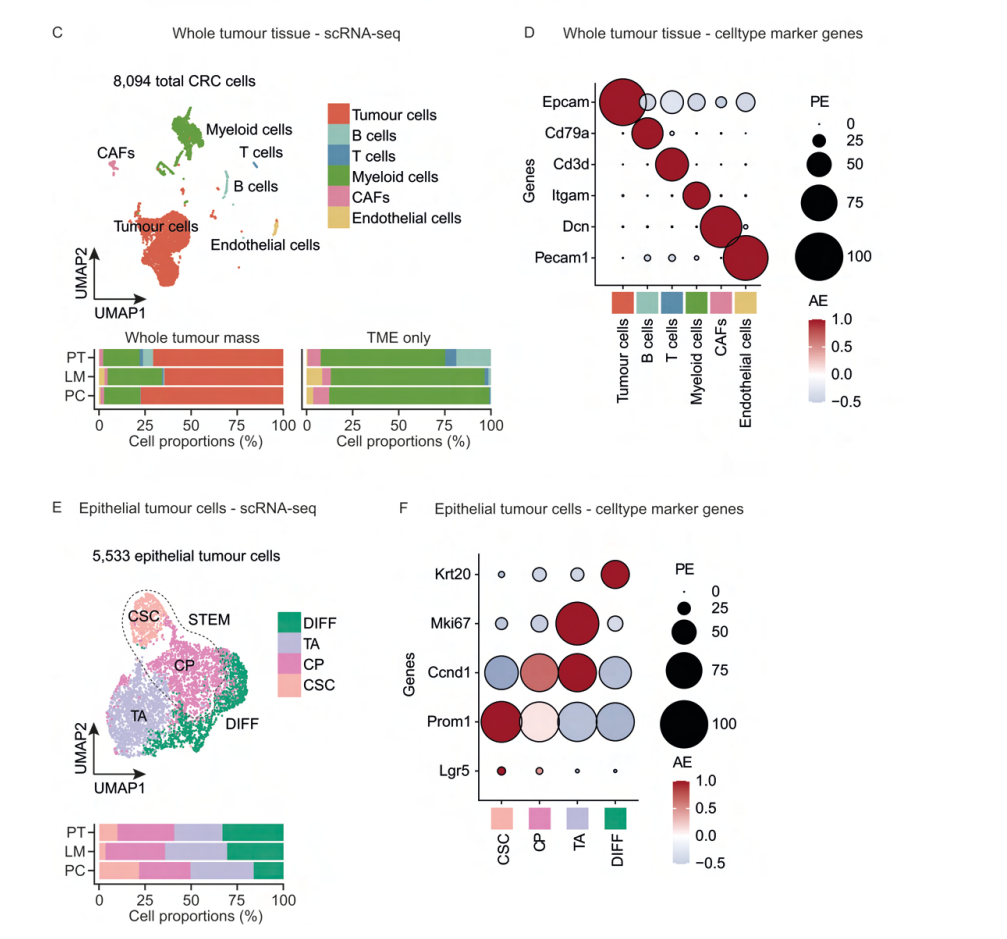
图1 小鼠原发性结直肠癌、肝转移和腹膜转移的细胞与功能景观
2.肿瘤干性区室(STEM)的位置特异性代谢重编程
根据结直肠癌的内在上皮状态,将恶性细胞分为iCMS2和iCMS3两种亚型,细化CRC的分子分型。iCMS2基因在原发灶和腹膜转移瘤中表现出增强的表达,而iCMS3在肝转移中表达上调。因此将原发灶和腹膜转移瘤的上皮细胞定义为iCMS2,肝转移灶上皮细胞定义为iCMS3,代表了转移期间的上皮生态位特异性重编程。

图2 iCMS2和iCMS3基因集打分小提琴图
基于VISION的单细胞代谢分析揭示了肝转移灶和腹膜转移灶STEM细胞的独特表型:原发灶STEM细胞具有最高的氧化磷酸化特征,具有部分脂肪酸降解、糖酵解/糖异生特征,但在转移灶中以独特的方式进行代谢重编程。肝转移灶STEM在糖酵解/糖异生通路得分最高,而腹膜转移灶STEM则在脂肪酸降解具有最高的得分。由于脂质代谢与CSC维持相关,通过细胞互作进行了细胞和CSC特异性串扰的生态位分析。发现在腹膜转移灶中,CSC细胞到所有上皮细胞的传出信号强度都增加,包括胶原蛋白、骨桥蛋白、粘连蛋白和血小板反应蛋白信号传导增加,这些信号通路与去分化、干细胞支持和转移相关。

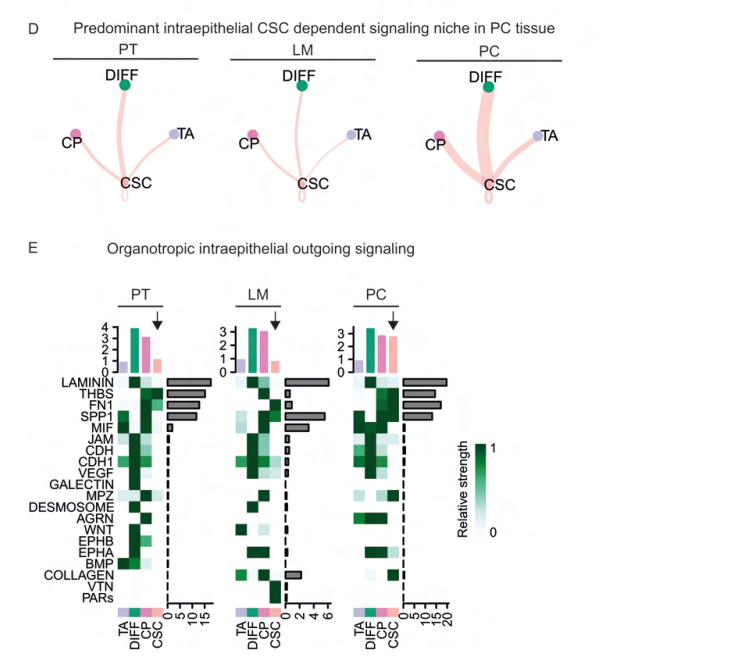
图3 多脏器CRC中干细胞区室的位置特异性代谢重编程
总的来说,证明了原发灶和转移灶细胞组成的位置异质性,此外也破译了肿瘤上皮的位置特异性iCMS和干细胞的代谢重编程。说明间质结直肠癌在多脏器转移过程中存在位点特异性性环境适应。
3.成纤维细胞在结直肠癌转移过程中的差异
CRC肿瘤微环境中,CAF极化为炎症表型(iCAF)与预后不良相关,通过支持免疫逃逸和促进肿瘤细胞的侵袭能力驱动治疗耐药和转移。GSEA分析表明cluster2的炎症相关基因上调,定义为iCAF,cluster1为肌成纤维细胞(myCAF)。iCAF主要存在于腹膜瘤中,而表征抗原递呈CAF(apCAF)基因表达减少,主要参与实体瘤免疫细胞的归巢和激活,包括H2-Ab1、H2-Aa和Cd74。基于细胞通讯,作者发现腹膜瘤中CAF和肿瘤细胞的互作增加,且CAF为主要的发送者。差异共表达分析发现腹膜瘤中CAF和肿瘤细胞之间的互作对过表达,表明细胞间通讯增加。互作对Lamb1/Cd44可驱动CRC的转移能力,并通过上调干细胞支持途径来支持瘤内CSC功能。CAF的位点特异性重编程与腹膜瘤中CSC数量的增加一致。表明腹膜瘤中的CAF通过直接支持CSC的存活来支持上皮生态位。
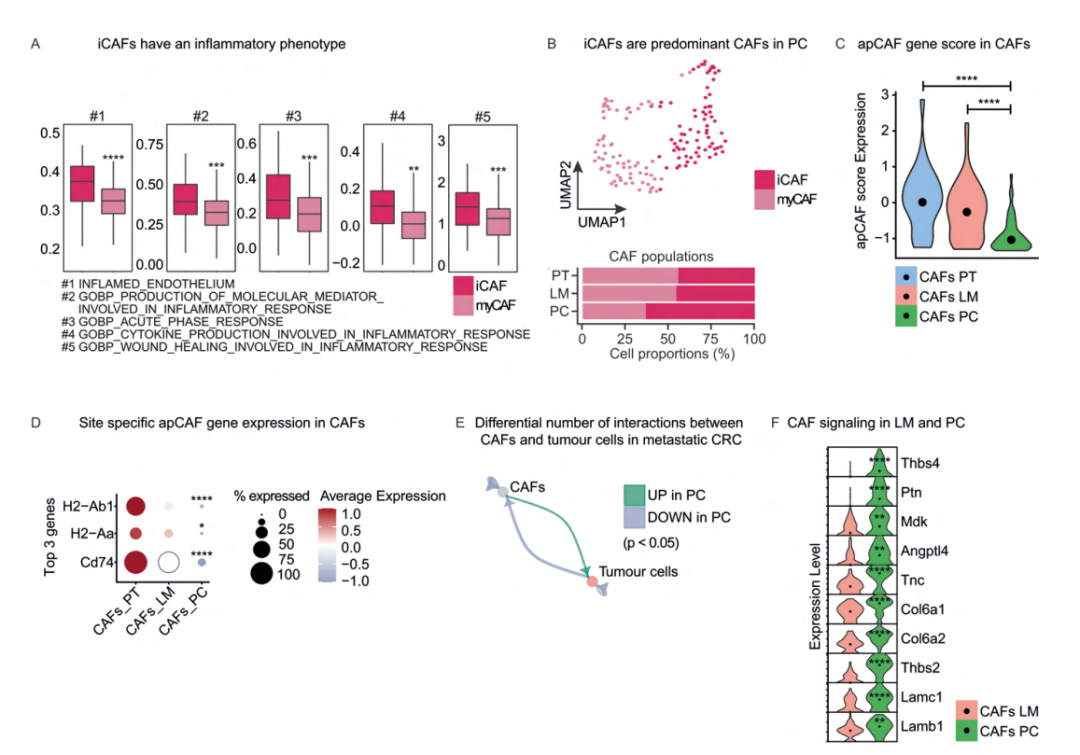
图4 结直肠癌转移过程中成纤维细胞动力学的转移间差异
4、转移性CRC中内皮细胞的位置特异性功能
对转移性内皮细胞进行GSEA分析,与肝转移灶相比,腹膜瘤内皮细胞具有上调的炎症表型。差异基因分析同样发现上调表达的基因包括:Lamb1、Itpr1、Hras、Fn1、Lamc1、Akt1、Nras和Nfkbia。进一步进行抗原递呈和血管生成的基因集打分,发现PC内皮细胞抗原递呈能力丧失,同时血管生成功能增强,表明局部免疫刺激减弱,血管形成增加,以支持腹膜瘤的生长。
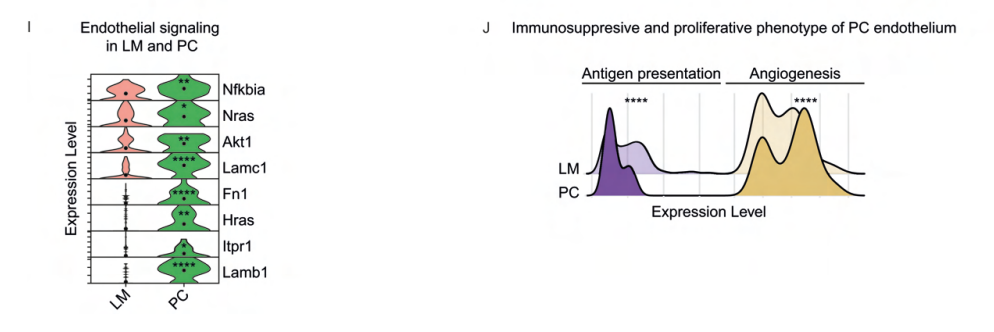
图5 结直肠癌转移过程中内皮细胞动力学的转移间差异
5、CRC疾病进展期间的位置特异性抗肿瘤免疫
由于腹膜转移瘤的适应性免疫细胞大量减少,通过流式分选了不同位置的CD45+CD11b-浸润细胞。共得到15714个细胞,包括B细胞、T细胞、NK细胞和肥大细胞。肥大细胞丰度较低,在原发灶占主导地位,NK细胞在肝转移灶占主导地位。为了从分子角度更好的理解T细胞和NK细胞亚型的代谢重编程,对T和NK细胞群进行了基于VISION的代谢评分。氧化磷酸化可能与肿瘤中终末耗竭T细胞和功能障碍有关,同时也会促进NKT和NK细胞的活性。在耗竭CD8+T细胞中观察到最高水平的氧化磷酸化评分,且与原发灶相比,两个转移灶的T和NK细胞的评分均有所增加。虽然转移灶中潜在的抗肿瘤免疫细胞(如细胞毒性CD8T细胞)的数量增加,但腹膜癌中T细胞耗竭标记物上调和T细胞激活标记物的下调。这一结果与腹膜癌中氧化磷酸化基因的升高一致。此外,作者也分析了NK细胞脱颗粒的表达特征,发现脱颗粒基因Gzmb和Prf1在转移瘤中表达量更高,表明细胞毒性增加,肝转移灶和腹膜转移灶中抗肿瘤免疫细胞的功能失调和代谢重编程,以及各自病变中浸润性NK细胞的细胞毒性功能增强。
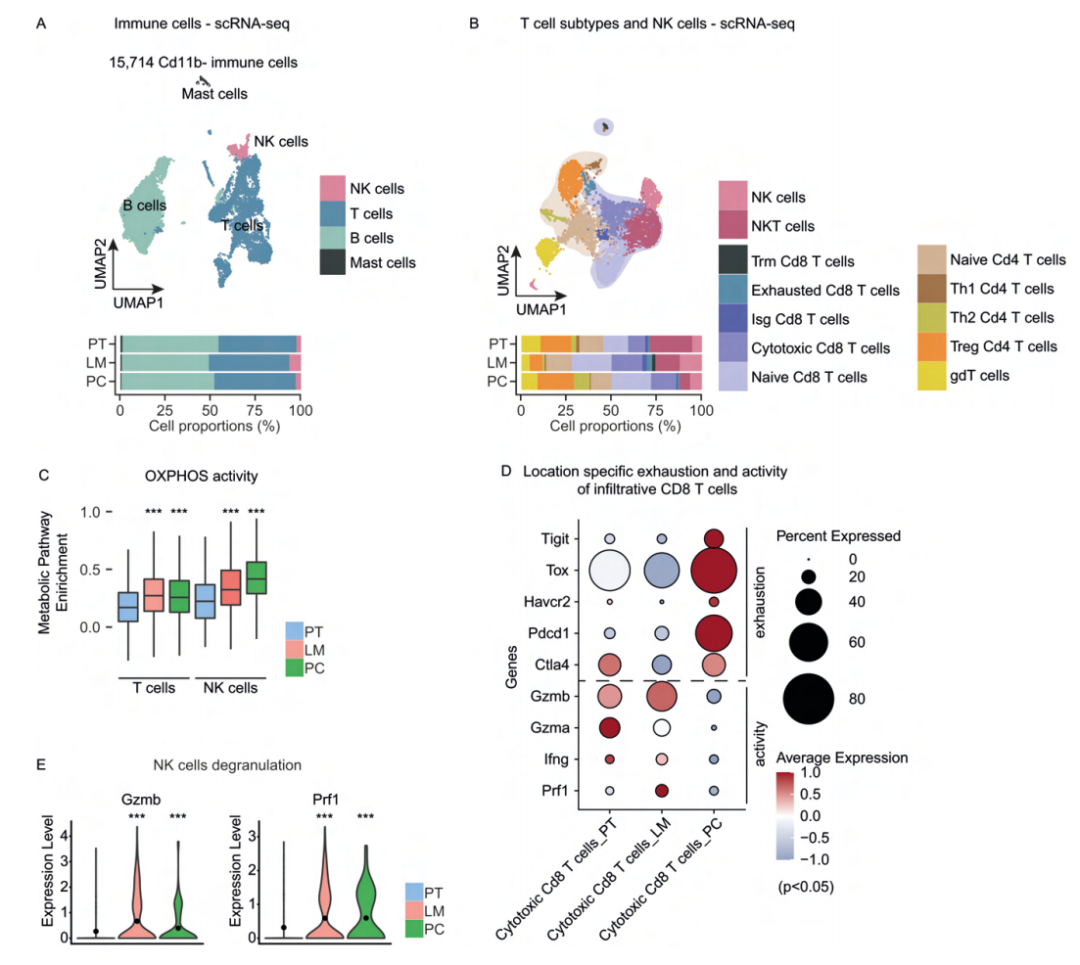
图6 结直肠癌转移过程中的位置特异性抗肿瘤免疫
6、转移性结直肠癌中B细胞适应性免疫分子特征
T细胞毒性产生的先决条件是T细胞和B细胞在抗体产生和抗原呈递中的微妙的协同作用。为了分析不同位置的B细胞功能及T、B细胞相互作用,进一步对B细胞进行了亚群细分:包括不通过抗原引发的B细胞不同的成熟阶段:未成熟Cd24a+B细胞、Irf4+B细胞、Naïve Ccr7+B细胞,以及在抗原识别后启动的典型的B细胞亚群:记忆B细胞、IgM+浆细胞、IgG+浆细胞和CD38+IgG+浆细胞。为了破译B细胞潜在的抗原呈递功能,分析了B细胞和T细胞之间差异性的细胞互作情况。将肝转移灶和腹膜转移灶合并称为MET进行后续分析。有意思的是,与原发灶B细胞相比,MET B细胞亚型的传出细胞信号传导均有所减少,表明在转移灶中B细胞功能发生了改变。进一步进行差异通路分析发现MET B细胞和T细胞中的MHC II信号通路下调,意味着MHC II依赖性抗原递呈减少,同时伴随着PD-L1通路的激活。
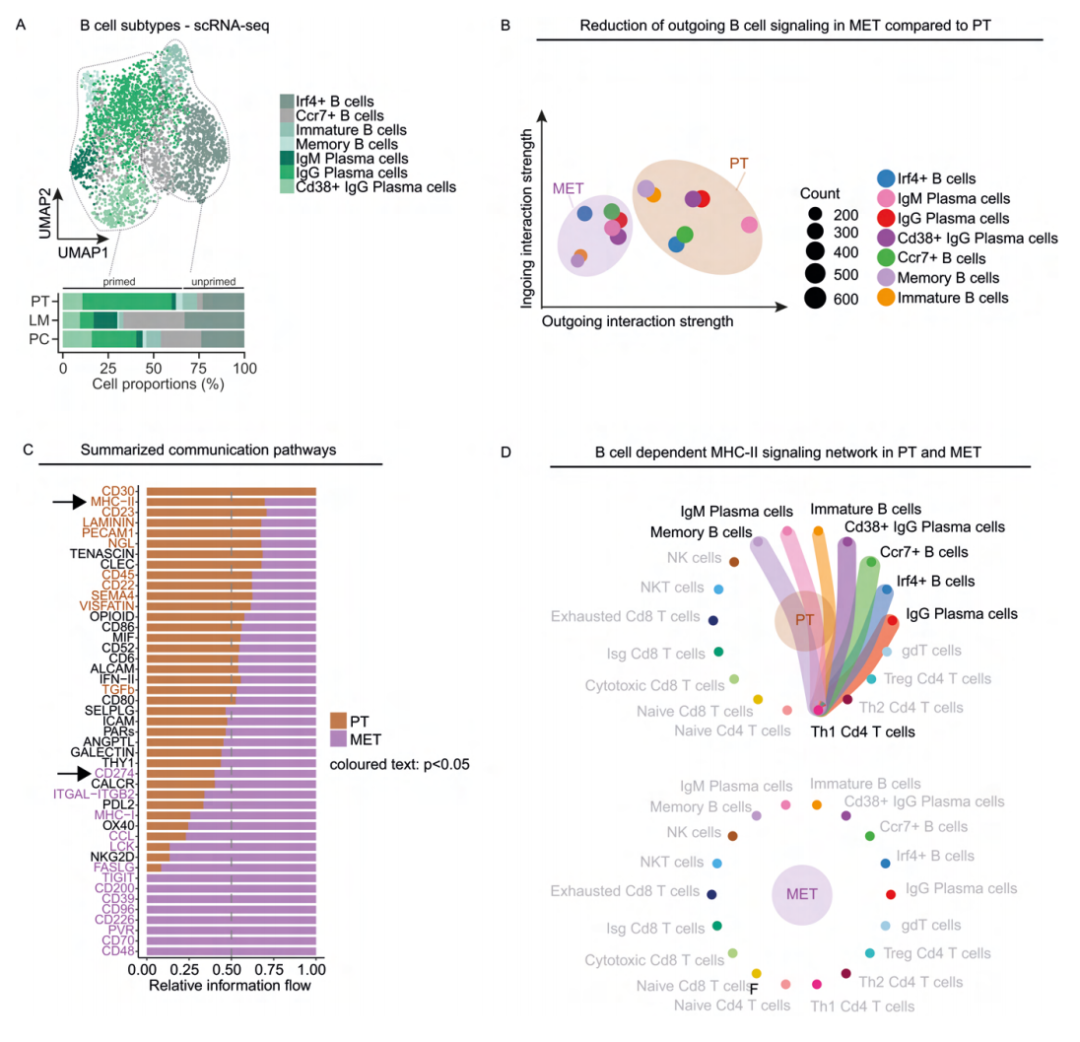
图7 转移性结直肠癌中的B细胞网络受损
7、小鼠多脏器APTKA CRC模拟人类IV期结直肠癌
接下来测试了小鼠的多脏器APTKA CRC是否可模拟人类IV期结直肠癌。为了分析转录相似性,使用了已发表的来自人类患者的原性肿瘤(hPT)和腹膜癌(hPC)与原发肿瘤(hPT)和肝转移(hLM)的数据,与从小鼠中获得的三个原发性肿瘤(mPT)、四个肝转移癌(mLM)和三个腹膜癌(mPC)的数据相结合。为了消除物种特异性差异,进行了批量矫正PCA,发现mPT和hPT以及mLM和hLM的肿瘤位置特异性聚类。通过MCP-count反卷积算法,分析了小鼠和人类样本中肿瘤微环境中各类细胞丰度。小鼠和人类样本肝转移灶中巨噬细胞、B细胞和T细胞的比例相当,细胞毒性得评分也相似。PCA和MCP-counter分析也具有高度一致性。小鼠组织中GSEA分析表明腹膜癌中参与EMT的基因上调,hPC中涉及EMT的基因富集。同时发现小鼠和人类腹膜癌中EMT蛋白的表达量增加。
为了进一步了解这种EMT标志物表达增加的细胞起源,对小鼠和人类样本进行了IHC。与scRNA-seq结果一致,在IHC中观察到腹膜瘤中上皮细胞减少与基质细胞显著增加。此外,VIM和ZEB1的表达主要在基质细胞中发现。根据HPF对VIM+和ZEB1+细胞进行定量分析,发现小鼠和人PC中两种marker均显著增加。结果描绘了小鼠肝转移和腹膜转移与人类肝转移灶和腹膜转移基质细胞表型的高度相似性,强调了APTKA多脏器CRC小鼠模型在进一步分子生物学研究中的应用潜力。
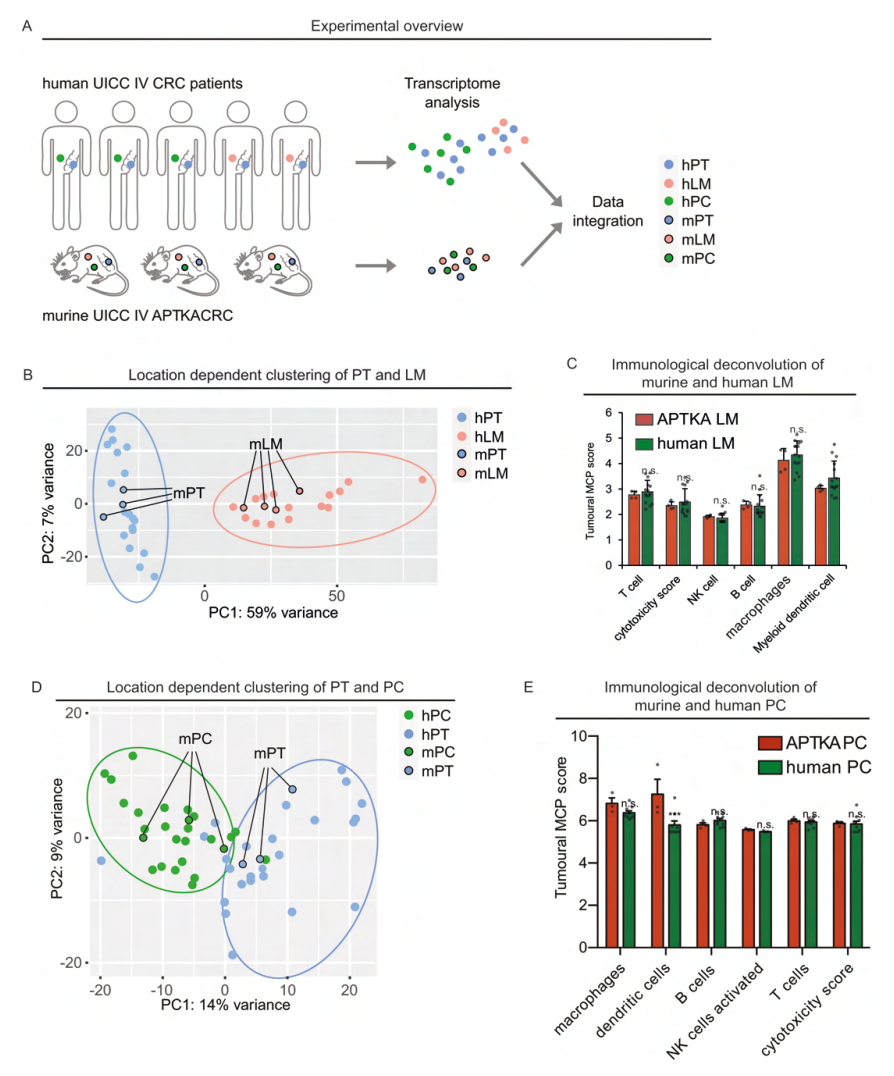
图8 小鼠多脏器APTKA结直肠癌模型模拟人类IV期CRC
8、腹膜瘤中应用免疫检查点抑制剂可重建PC中效应T细胞功能,并强调开发位置特异性个性化CRC治疗的重要性
迄今为止,肝转移中的免疫检查点阻断(ICB)仅对MSI高(微卫星不稳定性高)CRC有效。根据结果,抗PD1治疗应专门针对非MSI CRC的腹膜转移瘤进行评估。为了证明APTKA原位小鼠模型的转化潜力并验证数据,测试了通过抗PD1疗法进行CD8+ T细胞的位点特异性再激活。使用FACS分析浸润性CD8+效应T细胞的功能。发现PC组织中ICB治疗后PD1表达显著减少,脱颗粒标志物IFNg和PRF1增加,这表明位置依赖性治疗反应,因为PT和LM中的CD8+ T细胞并未被ICB显著激活(图9B)。然后使用FACS评估各个肿瘤部位上皮区室的特异性细胞死亡。发现在给予抗PD1后,PC肿瘤细胞区室中的细胞死亡显著上调,而PT和LM的肿瘤细胞不受影响(图9C)。为了进一步研究ICB对免疫学TME的空间重建,对B细胞和细胞毒性T细胞浸润(b220和CD8)进行了IHC。研究结果表明,在肿瘤中心(CT)以及侵袭性边缘(IM)进行抗PD1治疗后,CD8+ T细胞特别是在PC病变内的浸润增强,而在PT和LM中未观察到这种变化(图9D-E)。b220的定量显示B细胞浸润增加,尤其是在PC肿块的侵袭边缘,表明B细胞依赖性抗原呈递可能恢复。这些数据与scRNA-seq结果一致,PC中的CD8+ T细胞作为免疫调节的位置特异性靶标。进一步了解CRC转移的特定位置对于开发个体化和位置适应的治疗方法的重要性。
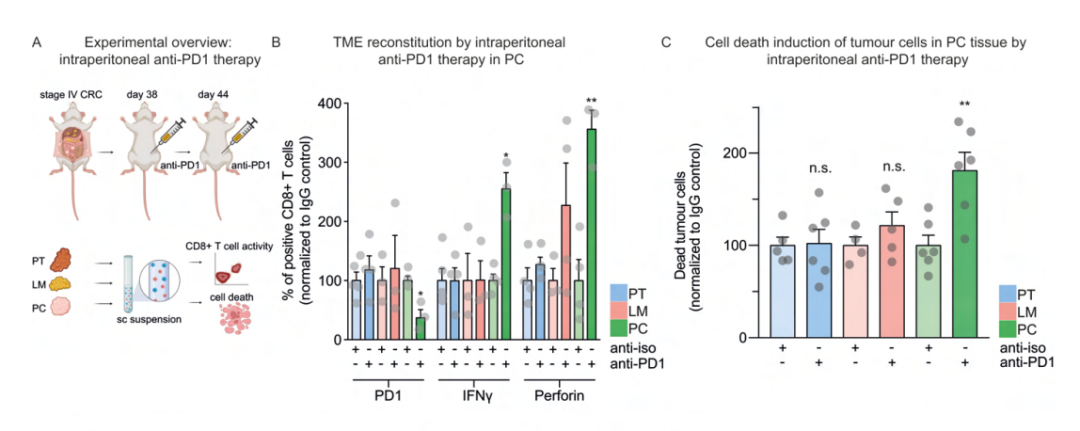
图9 腹膜瘤中应用免疫检查点抑制剂可重建PC中的效应T细胞功能
结论
本文展示了多脏器CRC的全面细胞和分子景观,并说明了肿瘤细胞和TME的特定位置依赖性重构。研究结果提供了对转移适应局部环境的复杂且多方面的景观过程,并确定耗竭效应CD8+ T细胞可作为潜在的PC特异性治疗靶点。
参考文献
Single-cell deconvolution reveals high lineage- and location-dependent heterogeneity in mesenchymal multivisceral stage IV colorectal cancer.The Journal of Clinical Investigation; IF:15.900; DOI: 10.1172/JCI169576
å








