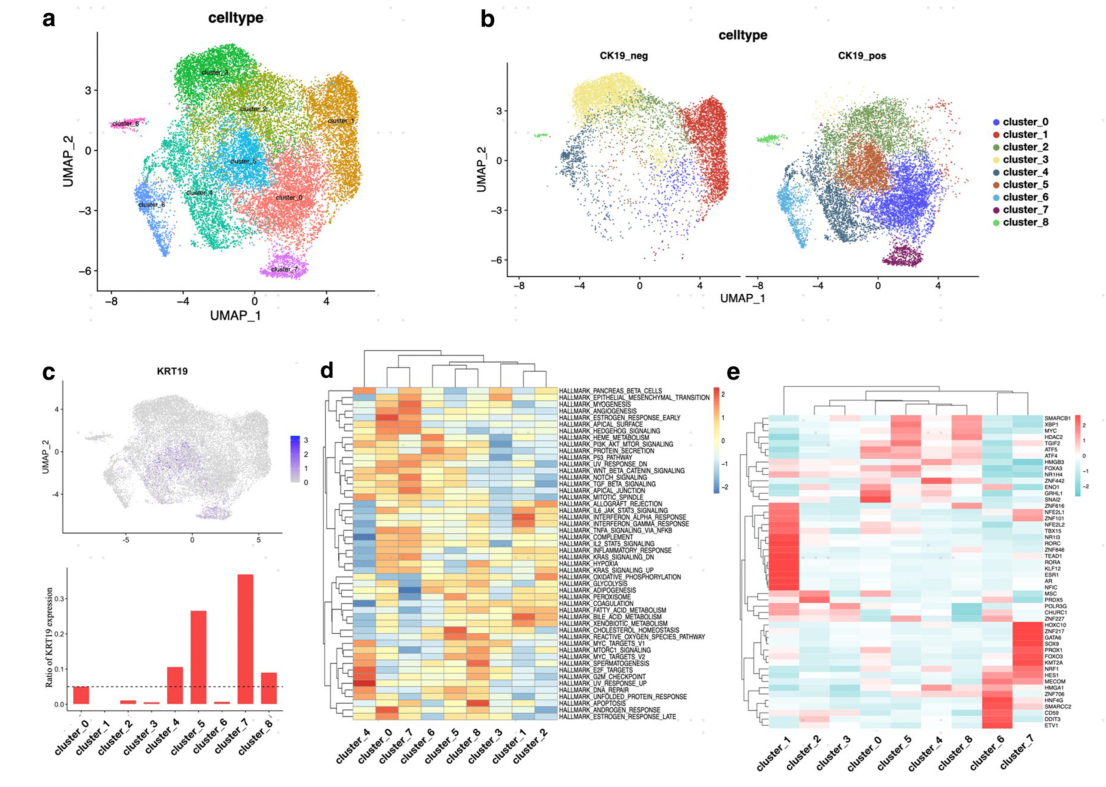
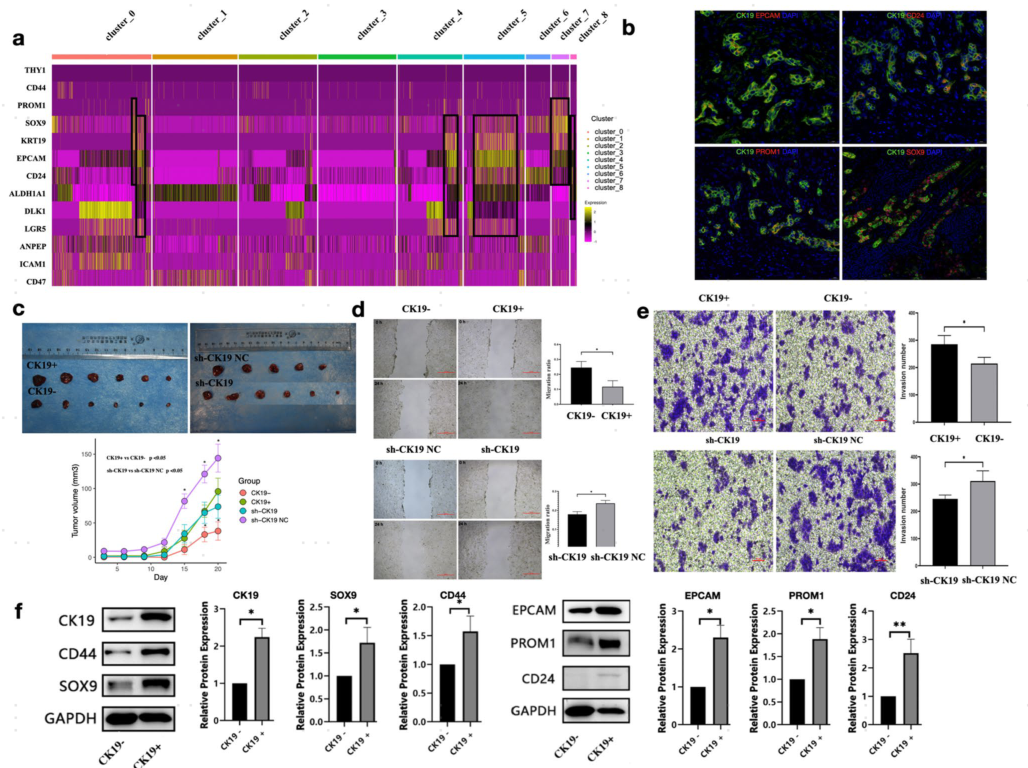
根据肿瘤干性标志物的表达,CK19+恶性细胞中干性标志物表达水平更高,其中 cluster_4、cluster_5、cluster_8和cluster_0具有相似的表达特征, cluster_7为另一种表达特征,这些群即为CK19+ CSCs(图3a)。采用多重免疫荧光染色(mIF)也验证了干性基因的共表达(图3b)。
进一步的细胞系实验表明,与CK19-Huh-7组相比,CK19+ Huh-7组在第18天和第20天的肿瘤体积显著增加 (图3c)。与sh-CK19 NC相比,sh-CK19-huh -7组在第15天、第18天和第20天的肿瘤体积显著减少(图3c)。与对照组相比,CK19 + Huh-7在创面愈合和Transwell侵袭实验中表现出更强的迁移和侵袭能力 (图3d,e)。CK19+ Huh-7组中CK19、SOX9、CD44、EPCAM、PROM1、CD24等6种干性生物标志物的蛋白表达水平显著升高 (图3f)。这些结果表明,CK19+恶性细胞具有较强的干性、迁移、侵袭和肿瘤形成特征。
图 3 CK19+ CSCs的干性特征
4、MMP9来源于TAM,是CK19+ HCC的枢纽基因
在验证队列1和TCGA队列中,对CK19基因的高、低表达水平进行DEG分析,加权基因共表达网络分析(WGCNA)获得了5个共表达基因模块(图4a)。蓝绿色模块与CK19基因及蛋白表达水平具有最高的相关性 (图4b)。在TCGA数据库中,从374例肝癌患者中筛选了74例HBV相关的HCC样本。分析CK19基因低表达组和高表达组的DEG,这些基因与蓝绿色模块中显示1009个共同的基因(图4c)。然后进行蛋白-蛋白相互作用(PPI)网络分析鉴定出MMP9、CXCL8、CCL2、TGFB1和TIMP1为核心基因(图4d)。在单细胞结果中表明CK19阳性HCC样本中,MMP9主要在髓源性细胞中显著高表达(图4f)。生存分析显示MMP9高表达的样本预后较差(图4g)。综上,具有蛋白水解活性的MMP9可能通过调节肿瘤细胞的血管生成、迁移、EMT和存活在肿瘤发生过程中发挥重要作用。
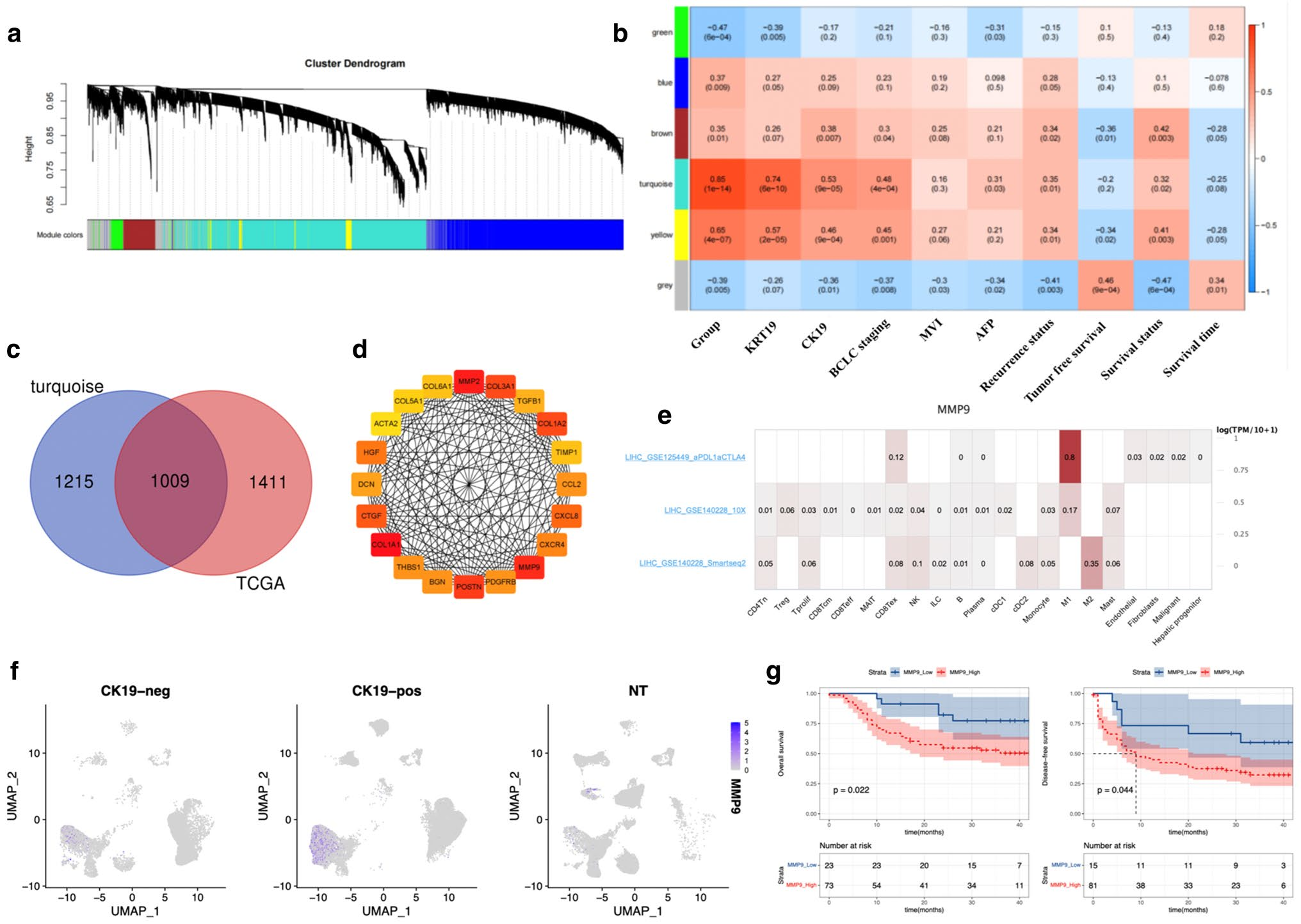
图 4 来源于TAM的MMP9作为CK19+ HCC的枢纽基因
5、TAM_SPP1高表达MMP9,在CK19+ HCC中特异性富集且有不良的预后
髓系来源细胞分为7类(图5a),其中TAM_SPP1在CK19+ HCC中显著富集(图5b)。在蛋白水平上使用mIF(图5d)得到证实。且MMP9主要表达于TAM_SPP1亚群(图5e)。与对照组相比,CK19+ Huh-7和sh-CK19-Huh-7细胞诱导的巨噬细胞中MMP9的表达水平分别显著升高和降低 (图5g)。这些结果进一步证明CK19+ CSC可能诱导巨噬细胞转化为TAM_SPP1,分泌MMP9。这表明TAM_SPP1生态位在CK19+ HCC的生物学行为中发挥了重要作用。验证队列1(图5h)和验证队列2(图5i)中TAM_SPP1高富集的患者生存期较短。提示TAM_SPP1可作为HCC患者预后不良的生物标志物。
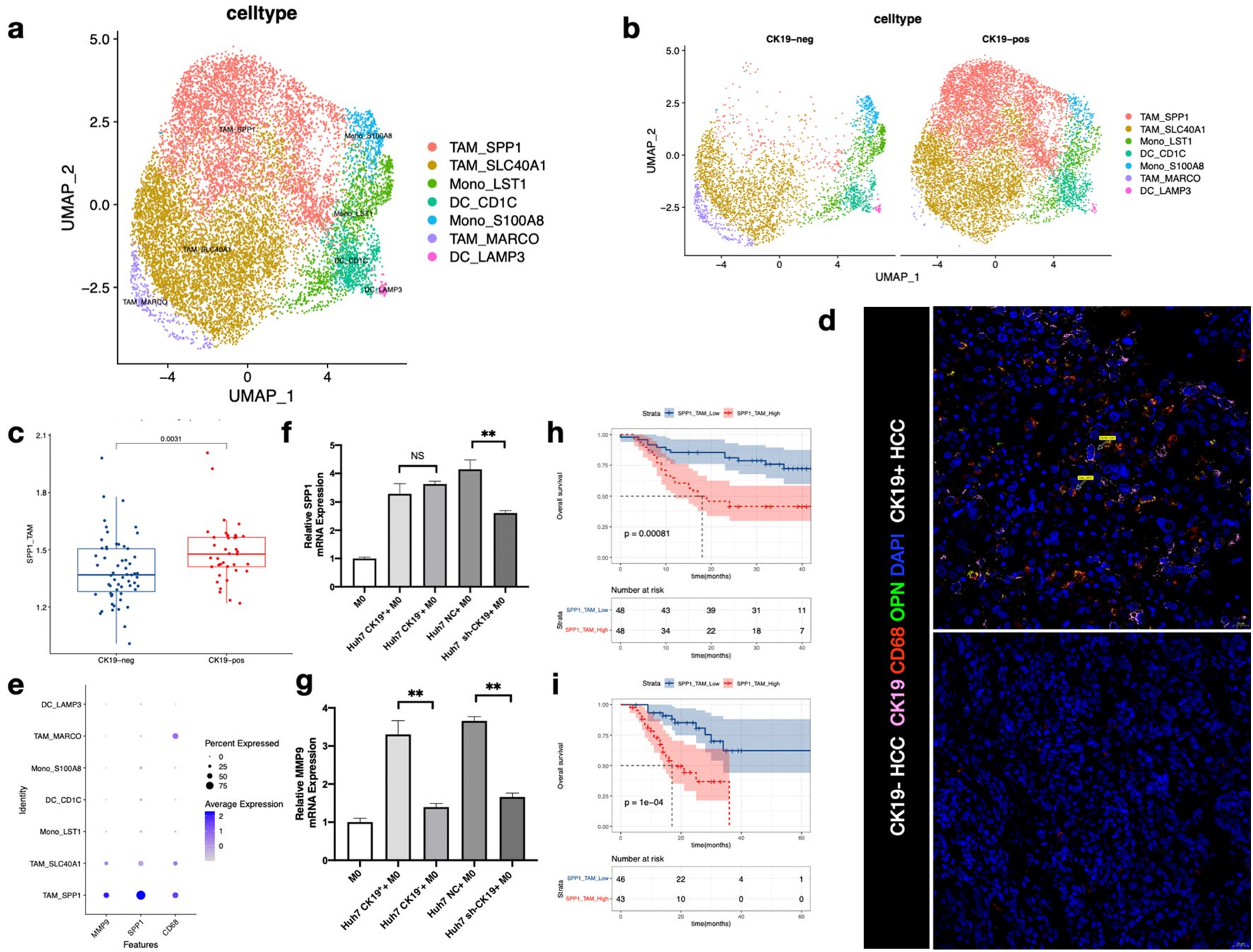
图5 TAM_SPP1高表达MMP9,在CK19+ HCC中特异性富集且有不良的预后
6、TAM_SPP1促进CK19+ HCC的侵袭转移
根据M1,M2特征基因表达发现TAM_SPP1是M2样巨噬细胞 (图6a, b), TAM_SPP1在CK19阳性HCC患者中具有更强的M2样特征(图6d)。CK19 + HCC患者TAM_SPP1的血管生成、EMT、缺氧和Kras信号通路被显著激活(图6e, f)。这些结果表明TAM_SPP1可能在肿瘤的侵袭和转移中起关键作用。临床数据进一步证明了它们促进转移的能力,在验证队列1中,与微血管侵袭(MVI)阴性HCC相比,TAM_SPP1在微血管侵袭(MVI)阳性HCC中显著富集(图6g)。血管侵袭与肿瘤复发密切相关,生存分析显示TAM_SPP1与肿瘤复发呈正相关。
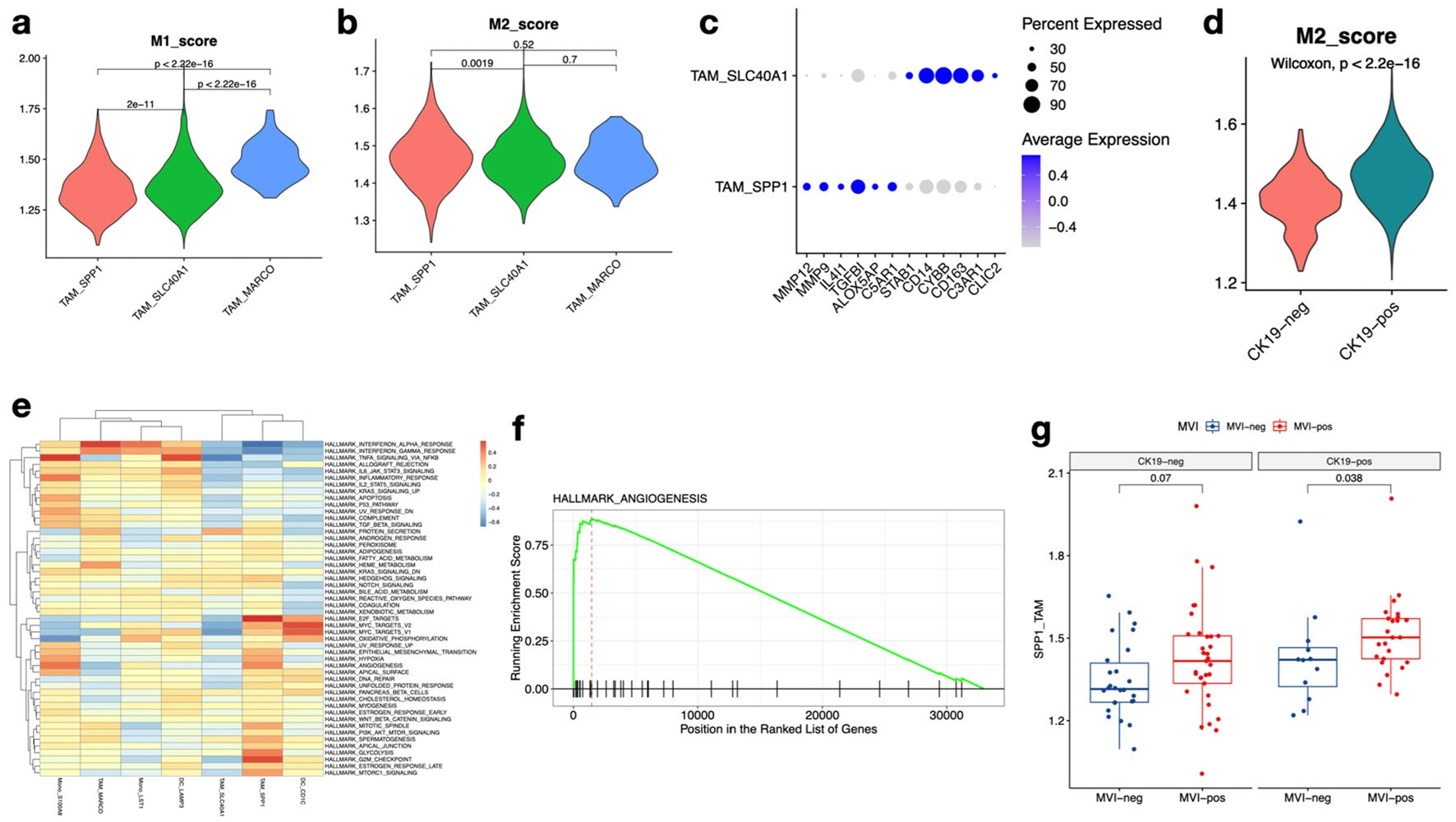
图6 SPP1阳性肿瘤相关巨噬细胞(TAM_SPP1)促进CK19+ HCC细胞的侵袭和转移
7、VEGFA信号通路促进了TAM_SPP1中MMP9的表达
CellphoneDB结果显示,在CK19+ HCC中,细胞相互作用明显高于对照组,这表明CK19+ HCC可能重编程并诱导TAM_SPP1呈现一定的功能状态。在CK19+ HCC中,肿瘤细胞可能通过VEGFA/FLT1与TAM_SPP1发生配体受体相互作用(图7b)。有趣的是,NicheNet分析预测出CK19阳性肿瘤细胞来源的VEGFA可以激活TAM_SPP1中的MMP9(图7c)。与CK19阳性组相比,在肿瘤细胞中,CK19阳性组的VEGFA表达水平更高(图7d),在TAM_SPP1中CK19阳性组的FLT1表达水平更高(图7e)。通过mIF实验进一步验证了这些观察结果 (图7f)。这些发现提示,VEGFA信号的激活可能促进TAM_SPP1细胞分泌MMP9,其可能在细胞外基质中发挥重要作用,促进肿瘤侵袭转移。这提示TAM_SPP1和MMP9可能作为HCC患者的有效治疗靶点。
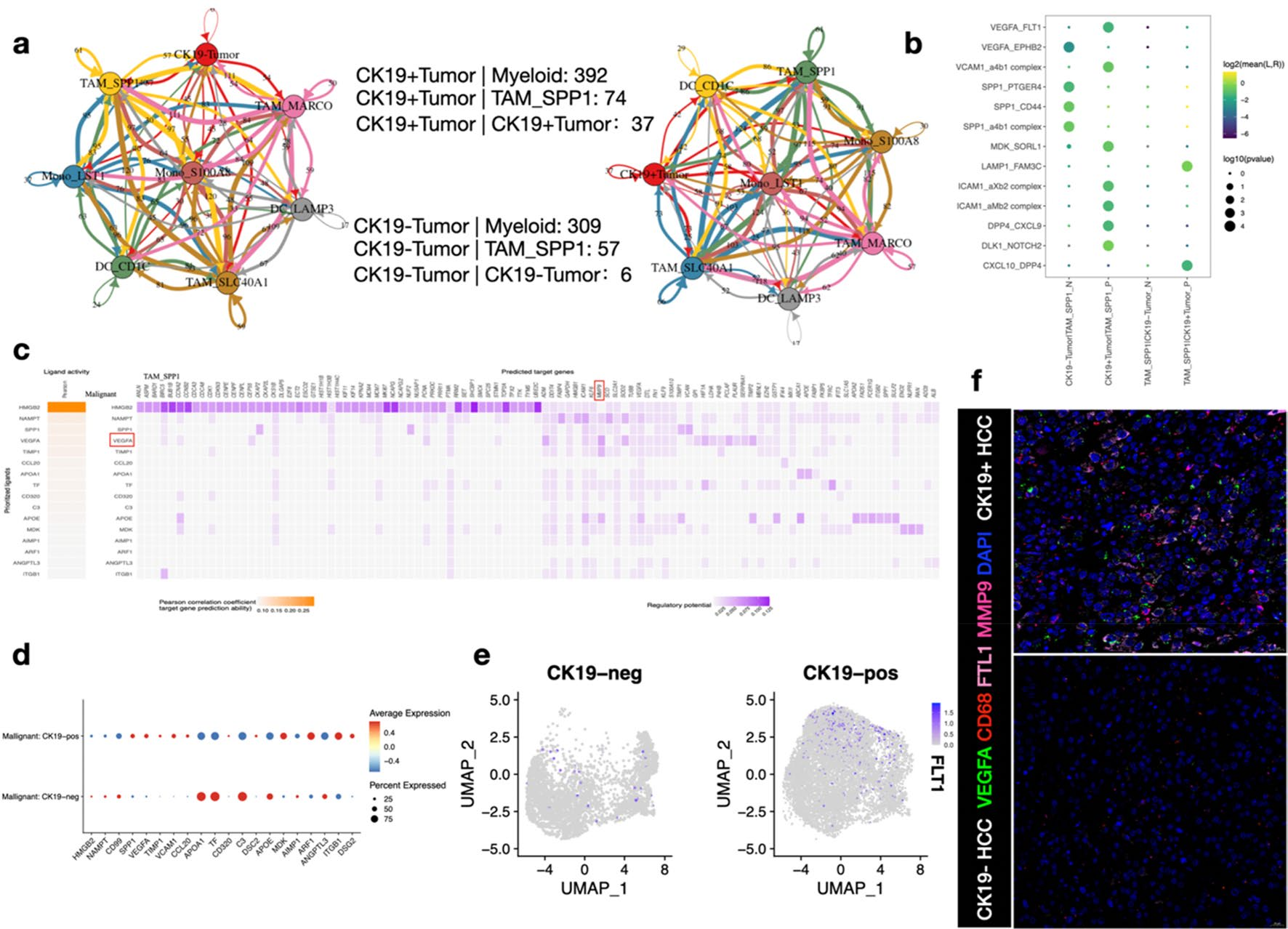
图7 VEGFA信号通路促进了TAM_SPP1中MMP9的表达