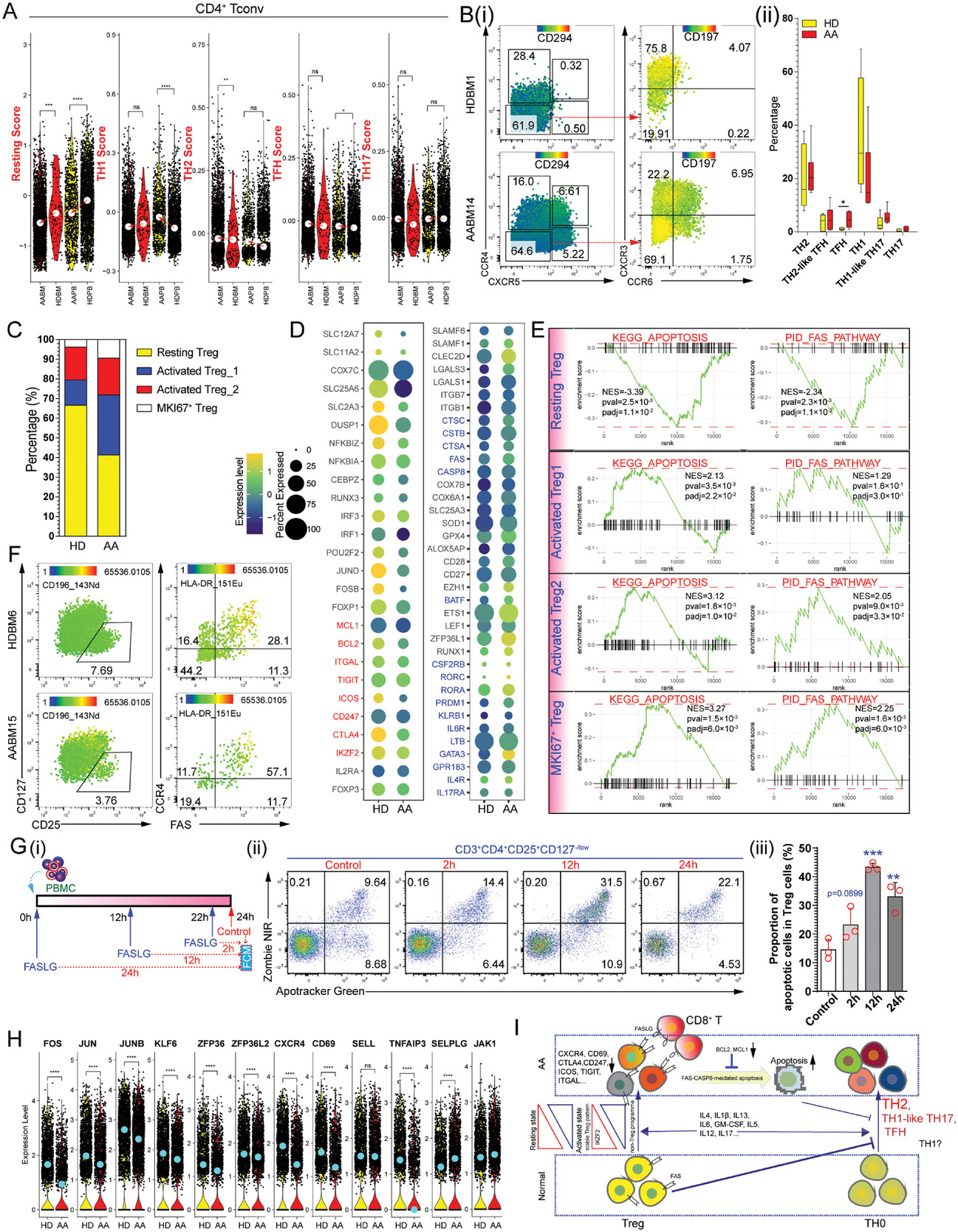
与健康对照相比,AA患者骨髓中静息型Treg亚群占比明显降低,免疫抑制分子的表达处于低水平;AA患者骨髓中Tregs高表达细胞凋亡相关的基因,而抗细胞凋亡的基因表达则处于很低的水平。另外,AA患者Tregs中与细胞迁移相关的基因表达降低表明,AA患者中Tregs细胞的免疫抑制和迁移功能受到影响。
图3 CD4+ Tregs细胞的免疫抑制和迁移功能受到抑制
4、AA患者中病理性Vδ1 T细胞占比增多
对NK细胞、NKT细胞以及γδ T细胞这几类特殊T细胞亚群进行分析,发现这几类细胞类型在AA患者中占比都明显升高,对γδ T细胞亚群分析,确认δ1样T细胞亚型是AA患者骨髓中占优势的亚型,表明该亚型可能是病理性的。
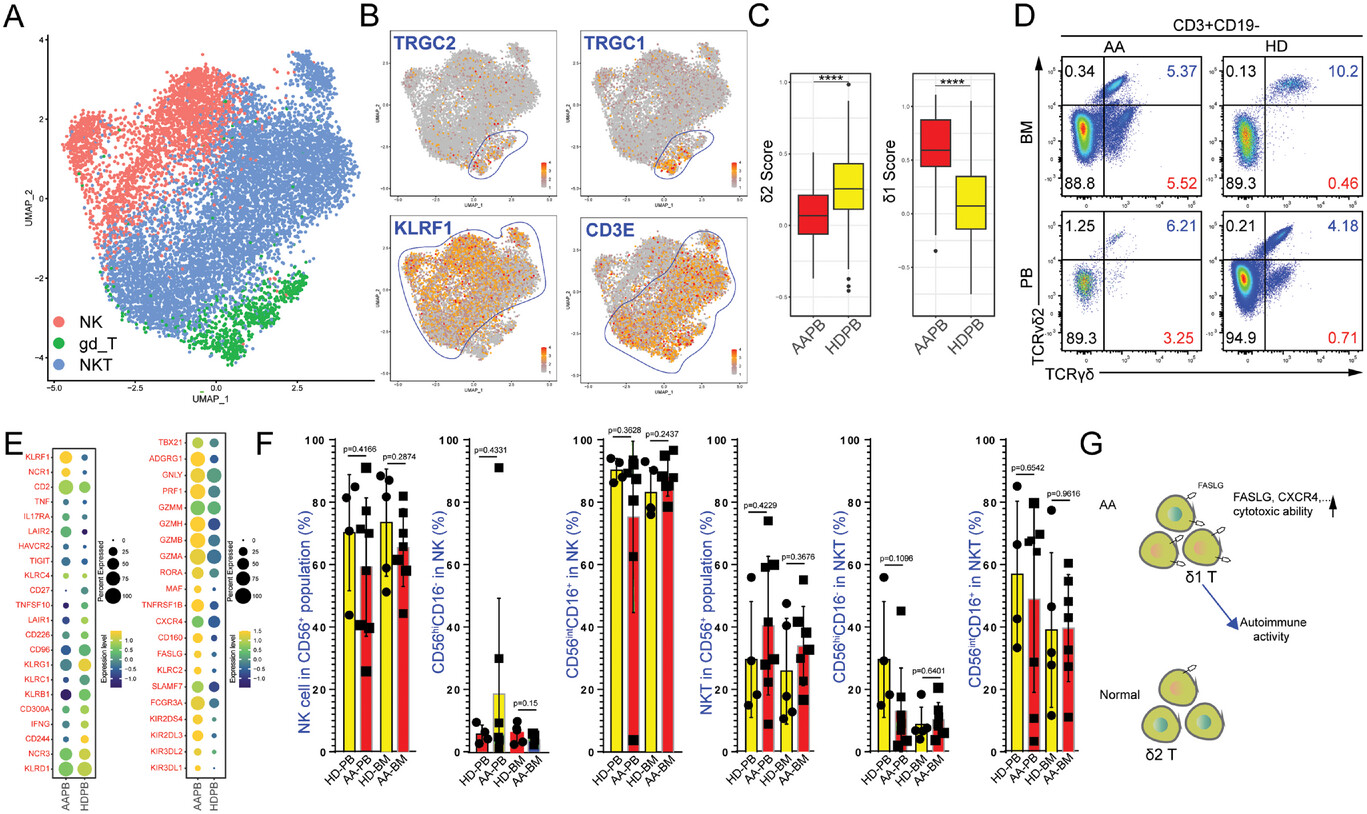
图4 AA患者中病理性VδT细胞占比增多
5、B细胞和红系祖细胞出现明显的细胞死亡表型
作者对B细胞和浆细胞进行进一步的细分分析,发现AA患者骨髓B细胞和浆细胞具有较高的细胞凋亡和细胞焦亡活性,增殖型的浆细胞也表现出FAS介导的细胞凋亡特征。
对骨髓来源红细胞进行分析,得到处于4个不同发育阶段的红细胞亚群,处于早期发育阶段的红系祖细胞在AA患者中占比减少,而处于发育末端的亚群占比明显上升。发育早期的红细胞亚群高表达FAS、TNFRSF1A和TNFRSF12A等基因,说明红细胞祖细胞对于外源性的细胞凋亡信号更为敏感。CD8+ T细胞介导的细胞死亡是红系祖细胞减少的原因,这可能会进一步影响NK细胞的发育和稳态。
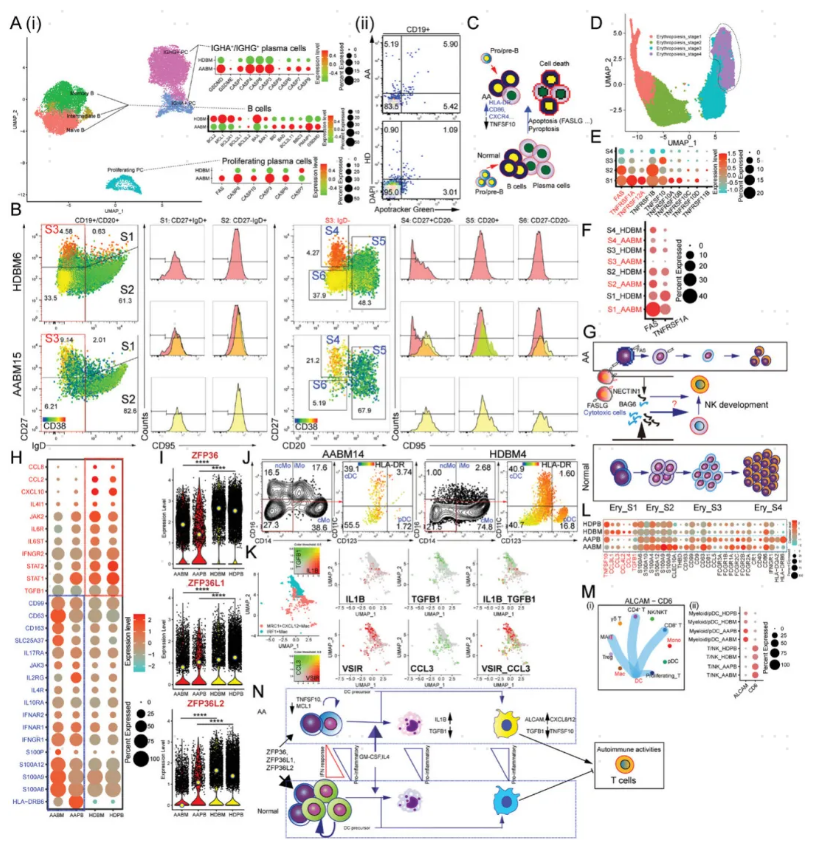
图5 B细胞和红系祖细胞出现明显的细胞死亡表型
6、铁死亡通路驱动的细胞死亡导致AA患者造血功能衰竭
铁离子过载是AA患者中比较明显的特征,对AA患者血清铁蛋白水平的检测证实了这一特征。相比其他细胞类型,HSPCs对铁死亡更为敏感,HSPCs和祖细胞中谷胱甘肽过氧化物酶基因GPX4的表达显著高于其他细胞类型。氧化脂肪酸(OFA)是铁死亡的一个表征因子,通过对AA患者骨髓浆液的代谢组学分析发现,多种OFA分子水平升高。AA患者骨髓中CD34+ HSPCs中活性氧ROS水平显著高于健康对照中,但是CD3+ T细胞中并没有观察到这一现象,说明HSPCs可能缺乏抗铁死亡的能力。这些发现表明,铁死亡是AA患者中造血功能的一个负向调节因素。
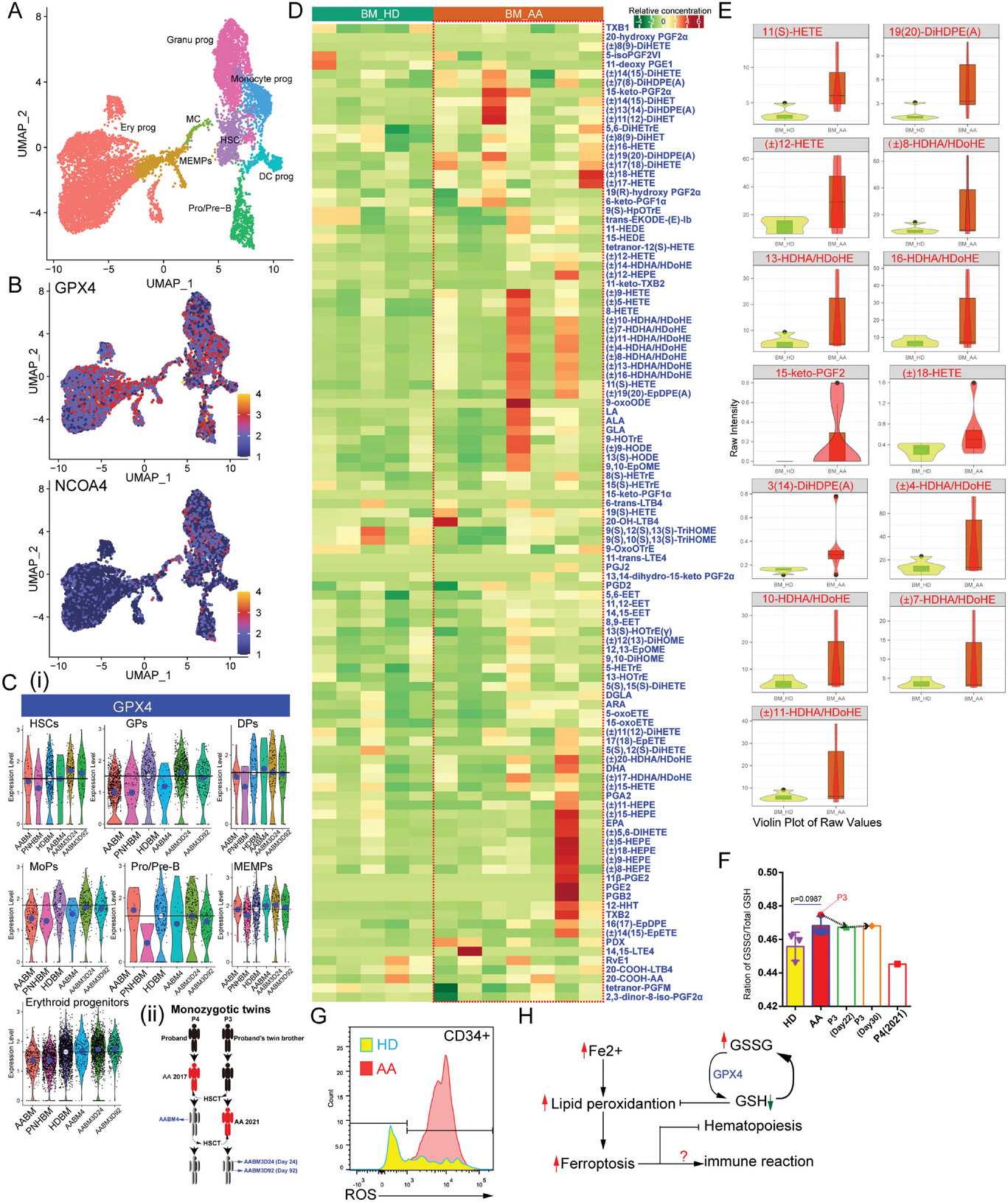
图6 铁死亡通路驱动的细胞死亡导致AA患者造血功能衰竭
7、同卵双生AA患者的HSCT治疗案例为AA致病机制提供新见解
通过对一个同卵双生、均患AA的双胞胎患者(先证者接受健康者的HSPCs进行HSCT治疗,4年后健康者患AA)进行分析,发现经过HSCT之后,AA患者中血细胞比容、网织红血球、白细胞、中性粒计数等指标恢复正常,表明造血功能得到恢复。
对这对双胞胎AA患者在不同时间点的外周血和骨髓进行单细胞转录组分析,发现造血功能的恢复伴随着HSPCs细胞占比的升高和T/NK细胞的减少。红细胞生成功能在HSCT治疗后24天或者更早的时期得到恢复。这一双胞胎AA患者的案例研究为AA致病机制的“seed-soil-worms”理论提供了新颖的见解。
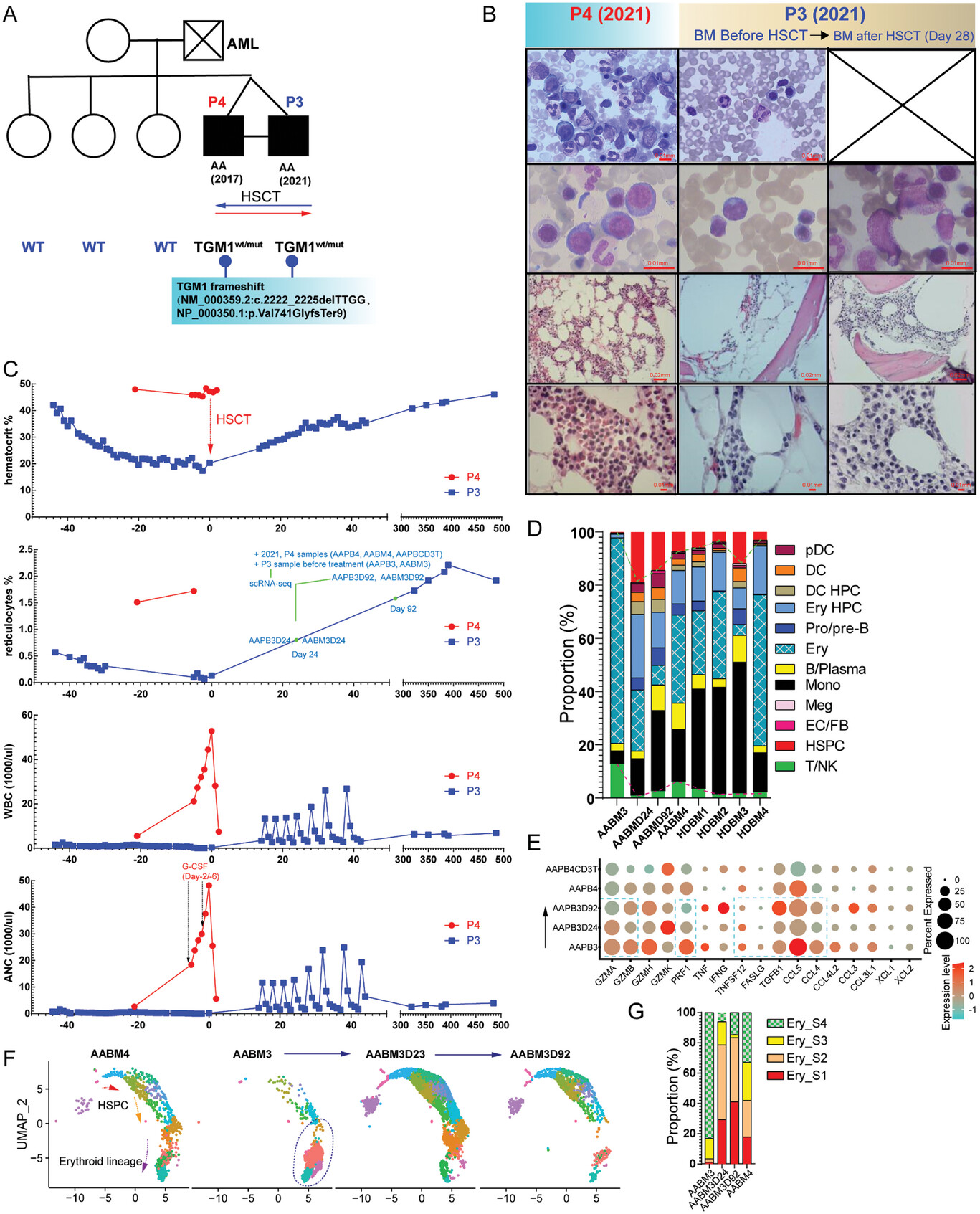
图7 同卵双生AA患者的HSCT治疗案例为AA致病机制提供新见解