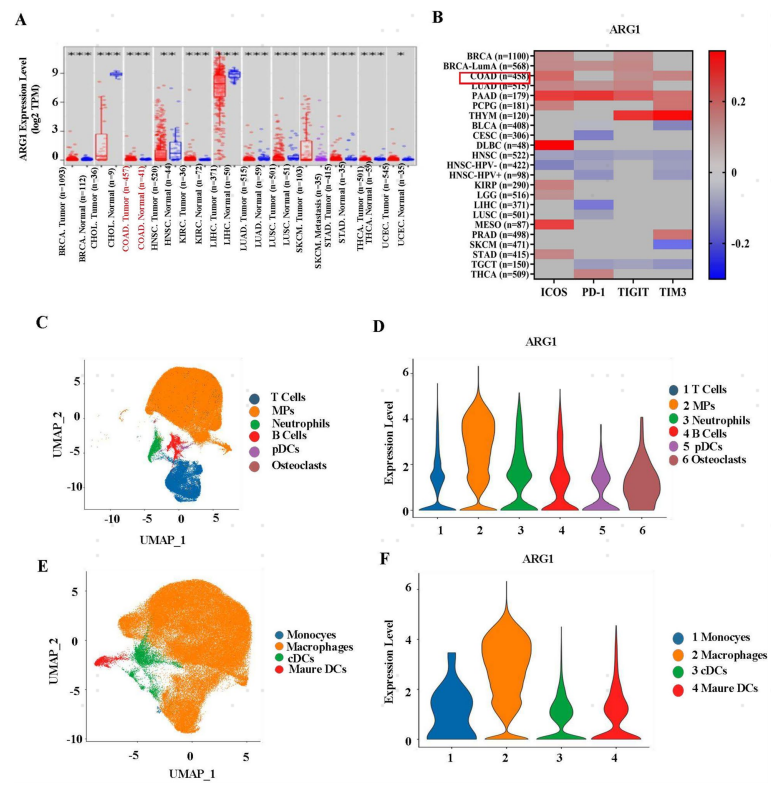
图2. GDNPs重新编程TAM以减少ARG1的产生
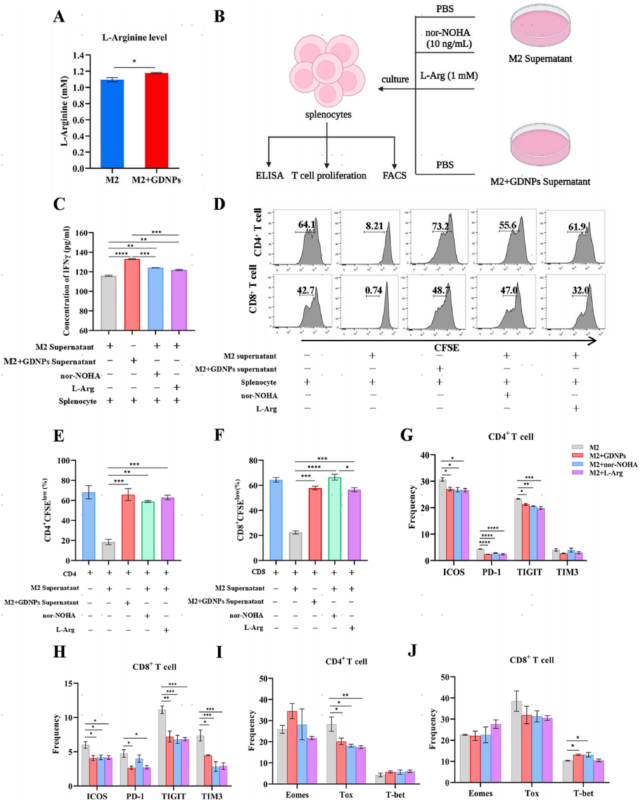
ARG1参与精氨酸代谢途径并分解精氨酸。精氨酸代谢对于T细胞的活性和反应非常重要。与对照相比,用GDNPs处理后M2样巨噬细胞上清液中的精氨酸水平更高(图3A)。作者建立了一个培养体系来探讨GDNPs是否可以维持TME中的精氨酸水平并增强T细胞的免疫反应(图3B)。GDNPs治疗组中脾细胞分泌的IFN-γ最高(图3C)。T细胞增殖实验显示,当GDNPs添加到M2样巨噬细胞中时,CD4+和CD8+T细胞的抑制得到减轻(图3D),并且增殖率比未处理的M2样巨噬细胞上清液高3倍(图3E,F)。
作者使用流式细胞术检测了与不同的M2样巨噬细胞上清液孵育的T细胞上免疫检查点的表达。结果显示,GDNPs使CD4+和CD8+T细胞上ICOS、PD-1、TIGIT表达显著下降。此外,CD8+T细胞上TIM3表达显著降低(图3G,H)。为了分析免疫检查点变化的原因,作者还检测了T细胞中的转录因子Eomes、Tox和T-bet。与对照相比,GDNPs治疗组CD4+T细胞中的Tox表达较低(图3I)。GDNPs和nor-NOHA治疗组中CD8+T细胞中T-bet的表达较高(图3J)。总的来说,这些数据表明GDNPs引起的巨噬细胞极化可以增强T细胞活化并改善T细胞耗竭,主要是通过下调ARG1水平来改善精氨酸代谢。
图3. GDNPs通过极化TAMs减少ARG1的产生以促进T细胞的增殖和活化
4、GDNPs改善TME中的精氨酸代谢,从而改善T细胞耗竭
接下来,作者研究了GDNPs治疗在体内是否具有类似的效果,以及这种效果是否有利于抗肿瘤免疫反应。为此,通过将MC38结肠癌细胞皮下接种到小鼠来建立荷瘤模型(图4A)。与对照相比,GDNPs治疗显著抑制了肿瘤生长(图4B)。
进行FACS分析以评估TME免疫细胞中ARG1的表达。结果表明,用GDNPs处理后,巨噬细胞和骨髓源性抑制细胞(MDSC)中的ARG1表达显著降低(图4C)。同时,GDNPs组的精氨酸水平(图4D)以及M1/M2比率较高(图4E)。这些数据表明,GDNPs可以通过重新编程TAM抑制ARG1的产生来维持精氨酸水平,从而促进其抗肿瘤作用。
为了研究GDNPs、ARG1和T细胞耗竭之间的相互作用,作者检查了T细胞活化、增殖和免疫检查点的表达。流式细胞术结果显示,与对照相比,GDNPs处理显著上调CD4+和CD8+T细胞中CD69和Ki67的表达,同时下调ICOS、PD-1、TIGIT、TIM-3的表达。(图4F-I)。为了进一步确定GDNPs对缓解T细胞耗竭的潜在影响,作者评估了T细胞中转录因子Eomes、Tox和T-bet的表达(图4J,K)。结果显示,GDNPs抑制CD4+和CD8+T细胞中Eomes和Tox的表达,但仅增强CD8+T细胞中T-bet的表达。总之,GDNPs通过促进T细胞活化增殖和减轻T细胞耗竭来发挥抗肿瘤作用。
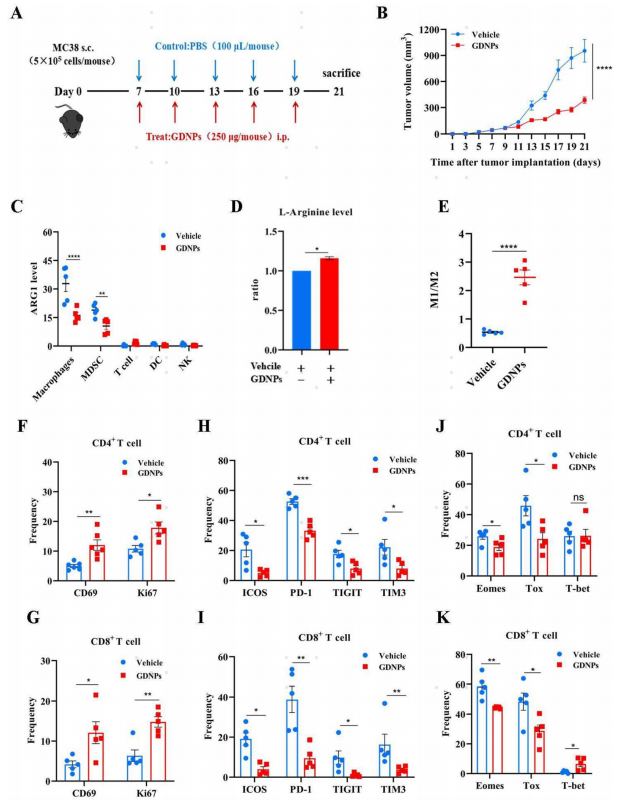
图4. GDNPs改善TME中的精氨酸代谢以缓解T细胞耗竭
5、GDNPs通过增强CD8Tef的作用功能改善T细胞耗竭
为了探索GDNPs如何影响CD8+T细胞亚群以进一步减轻T细胞耗竭,作者使用单细胞测序来检测GDNPs给药后T细胞的变化。对CD8+T细胞聚类分群为三种不同的亚型:初始T、CD8效应T细胞(CD8Teff)和CD8耗竭T细胞(CD8Tex)(图5A,B)。细胞毒性和趋化因子相关基因在GDNPs处理的CD8Teff和Tex亚簇中表现出更高的表达水平(图5C)。
此外,使用效应基因集进行UCell分析发现GDNPs不仅增强了CD8Teff的细胞毒性效应功能,而且增强了CD8Tex和naiveT的细胞毒性效应功能(图5D-F)。热图结果表明,GDNPs下调CD8Teff细胞中Tox、Eomes的表达,上调Tbx21的表达。CD8Tex中的Tox和Eomes也观察到相同的结果(图5G)。总之,GDNPs通过改善CD8Teff中的tbx21表达来增强效应器功能,从而改善T细胞耗竭。
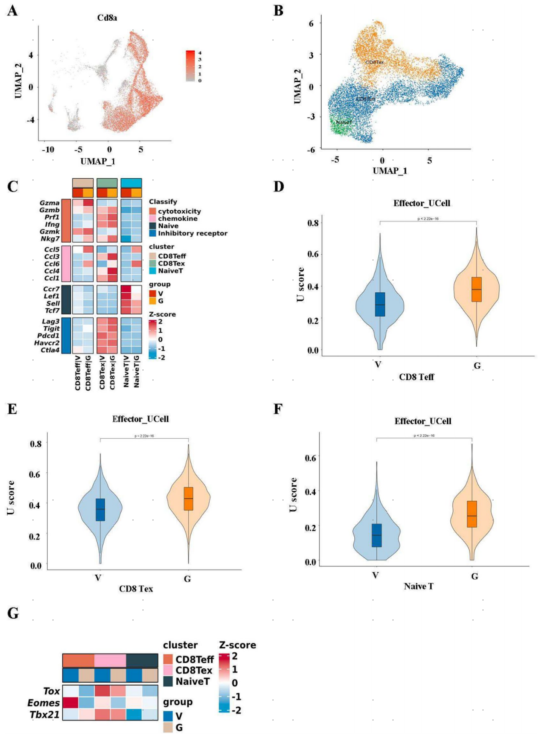
图5. GDNPs通过增强CD8Teff的功能缓解T细胞耗竭
6、GDNPs对T细胞耗竭的改善效果取决于mTOR-T-bet轴
以上的研究表明,GDNPs通过调节ARG1表达来影响TME中的精氨酸水平,并且作者发现GDNPs增加了T细胞中T-bet的表达从而改善了精氨酸代谢。因此作者推测GDNPs对T细胞耗竭的改善可能也与调节精氨酸代谢的mTOR信号通路有关。为此,作者构建了一个培养体系,将CD8+T细胞与M2+GDNPs或M2巨噬细胞上清液一起培养后收集CD8+T细胞进行转录组测序。KEGG富集分析显示mTOR信号通路存在显著差异(图6A)。为了进一步探讨GDNPs改善T细胞耗竭的机制,作者将脾细胞与经或不经GDNPs处理的M2样巨噬细胞上清液一起孵育,结果显示,GDNPs处理后T细胞中p-S6和p-4EBP1的表达显著增加,表明mTOR信号的激活增强(图6B-D)。
精氨酸被认为是mTOR通路的激活剂。为了进一步验证精氨酸对mTOR活性的增强作用,使用流式细胞术分析发现精氨酸增加了CD8+T细胞中p-S6和p-4EBP1的表达(图6E-G)。此外,流式细胞术分析表明,精氨酸降低了CD4+T细胞和CD8+T细胞中Tox的表达,增加了T-bet的表达。而精氨酸对Eomes表达的影响仅在CD4+T细胞中发现(下调),而在CD8+T细胞中则没有(图6H-J)。为了测试补充精氨酸是否可以通过调节这些转录因子来改善T细胞耗竭,作者通过流式细胞术检测了有或没有精氨酸培养的T细胞上ICOS、PD-1、TIGIT、TIM3的表达。结果表明,补充精氨酸降低了CD4+和CD8+T细胞上PD-1、TIGIT和TIM3的表达,这证实补充精氨酸可以改善T细胞耗竭(图6K-M)。因此,GDNPs通过极化巨噬细胞来改善精氨酸代谢,从而防止T细胞耗竭。
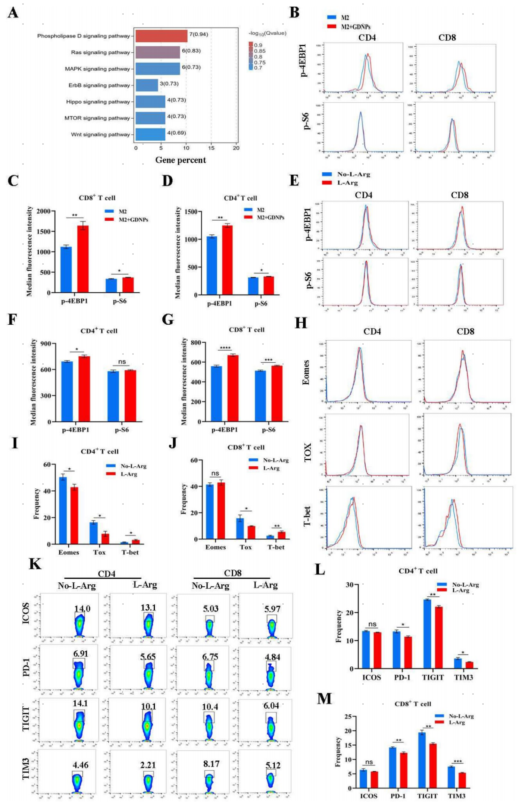
图6. GDNPs对T细胞耗竭的缓解作用依赖于mTOR-T-bet轴
7、抑制T细胞中的mTOR活性可抑制GDNPs的抗肿瘤作用
为了进一步阐明GDNPs是否通过mTOR-T-bet轴改善T细胞耗竭,作者使用mTOR活性抑制剂雷帕霉素来检查改善的T细胞耗竭是否主要受mTOR信号通路调节。因此,作者利用M2样巨噬细胞的上清液与GDNPs加雷帕霉素建立了脾细胞培养体系,以抑制mTOR活性。流式细胞术结果显示,与单独使用M2+GDNPs相比,添加雷帕霉素时T细胞上ICOS、PD-1、TIGIT的表达比例显著升高(图7A,B)。与未使用雷帕霉素的组相比,经雷帕霉素处理的CD8+T细胞中Tox表达较高,而雷帕霉素存在时T-bet表达较低(图7C,D)。同时,作者进行了体内验证,通过T细胞回输实验(图7E)表明,雷帕霉素处理后GDNPs失去了抗肿瘤作用(图7F)。总之,这些结果表明GDNPs改善T细胞耗竭依赖于mTOR-T-bet途径(图7G)。
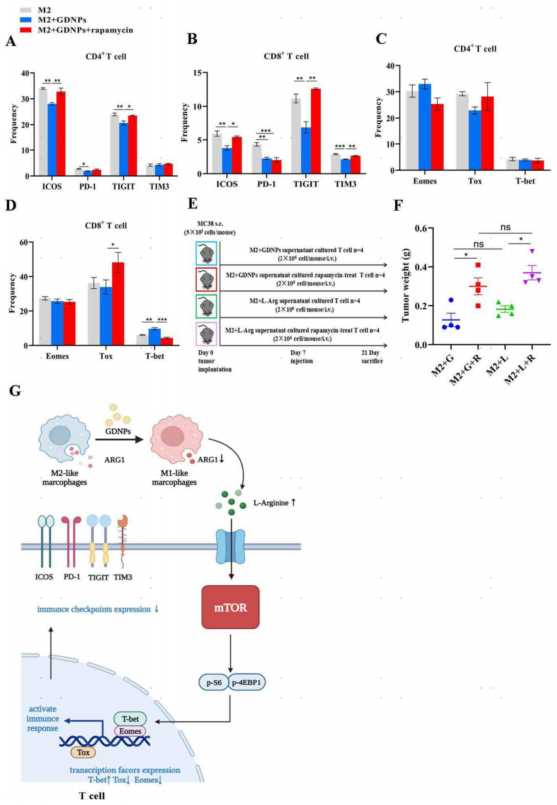
图7. 抑制T细胞中的mTOR活性抑制GDNPs的抗肿瘤作用