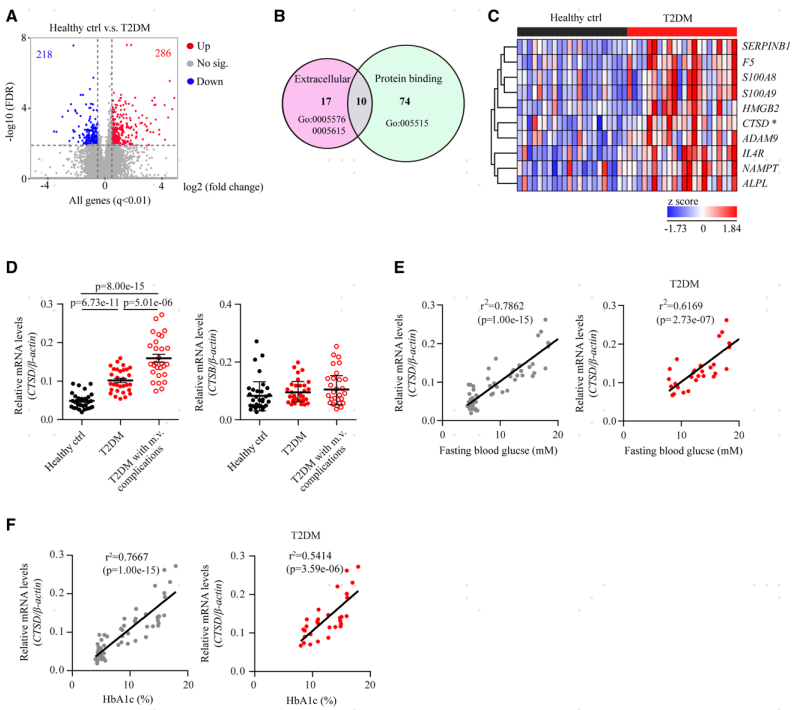
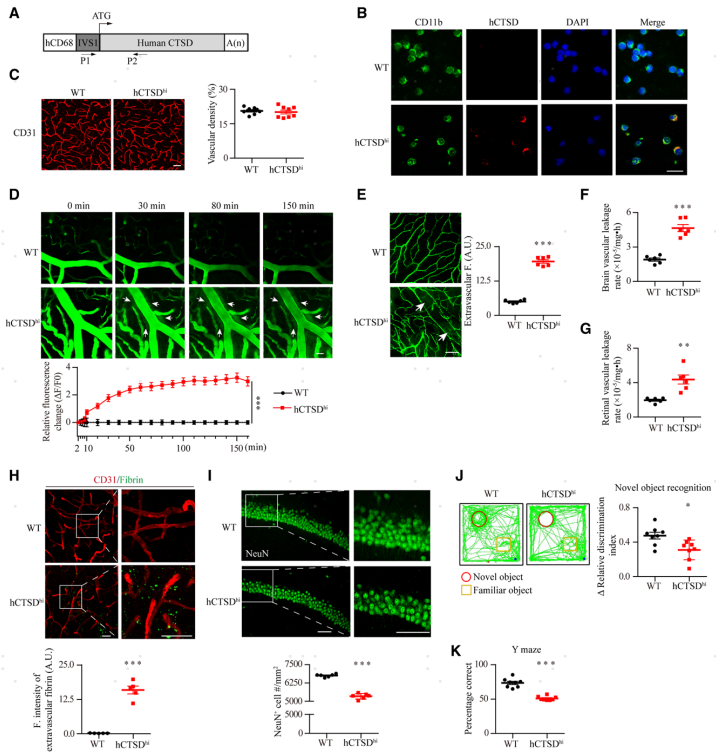
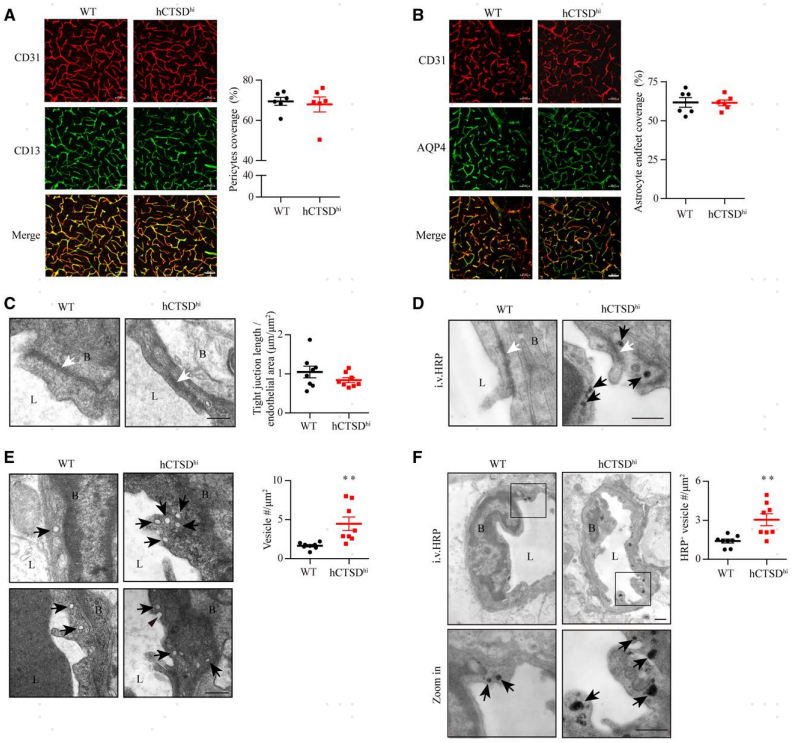
脑微血管通透性的维持与血管周细胞和星形胶质细胞终足对血管内皮细胞的覆盖率紧密关联。因此,通过CD31和CD13(周细胞标记物)或AQP4(星形细胞终足标记物)的免疫染色来分析周细胞和星形细胞终足的血管覆盖率。结果显示,hCTSDhi小鼠脑周细胞(图3A)和星形细胞终足(图3B)的血管覆盖率保持不变,提示hCTSDhi小鼠脑微血管的通透性增高是由于脑内皮本身受损所致。采集小鼠大脑进行透射电子显微镜(TEM)分析,观察到hCTSDhi小鼠脑血管内皮细胞中的囊泡显著增加(图3E),这意味着囊泡介导的胞吞作用增强,这是血脑屏障通透性的关键调节因子。接着又通过静脉注射了电镜示踪剂HRP,之后进行的电镜成像发现hCTSDhi小鼠脑血管内皮细胞中HRP阳性的囊泡显著增加,然而脑血管内皮细胞间的紧密连接结构这并未见到HRP示踪剂分布。这说明,单核细胞CTSD的高表达增强了囊泡介导的从血液到脑实质的转胞吞作用,而不影响血管内皮细胞间的紧密连接结构。
图3 hCTSDhi小鼠脑血管内皮细胞中囊泡密度增加,转胞吞作用增强
4. 脑微血管内皮细胞中Cav1的上调导致hCTSDhi小鼠脑血管通透性增高
作者为了探讨hCTSDhi小鼠脑血管内皮细胞囊泡介导的转胞吞增强的机制,进行单细胞RNA测序分析了hCTSDhi小鼠脑内细胞组成和基因表达的变化。细胞聚类分析显示,hCTSDhi小鼠脑内内皮细胞百分比略有变化(图4A)。然后,与内皮细胞簇进行差异基因分析,在hCTSDhi小鼠中发现29个上调基因和33个下调基因(图4B)。基因集富集分析显示,差异表达基因在内吞途径(顶部,图4C)和小窝途径(底部,图4C)中显著富集。在hCTSDhi小鼠脑内皮细胞的差异表达基因中,发现小窝主要结构成分Cav1 (caveolin 1)和Cavin2 (caveolae-associated protein 2)上调,图4D)。细胞群分析显示,与野生型对照相比,hCTSDhi小鼠的Cav1+内皮细胞增加的比例高于Cavin2+内皮细胞增加的比例 (图4E)。内皮细胞群进一步分为静脉内皮细胞、毛细血管内皮细胞和动脉内皮细胞(上图,图4F),发现Cav1在hCTSDhi小鼠的3个内皮亚群中均有升高,其中在毛细血管细胞中升高的比例尤其高(相比野生型小鼠,图4F)。进一步对脑切片进行免疫染色,结果证实了hCTSDhi小鼠脑微血管中Cav1的表达增加(图4G)。为了确定增加的Cav1是否为hCTSDhi小鼠脑血管通透性升高所必需,用编码shRNA-Cav1的AAV-BR1病毒特异性干扰内皮细胞Cav1,然后进行血管通透性分析。发现下调内皮细胞Cav1后,hCTSDhi小鼠脑实质纤维蛋白原沉积和荧光葡聚糖渗漏的现象明显缓解了 (图4H,I)。进一步的TEM分析显示,hCTSDhi小鼠脑内皮中囊泡的积聚的现象也减轻了(图4J)。综上所述,这些数据表明,外周单核细胞CTSD的上调增加了脑微血管内皮细胞Cav1,促进了囊泡介导的血脑转胞吞作用,导致脑微血管通透性增加。
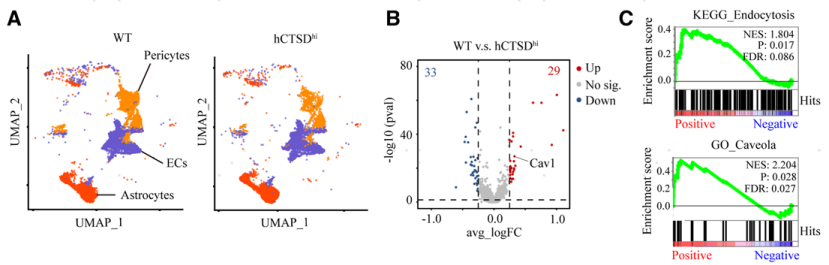
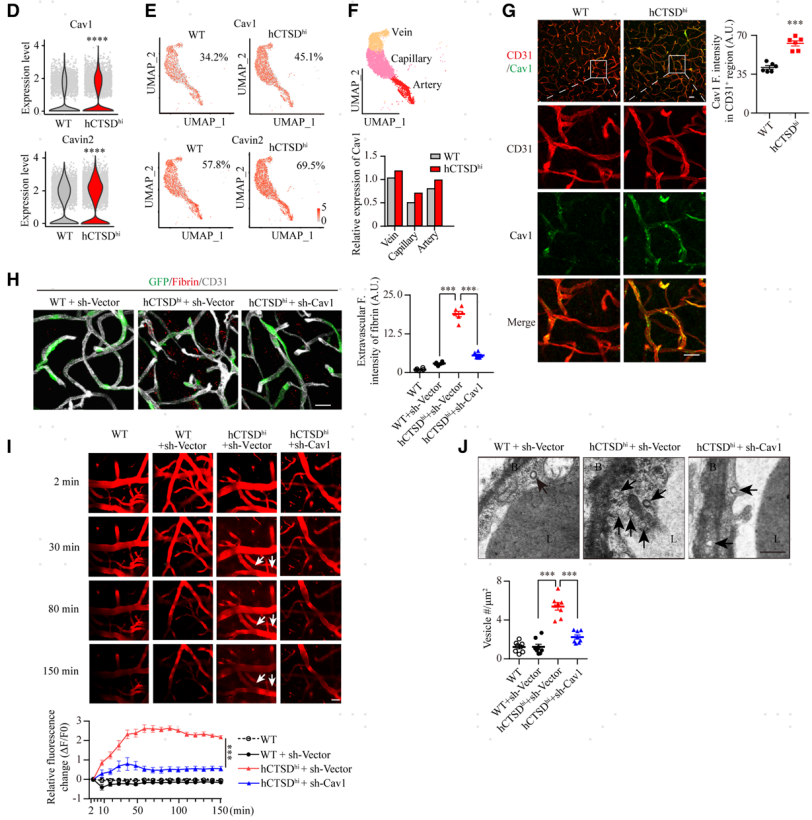
图4 hCTSDhi小鼠脑内皮中Cav1依赖性胞吞作用增强
5. 单核细胞分泌Pro-CTSD触发脑血管内皮细胞Cav1依赖性胞吞作用
高表达CTSD的单核细胞如何调节脑血管内皮细胞的胞吞作用?作者假设CTSD具有可分泌性,可以由单核细胞分泌到血浆中然后对脑血管内皮细胞产生作用。因此,作者对T2DM患者的血浆样本进行了Western blot分析。发现血浆中的CTSD以53 kD的pro-CTSD为主,T2DM患者血浆中pro-CTSD显著升高(图5A)。同时发现hCTSDhi小鼠血浆中也存在高水平的pro-CTSD (图5C,D)。作者使用浓度梯度葡萄糖处理的单核THP-1细胞,发现pro-CTSD的表达水平表现出葡萄糖浓度依赖性,而CTSD重链的表达水平却无明显变化 (图5E)。这些数据表明高糖诱发单核细胞过度分泌pro-CTSD。接下来作者利用慢病毒构建了一个稳定的过表达CTSD的单核THP-1细胞系(命名为CTSDOE),利用该细胞分泌的细胞上清CTSDOE CM评估分泌的pro-CTSD对脑血管内皮细胞的影响。结果发现分泌的pro-CTSD上调脑血管内皮细胞Cav1的表达,增加内皮细胞屏障的通透性。接着作者又通过qRT-PCR和Luciferas实验发现,pro-CTSD是通过上调脑血管内皮细胞Cav1的转录来促进小窝蛋白的表达的。
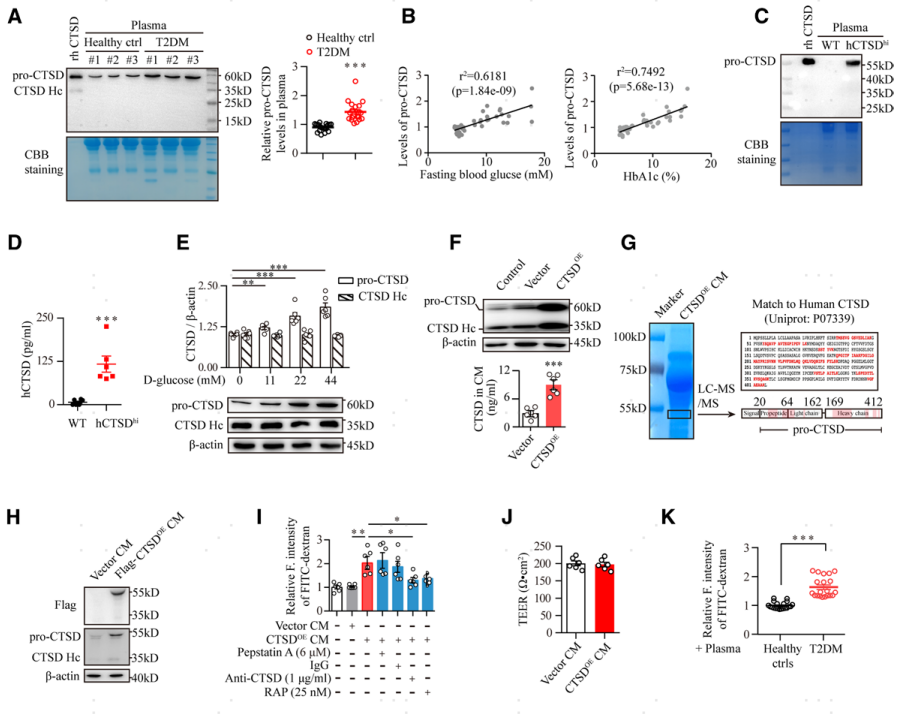
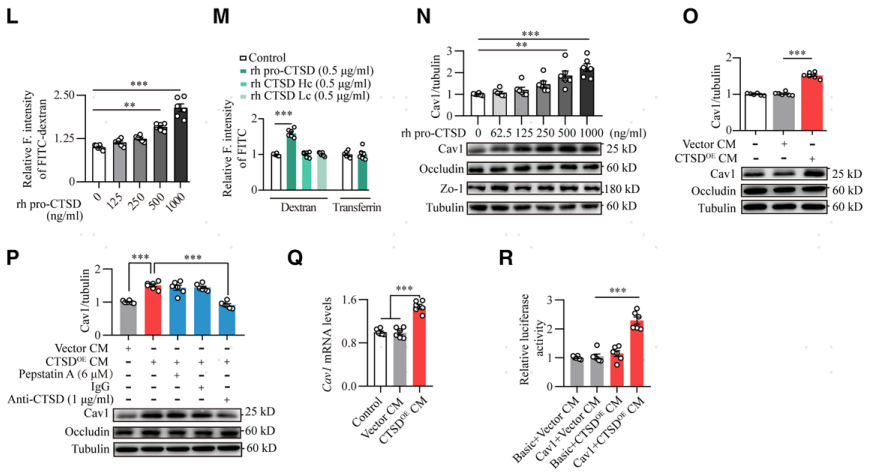
图5 糖尿病时单核细胞分泌pro-CTSD上调脑血管内皮细胞中的Cav1的表达促进转胞吞作用
6. pro-CTSD结合脑血管内皮细胞LRP1受体激活NF-kB信号并促进Cav1表达增强转胞吞作用
作者利用质谱检测和富集分析的方法筛选位于脑血管内皮细胞表面可以与pro-CTSD相互作用的受体蛋白(图6A),发现低密度脂蛋白受体相关蛋白1(LRP1)可以与pro-CTSD结合(图6B)。进一步进行免疫沉淀和Pulldown实验发现pro-CTSD主要与LRP1的α亚基的细胞外簇2结合(图6C)。为了明确pro-CTSD与LRP1的结合对脑血管内皮细胞Cav1的上调作用,作者利用干扰技术抑制了脑血管内皮细胞LRP1的表达,Western blot结果显示抑制脑血管内皮细胞LRP1表达可以有效阻断CTSDOE CM对Cav1的上调作用(图6D)。体内实验也发现同样的效果,利用AAV-BR1病毒特异性沉默脑血管内皮细胞LRP1可以有效阻断hCTSDhi小鼠脑血管内皮细胞中Cav1的高表达 (图6G)。同时TEM分析显示,沉默LRP1可以明显缓解 hCTSDhi小鼠脑血管内皮细胞囊泡增多的现象 (图6H)。这些数据表明,pro-CTSD与脑内皮上LRP1的细胞外簇2结构域结合,促进Cav1介导的转胞吞作用。接下来作者又对pro-CTSD与LRP1结合激活的下游信号通路进行分析,发现单核细胞分泌pro-CTSD与脑内皮细胞LRP1的胞外结构域结合可以激活NF-kB信号通路,上调Cav1的表达,增强Cav1介导的转胞吞作用(图6I-K)。
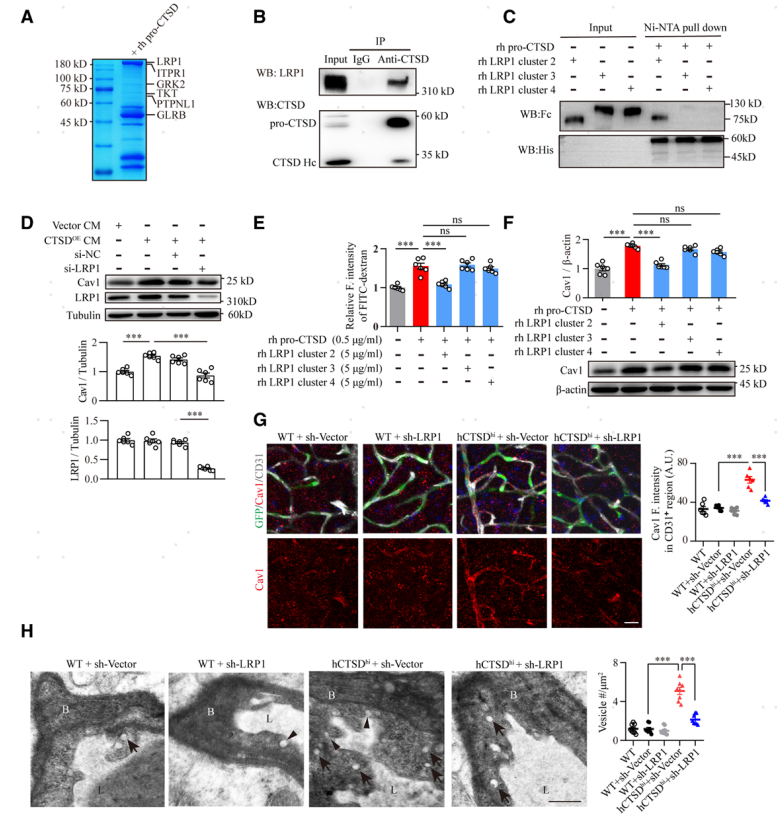
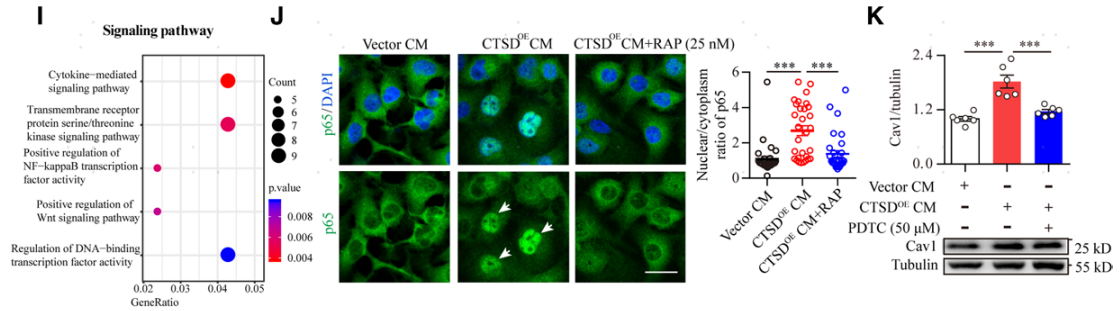
图6 pro-CTSD与LRP1受体结合激活内皮细胞NF-kb信号通路上调Cav1表达,增强囊泡介导的转胞吞作用
7. 敲除单核细胞CTSD可以缓解糖尿病小鼠脑血管内皮细胞转胞吞作用,对糖尿病导致认知功能损伤具有保护作用
接下来,作者利用LoxP-Cre技术单倍敲降了小鼠单核细胞中CTSD的表达(构建CTSDmKO小鼠),分析CTSD的下调是否对糖尿病相关的脑微血管损伤有保护作用。通过qRT-PCR和ELISA检测可见,CTSD的单倍敲降可以有效的将糖尿病模型小鼠单核细胞和血浆中的CTSD水平控制在健康对照小鼠的水平(图7B,C)。接着作者又使用FITC-葡聚糖(40 kDa)进行了体内双光子脑成像,评估CTSD消除是否可以保护糖尿病对脑微血管的损伤。发现糖尿病CTSDfl/fl小鼠的脑实质中FITC-葡聚糖外渗明显,而糖尿病CTSDmKO小鼠的脑实质中这种外渗明显减少(图7D)。并且发现CTSD敲除可以有效缓解糖尿病小鼠脑组织和视网膜血管中FITC-葡聚糖的渗漏(图7E)。透射电镜分析显示,糖尿病CTSDmKO小鼠脑血管内皮细胞中囊泡的密度较糖尿病CTSDfl/fl小鼠也明显下降(图7F),这说明CTSD的敲除有效缓解了糖尿病诱发的脑血管内皮细胞转胞吞增强的效应。接着,作者用NeuN抗体进行免疫染色,结果显示糖尿病CTSDmKO小鼠海马神经元的丢失有所减轻(图7G)。Y迷宫和新物体识别测试结果显示,糖尿病CTSDmKO小鼠的记忆和认知能力恢复显著 (图7H,I)。这些结果表明,单核细胞CTSD的敲除可以有效治疗糖尿病诱发的脑微血管渗漏和认知障碍。
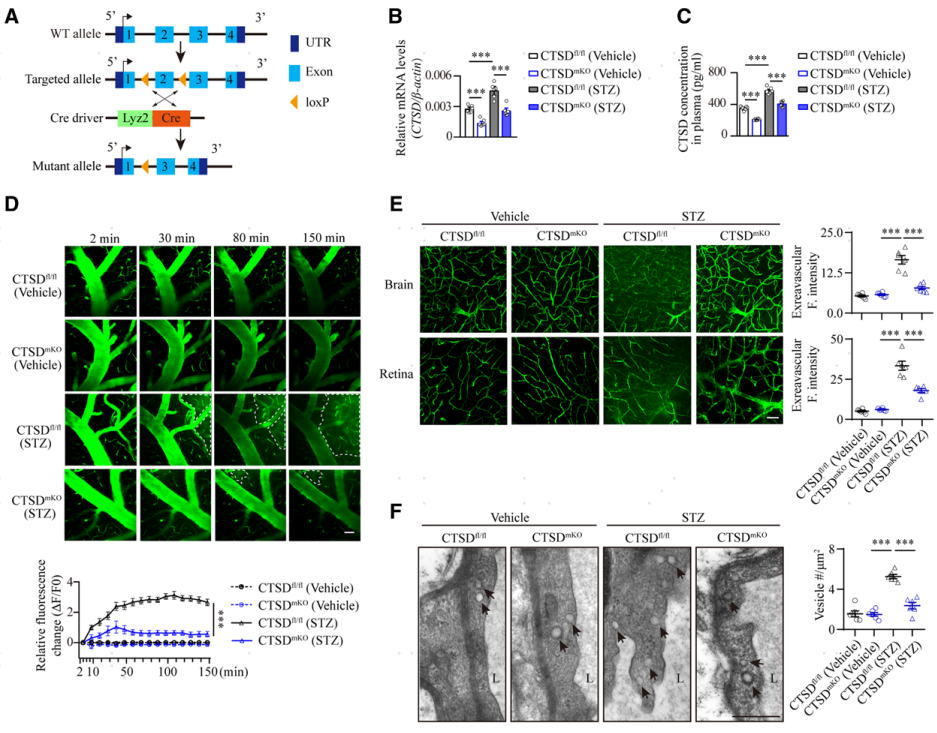
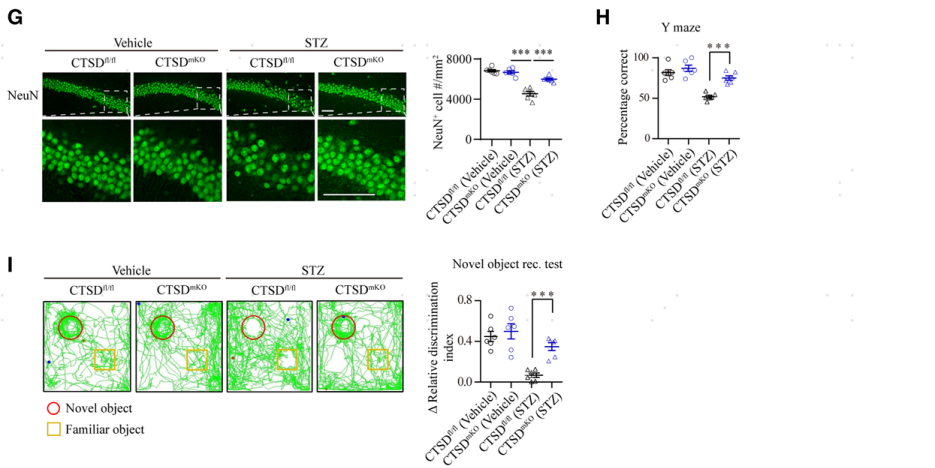
图7 敲除单核细胞CTSD可以有效缓解糖尿病小鼠的脑血管渗漏、改善认知功能