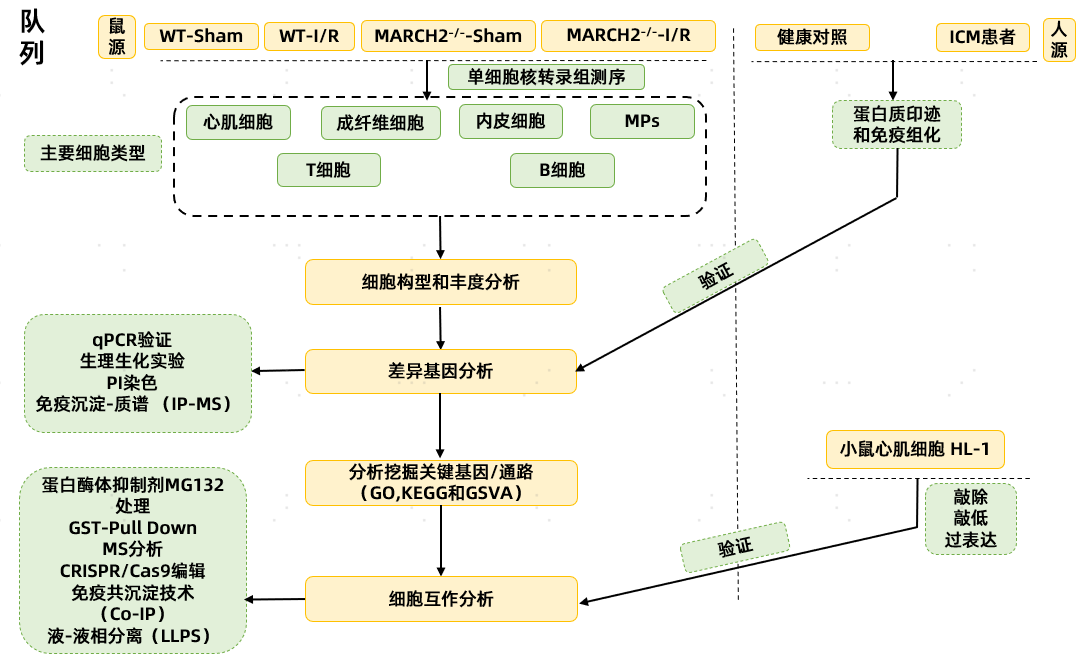
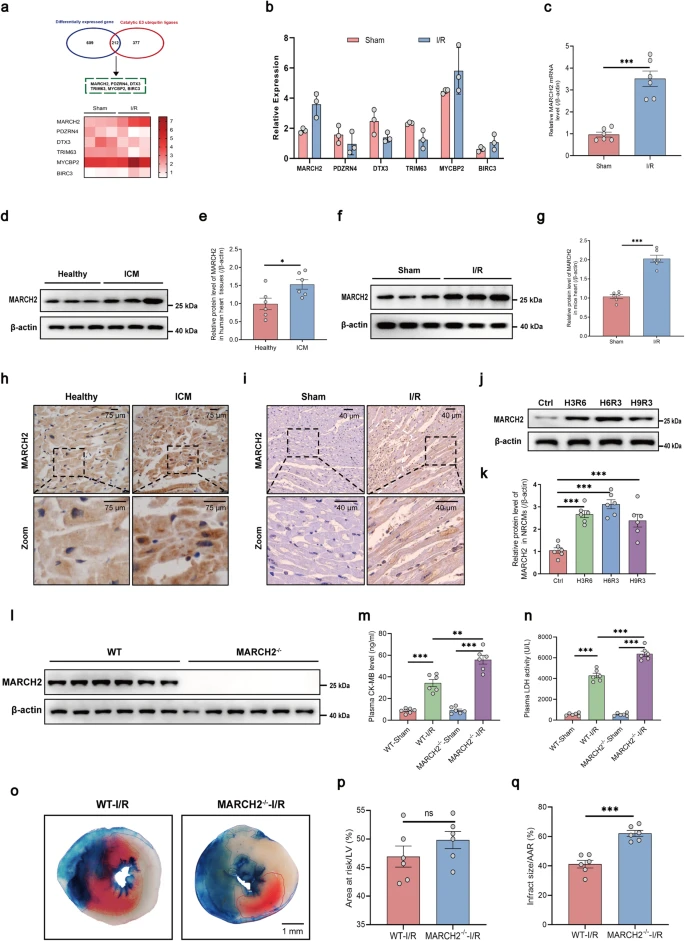
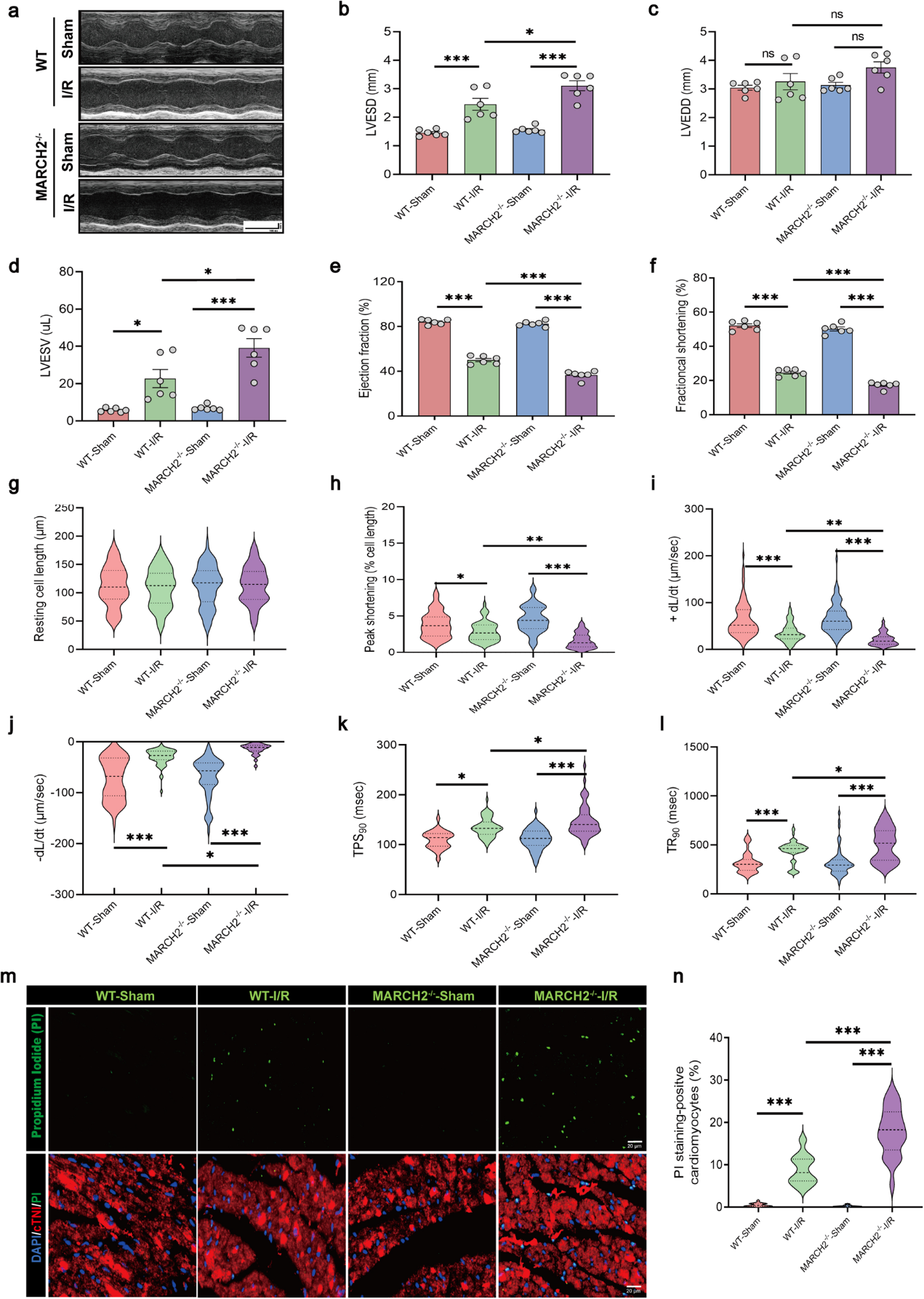
为探究MARCH2 KO是否加重心脏I/R损伤,作者对WT和MARCH2 KO小鼠进行了snRNA-seq分析。分析显示I/R术后MP和心肌细胞簇发生变化,提示这两类细胞在心脏I/R损伤中起重要作用。WT-I/R组中,NLRP3炎症小体组装相关基因在多种细胞中上调,揭示NLRP3在心肌I/R损伤中的关键作用。KEGG和GO分析强调NOD样受体信号通路、坏死性凋亡及NLRP3炎症小体复合物组装的重要性。相关基因主要在MARCH2 KO心肌细胞中升高,证实心肌细胞的核心作用。GSVA分析显示,MARCH2 KO-I/R心肌细胞中NOD样受体和NLRP3炎症小体复合物组装相关基因显著上调。此外,MARCH2缺失增强NLRP3与ASC的相互作用,表明其可能促进NLRP3炎症小体组装和活化,加剧心脏I/R损伤。
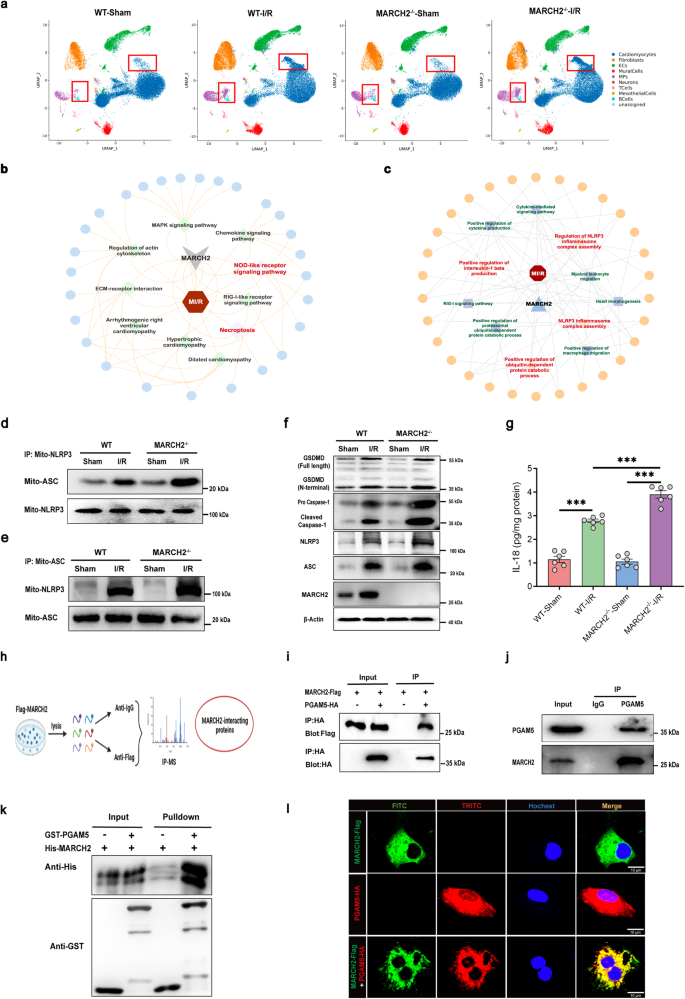
图3 PGAM5与MARCH2相互作用
4.MARCH2通过催化K48连接的多泛素化介导 PGAM5蛋白酶体降解
细胞互作分析显示,MARCH2 KO-I/R心脏中MPs与心肌细胞间相互作用增强。在模拟H/R损伤和促炎环境下,MARCH2促进PGAM5的蛋白酶体依赖性降解。MARCH2的催化活性及其与PGAM5的直接相互作用(通过TM和PDZ结构域)在降低PGAM5水平中起关键作用。MARCH2将K48连接的polyUb链与PGAM5的K88和K141位点偶联,导致PGAM5泛素化和降解。这些发现表明MARCH2在心肌I/R损伤中通过调控PGAM5泛素化降解过程发挥重要作用。
图4 MARCH2 E3连接酶通过K48连接的polyUb促进PGAM5的降解
5.MARCH2抑制心肌I/R后PGAM5依赖性NLRP3炎症小体激活
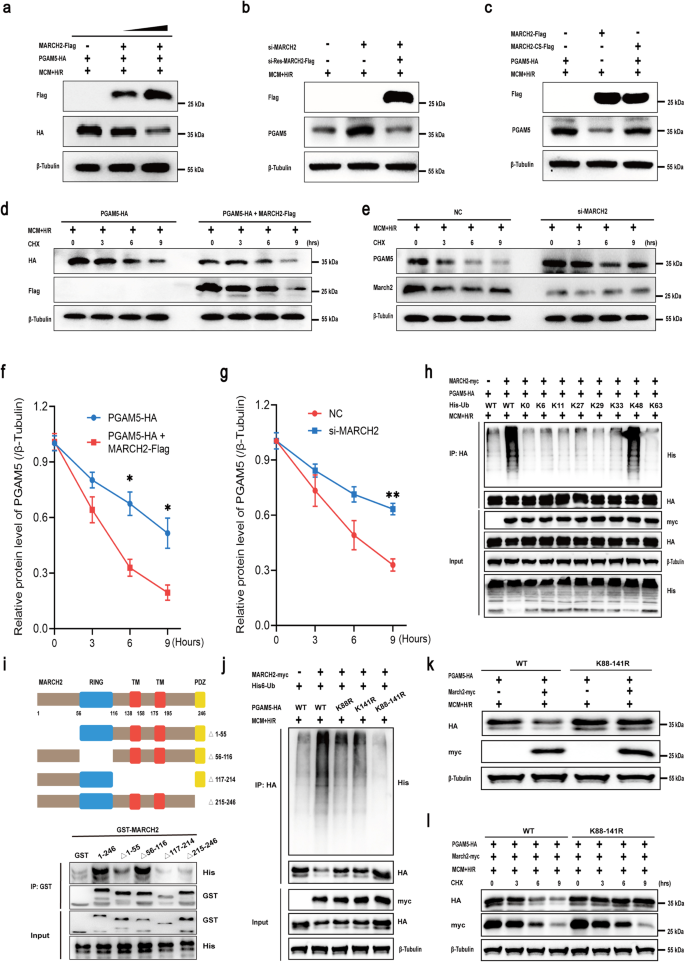
在ICM患者中,PGAM5与MARCH2蛋白水平呈负相关。MARCH2过表达导致NMCMs中PGAM5蛋白水平下降,而MARCH2缺失降低了PGAM5的K48连接泛素化水平。小鼠心脏I/R损伤后,PGAM5水平上升,MARCH2基因敲除加剧此效应。此外,MARCH2通过影响泛素信号转导调控PGAM5在NLRP3炎症小体中的作用,过表达MARCH2抵消MCM+H/R诱导的ASC升高,削弱PGAM5的共表达效果。
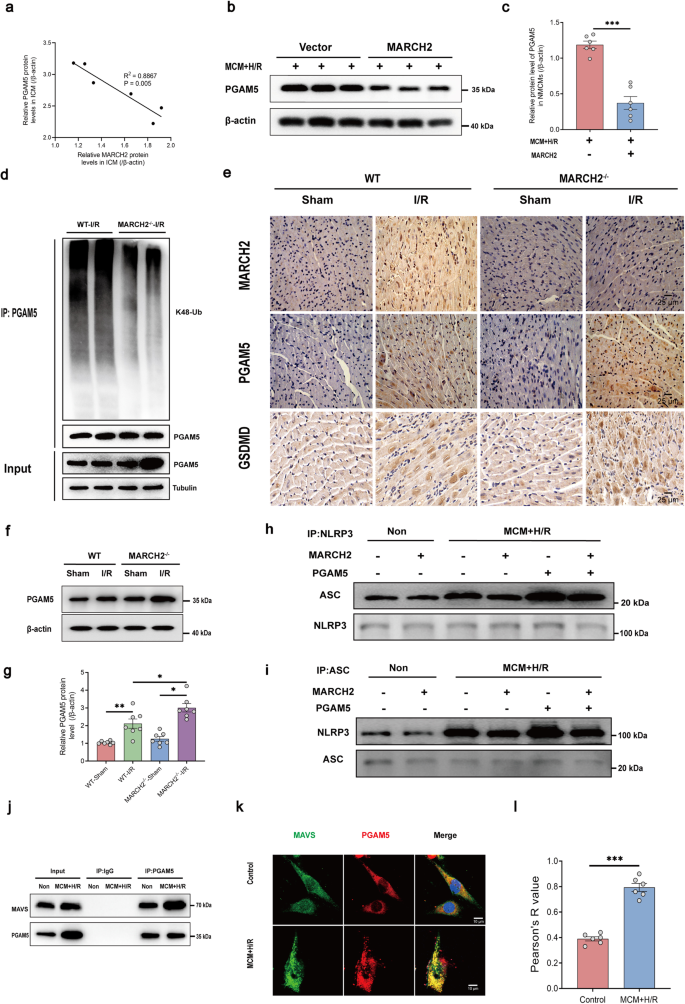
图5 PGAM5介导MARCH2对心肌I/R后NLRP3炎症小体组装的调节
6.在MCM+H/R处理下PGAM5-MAVS共聚体的形成促进了MAVS依赖性NLRP3活化
作者从公共的蛋白质-蛋白质相互作用数据库中发现了PGAM5与MAVS的潜在联系,并通过一系列实验验证该发现。结果表明PGAM5和MAVS能够形成点状结构,并表现出类似液体的特性。此外,还发现PGAM5可以促进MAVS介导的NLRP3炎症小体激活,并在调控NLRP3炎症小体激活过程中的起重要作用。这些发现为理解PGAM5和MAVS如何共同参与NLRP3炎症小体的激活提供了理论基础。
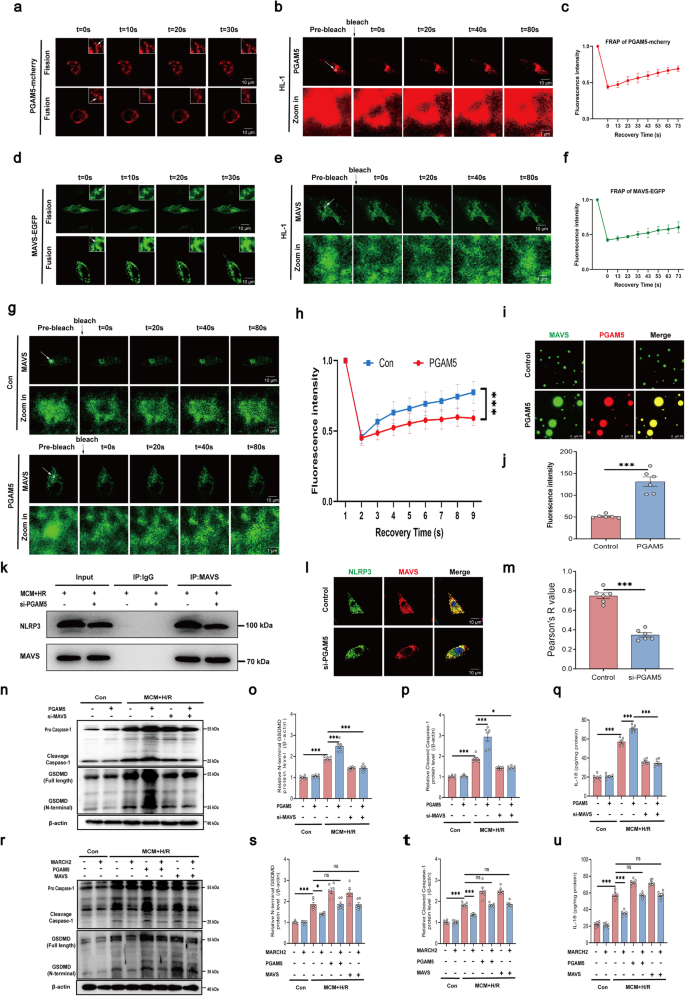
图6 在MCM+H/R攻击下形成的PGAM5–MAVS共聚体,PGAM5促进MAVS依赖性NLRP3活化
7.MARCH2过表达可防止心肌I/R损伤
通过构建病毒载体在心肌细胞中高效表达MARCH2,作者发现与仅使用载体的对照组相比,MARCH2治疗显著提高了小鼠心肌细胞中的MARCH2蛋白水平。这种治疗显著改善了小鼠对I/R损伤的反应,提升了心脏功能,减少了心肌梗死面积,并降低了心脏损伤标志物的水平。MARCH2治疗增加了PGAM5的K48连接泛素化,降低了PGAM5的蛋白水平,增强了线粒体定位的NLRP3和ASC之间的相互作用,并抑制了下游促炎因子IL-18的分泌。这些结果表明MARCH2在心肌I/R损伤治疗中具有巨大潜力。
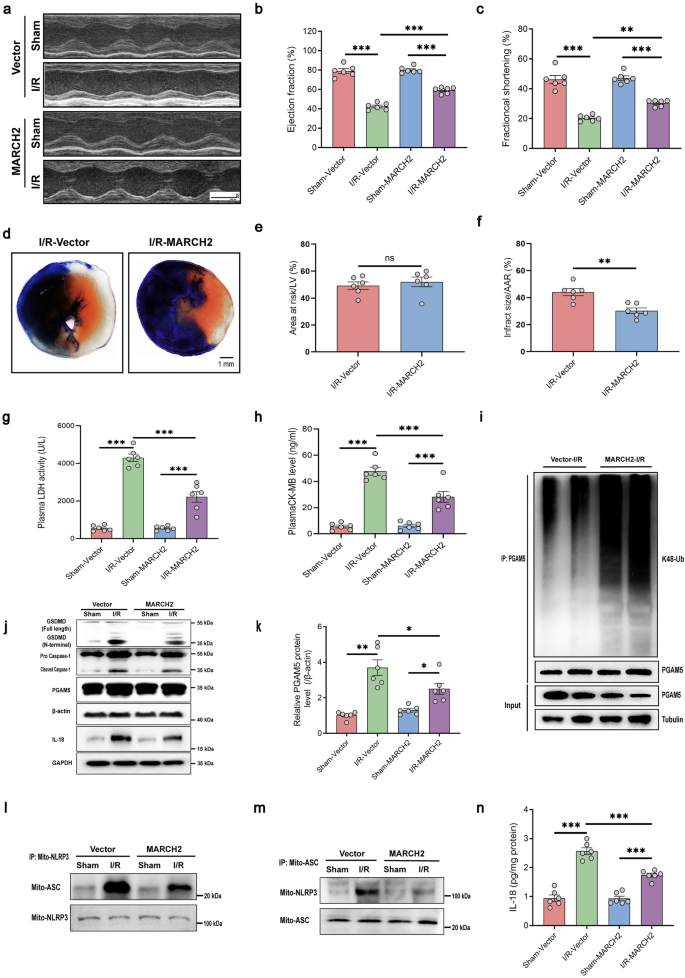
图7 MARCH2过表达通过抑制PGAM5–MAVS-NLRP3炎症小体通路减少I/R损伤并保留心脏功能
8.心脏PGAM5-MAVS信号转导对于MARCH2对心肌I/R损伤的保护作用至关重要
通过RNA干扰技术敲低心肌细胞中的PGAM5,发现MARCH2的心脏保护作用依赖于PGAM5。MARCH2 KO心脏的负面影响在PGAM5敲低时减轻,梗死面积减小,心脏功能改善。同时,心脏损伤标志物LDH和CK-MB的水平明显降低,caspase-1和GSDMD裂解及IL-18分泌减少。稳定表达MARCH2的AAV9病毒载体显著减小I/R诱导的梗死面积,而PGAM5或MAVS过表达则阻断此效果。MARCH2过表达抵消I/R诱导的损伤标志物升高、心脏功能降低及caspase-1、GSDMD裂解增加,但PGAM5和MAVS共表达时保护作用中止。因此,MARCH2通过抑制NLRP3炎症复合物和焦亡,以PGAM5/MAVS依赖性方式保护心肌免受缺血再灌注损伤。
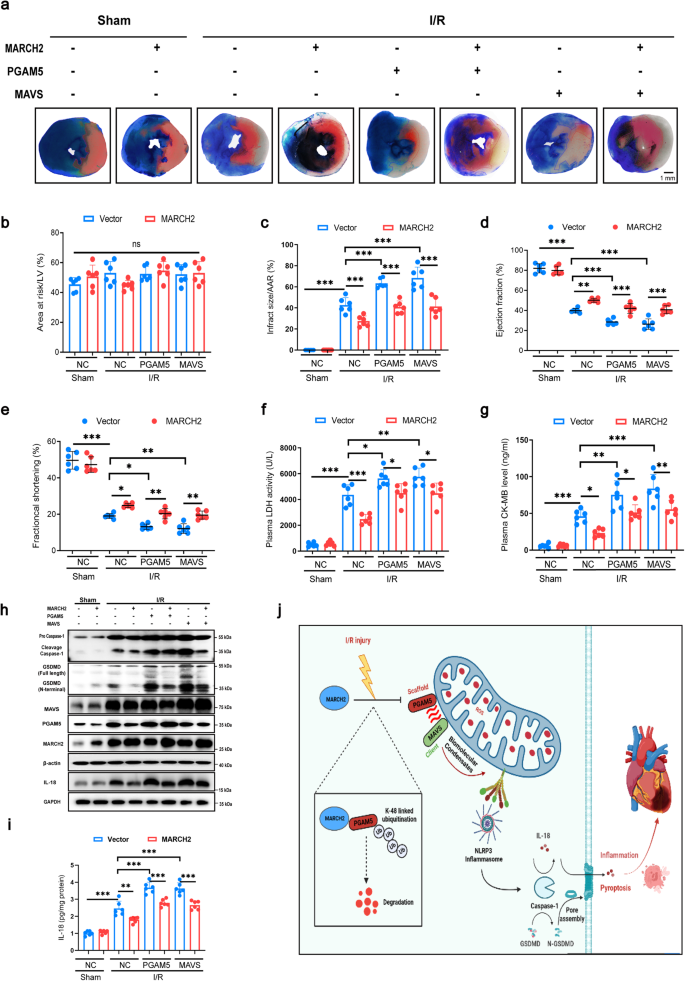
图8 PGAM5/MAVS信号通路对I/R损伤中MARCH2的调节至关重要