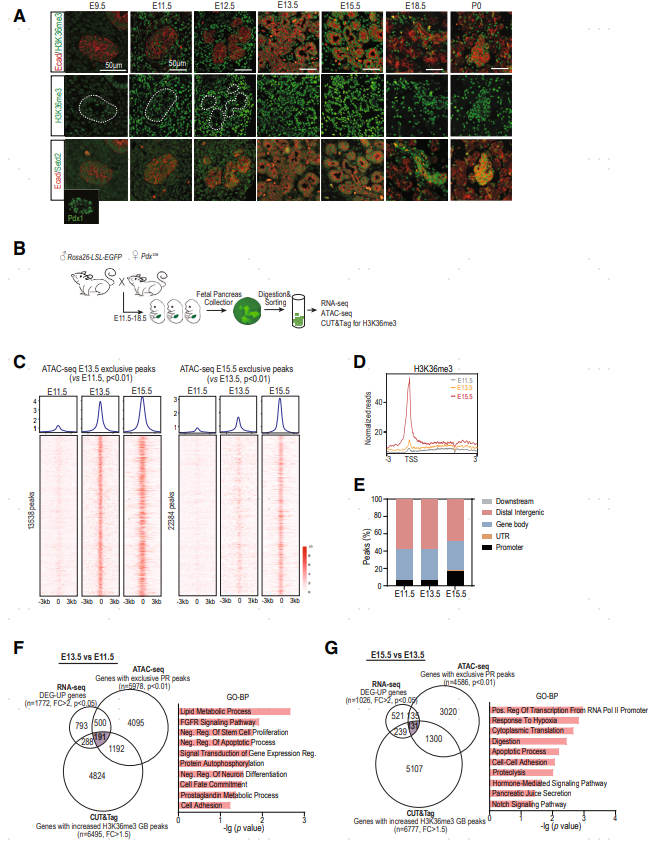
图2. 胰腺器官发生过程中H3K36me3的动态水平和相关转录组谱
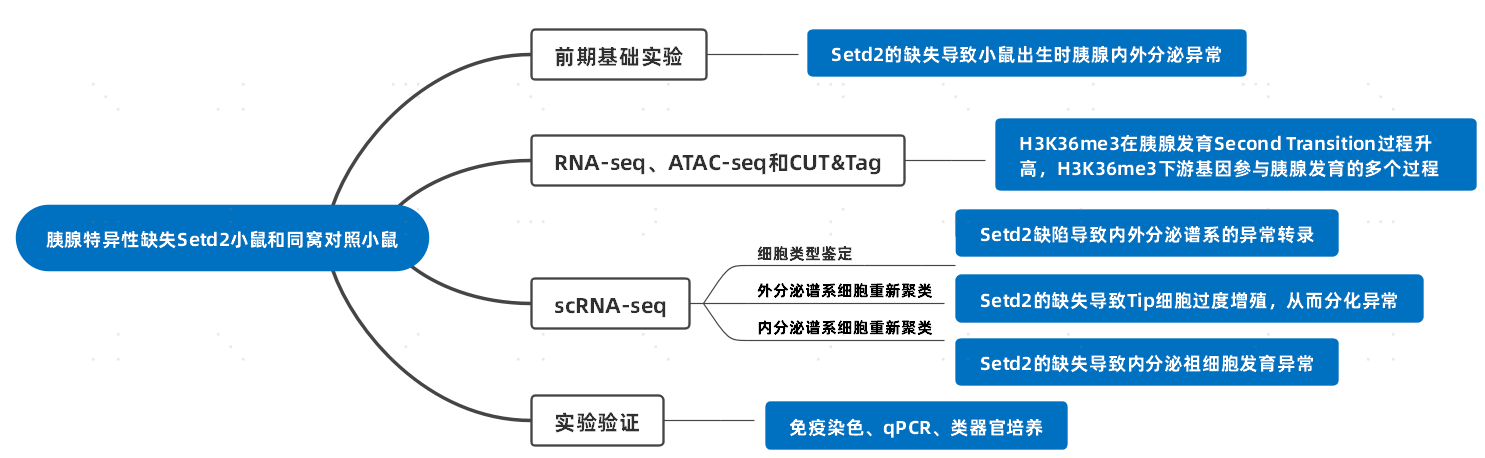
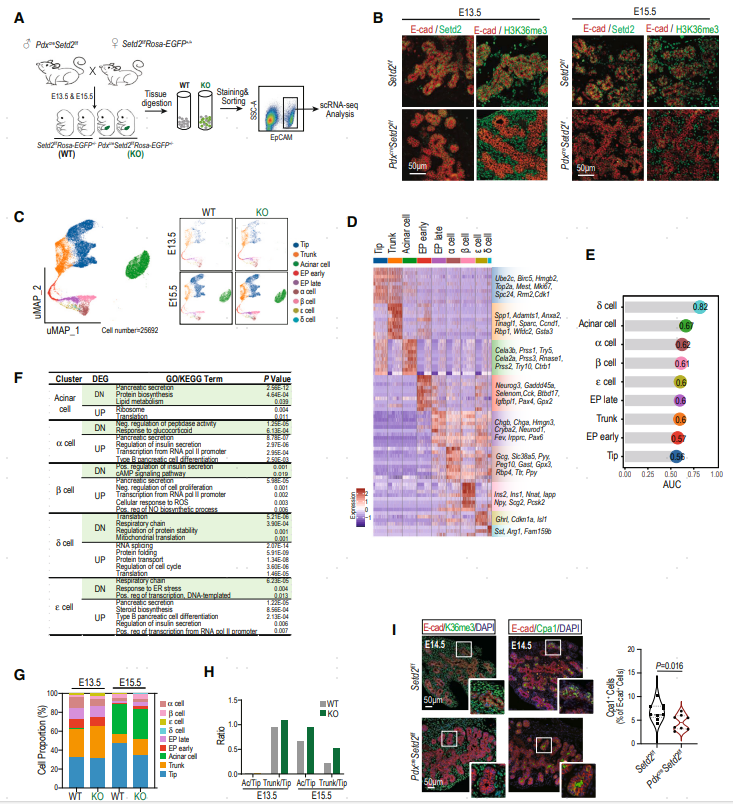
以单细胞分辨率分析胰腺发育Second Transition期间Setd2-H3K36me3缺失的表现。对E13.5和E15.5时期胰腺特异性缺失Setd2小鼠PdxcreSetd2f/fRosa-EGFP+/−(KO)和同窝对照小鼠Setd2f/fRosa-EGFP+/−(WT)的胰腺上皮细胞进行scRNA-seq(图3A)。经过质控后,对获得的25692个细胞进行后续分析。确定了9个不同的细胞群体(图3A-D),包括Tip、Trunk、Acinar(腺泡)、EP early(早期内分泌祖细胞)、EP late(晚期内分泌祖细胞)、α、β、ε和δ细胞。Augur分析显示内外分泌谱系中的终末分化细胞在Second Transition阶段均受到Setd2缺失的影响。WT组和KO组之间终末分化细胞中DEG的GO-KEGG分析进一步说明了Setd2缺失时的功能异常。例如,胰腺分泌和蛋白质合成/折叠过程在腺泡细胞中受损(图3F)。
除了异常转录外,还发现WT组和KO组之间的细胞比例存在差异(图3G)。在Setd2缺陷胰腺中,Tip细胞的比例较低,该现象在E15.5尤其显著。鉴于Tip细胞是胰腺谱系分化的第二个分支节点,即可分化形成Acinar,又能形成Trunk,作者比较了E13.5和E15.5的Acinar/Tip和Trunk/Tip的比例(图3H)。两个比率都增加表明Setd2缺陷胰腺中从Tip到Trunk细胞/Acinar细胞的分化过程加快。免疫荧光染色进一步验证了Tip数量的减少。综上,从单细胞水平证实了Setd2缺陷导致胰腺发育在Second Transition时期出现异常。
图3. scRNA-seq揭示Setd2缺陷导致的内外分泌谱系中的异常转录组谱
4.Setd2的缺乏加速了Tip细胞从静止状态向增殖状态的转变
为进一步研究Setd2缺失对外分泌谱系的变化,对Tip和Acinar细胞进行聚类分群,鉴定了7个亚群(图4A-C)。Tip early亚群仅存在于E13.5阶段,高表达干性相关基因。Tip proliferating 1和Tip proliferating 2亚群都高表达细胞周期相关基因。值得注意的是,Tip early 中同时表达增殖促进基因和抑制基因,提示Tip early的增殖状态受到严格调控。
在Setd2缺陷的胰腺中,E13.5时的Tip early亚群细胞比例下降,同时Tip proliferating 1亚群比例增加。UCell分析显示,在Tip early亚群中,Setd2缺陷组的增殖特征评分更高(图4E)。免疫染色证实在E13.5的Setd2缺陷胰腺中存在更多的Ki67+的Tip 细胞(图4F)。同时,scRNA-seq结果中E15.5时观察到更多增殖的腺泡细胞,这可以解释在Setd2缺陷胰腺中观察到的acinar和pro-acinar(腺泡前体细胞)比率增加的原因(图4D)。Tip early亚群中DEG的功能富集分析显示,Setd2缺陷胰腺中上调增殖相关基因,下调氧化磷酸化(OXPHOS)等干性相关基因(图4G)。
接下来,作者试图确定H3K36me3调节Tip的干性-增殖平衡的直接靶点,筛选到一个关键基因Irf6。在Setd2缺失后,Irf6在Tip early亚群中的水平显著降低(图4K–4L)。为了探讨Irf6的缺失是否模拟了由Setd2缺失引起的干性-增殖失衡,作者分离了E13.5的胰腺上皮细胞,并用小干扰RNA(siRNA)沉默Irf6,然后在类器官系统中培养上皮细胞以评估其干性:Irf6敲低后形成更多和更小的类器官,表型和Setd2缺失时类似(图4M)。qPCR分析进一步验证Irf6水平的降低和增殖相关基因(如Pcna)的上调(图4N)。以上数据说明Setd2-H3K36me3通过Irf6控制Tip细胞的静息-增殖状态的转变,Setd2的缺失导致Tip细胞过度增殖,从而分化异常。
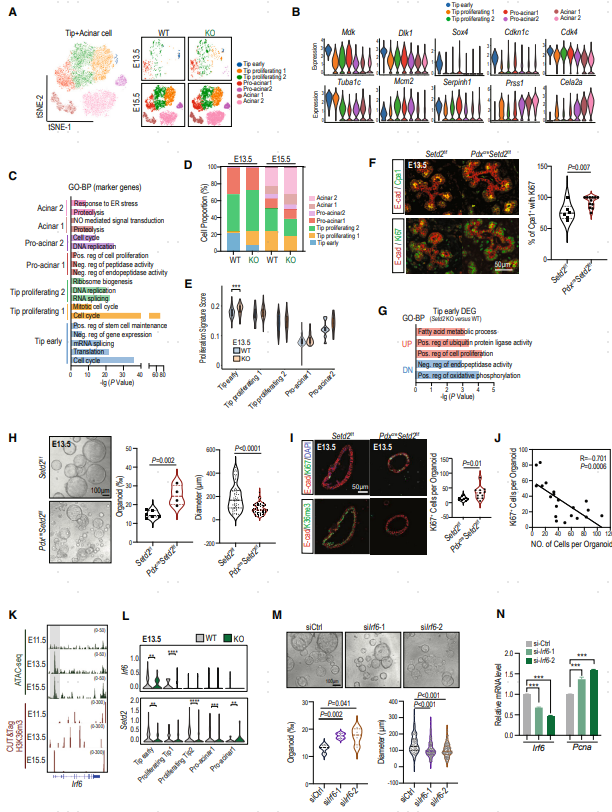
图4. Tip细胞中Setd2的缺乏加速了E13.5期从静止状态向增殖状态的转变
5.Setd2-H3K36me3通过Nkx2.2促进内分泌谱系分化
为了进一步了解Setd2缺失胰腺的内分泌谱系发育异常,作者将EP(内分泌祖细胞)与Trunk进行亚群聚类,分为7个亚群(图5A)。Tip-trunk同时表达Tip标记物(Cpa1)和Trunk标记物(Anxa2和Sox9);Proliferating trunk表达细胞周期相关基因;Trunk-EP表达干细胞维持和Notch信号通路相关的基因,表明其分化潜力(图5B,C)。EP被分为EP1、EP2、EP3和EP4,具有特定的标记基因。考虑到所有EP细胞都来源于Trunk-EP,作者进一步观察到EP1、EP2和EP3与Trunk-EP的比率下降(图5D,E),这表明Setd2缺失损害了EP的形成。
为了寻找Setd2缺失诱导的内分泌发育缺陷的分子机制,作者比较了所有Trunk、Trunk-EP和EP细胞中的DEG(图5F)。如图5F所示,EP中下调的基因与分化、线粒体丙酮酸盐转运、OXPHOS和细胞增殖有关,而上调的基因与Notch信号通路和胚胎发育有关。值得注意的是,在E13.5和E15.5的Setd2缺陷组中,EP的标志物Neurog3(Ngn3)的mRNA水平显著降低(图5G,H)。同样的,免疫共染色证实在E13.5和E15.5阶段,Setd2缺陷胰腺中的Ngn3+细胞显著减少(图5I,J)。
基于之前的CUT&Tag数据集,Ngn3不受H3K36me3的直接调控。为了寻找负责Ngn3+EP形成的H3K36me3直接靶标,取Setd2缺失时总EP中下调的基因和WT胰腺GB区域中H3K36me3富集的基因的交集,鉴定了四个基因(图5K),其中,Nkx2.2是一种重要的TF,在转录水平上促进Ngn3表达。综合基因组学查看器(IGV)证实,在E13.5和E15.5,Nkx2.2在GB上的H3K36me3信号增加(图5L)。在Setd2缺失后,scRNA-seq数据显示Nkx2.2转录水平降低,主要体现在E13.5的所有Trunk和EP亚群中(图5M)。此外,通过免疫染色在E13.5和E15.5胚胎胰腺中进一步验证,Setd2缺失的情况下Nkx2.2蛋白水平下调(图5N)。上述结果证实了Setd2在内分泌谱系分配中的重要作用,至少部分通过调节Nkx2.2来确保Ngn3+EP细胞的适当分化。
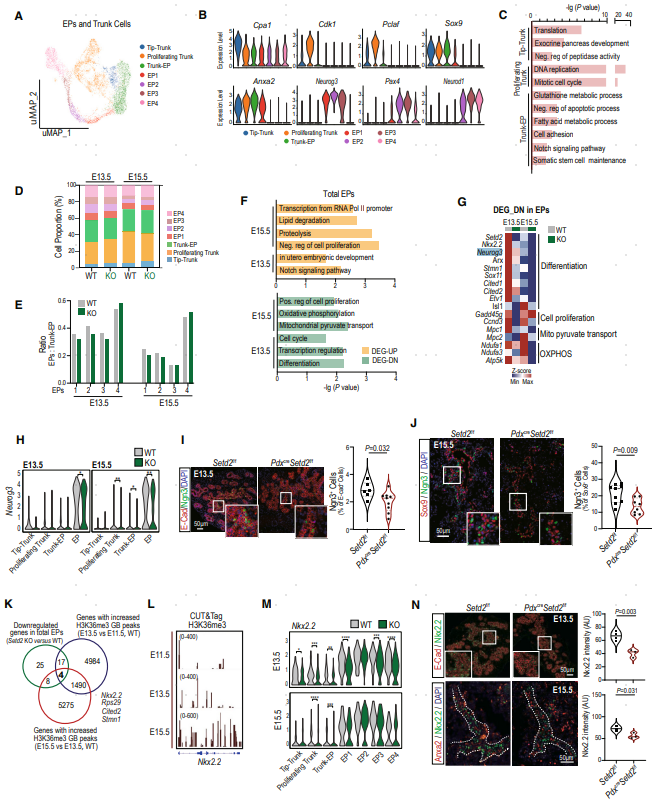
图5. Setd2-H3K36me3通过Nkx2.2促进内分泌调节
结论
本文通过scRNA-seq、CUT&Tag、ATAC-seq和bulk RNA-seq的联合分析,揭示H3K36me3水平从胰腺发育Second Transition开始显著增加。确定胰腺缺失Setd2会导致内外分泌谱系的异常:过度增殖的Tip细胞导致异常分化;Ngn3+内分泌祖细胞由于Nkx2.2的下调而下降,导致内分泌发育不足。本研究确定SETD2是胚胎胰腺发育中的关键参与者,并为理解胰腺疾病中组蛋白修饰的失调提供了线索。
Spatiotemporal role of SETD2-H3K36me3 in murine pancreatic organogenesis. Cell reports; IF:8.8; DOI: 10.1016/j.celrep.2024.113703