图2. 肿瘤细胞克隆进化分析
3.肿瘤细胞的转录异质性
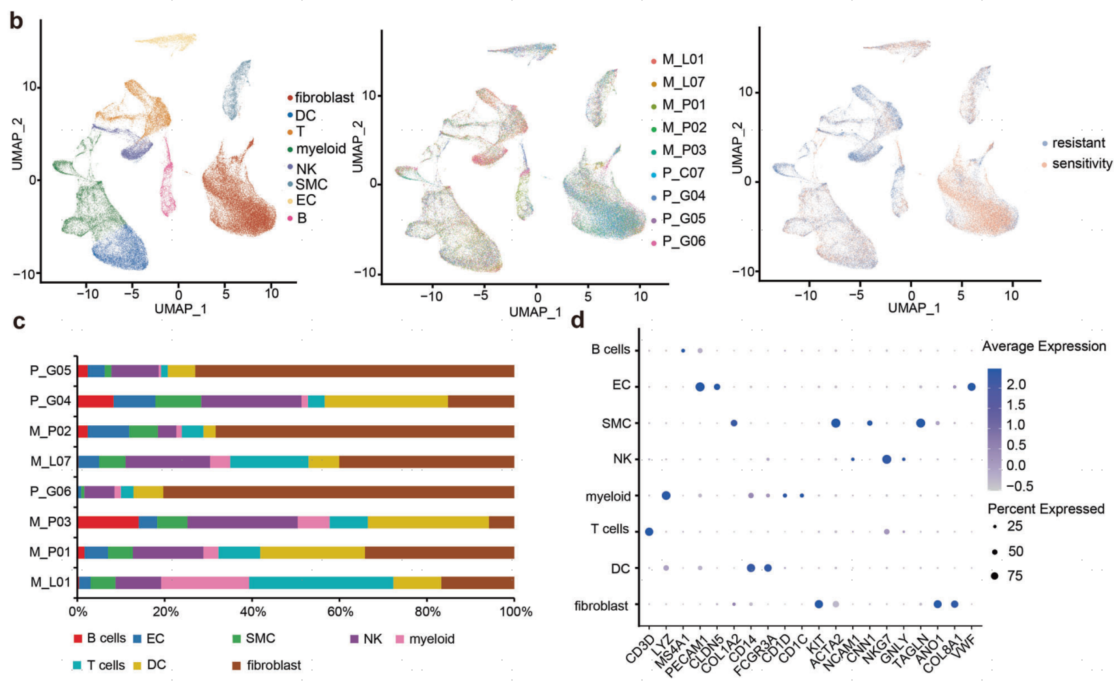
首先,对成纤维细胞重新进行了聚类分群,根据每个亚群的基因表达谱信息,作者将肿瘤细胞分为以下6种类型,包括BASP1_fib、DUSP1_fib、IDO1_fib、KITlow DOG+SMA+_fib、PDGFRA_fib和KIT-_fib,这些细胞在所有样品中都可以观察到(图3a,b)。其中,BASP1_fib和DUSP1_fib是成纤维细胞中分布最多的亚群(图3c)。接着,作者分析了上述所有细胞亚群的功能特征(图3d)。正常细胞KIT-_fib富集了一系列免疫相关的通路,包括单核细胞趋化性、髓系白细胞迁移、髓系白细胞活化和白细胞介导的免疫。BASP1_fib高度富集氧化磷酸化及其途径,而DUSP1_fib和IDO1_fib高度富集糖酵解途径,这表明GIST中的肿瘤细胞经历了不同的代谢重编程。此外,在DUSP1_fib和IDO1_fib细胞中高度富集了细胞死亡相关的通路,而在BASP1_fib细胞中则不富集,这说明肿瘤细胞通过不同的代谢通路所具有的功能也存在显著差异。这些结果提示GIST具有较高的肿瘤内异质性。
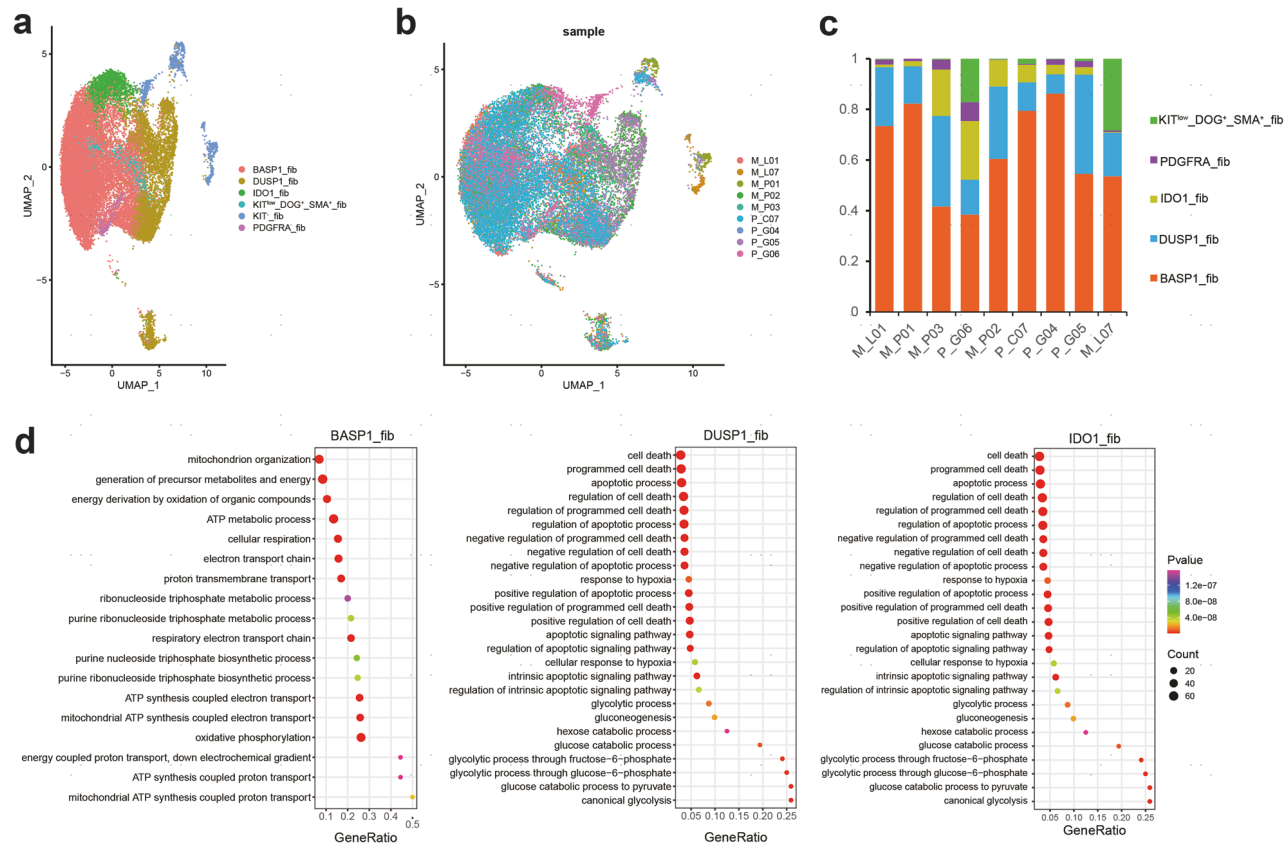
图3. 六种恶性细胞类型的转录特征和异质性
4.GIST的免疫微环境分析
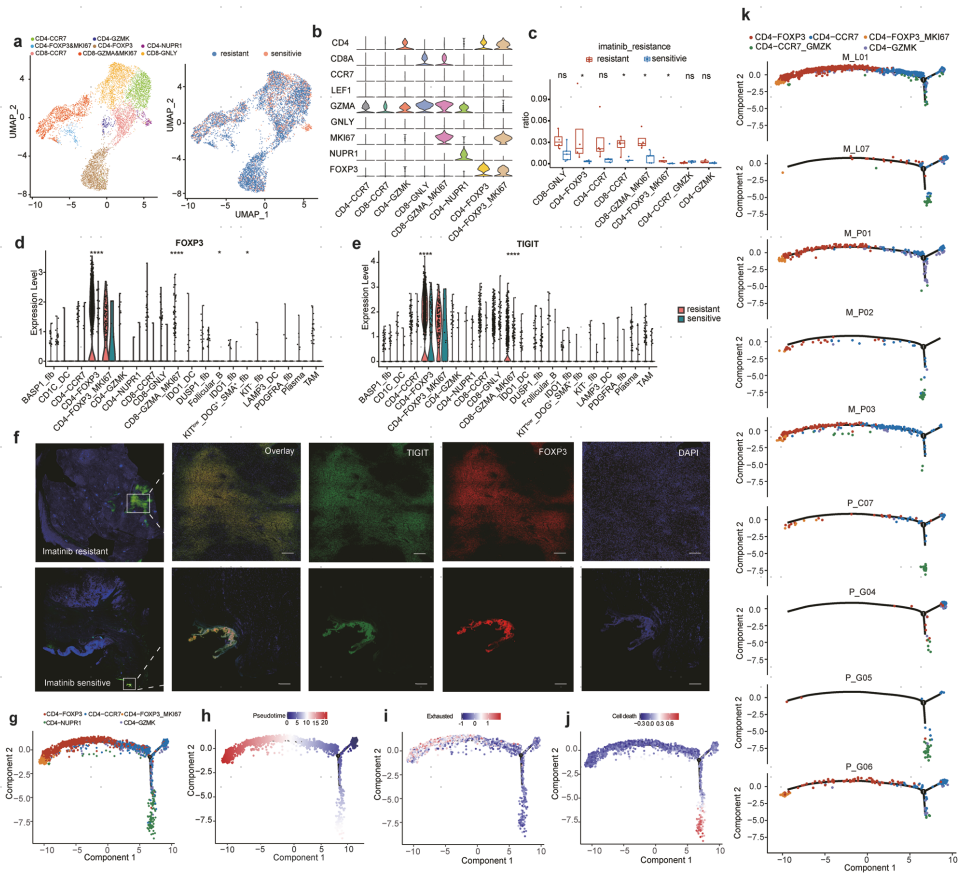
对每个样本的免疫微环境进行探索,以进一步分析GIST中伊马替尼的耐药机制。首先,作者将T细胞分为以下8种亚型:CD4-CCR7、CD4-GZMK、CD4-FOXP3&MKI67、CD4-FOXP3、CD4-NUPR1、CD8-CCR7、CD8-GZMA&MIK67以及CD8-GNLY(图4a,b)。接着,比较了耐药组和敏感组之间的细胞比例差异(图4c)。令人惊讶的是,耐药组的Treg细胞(CD4-FOXP3)比例远高于敏感组,这意味着Treg细胞可能参与了伊马替尼耐药性。此外,在耐药组中,增殖状态的Treg细胞(CD4-FOXP3&MKI67)的比例也显著增加,而细胞毒性CD8 T细胞的数量呈下降趋势。上述结果进一步说明了Treg细胞与伊马替尼耐药性之间的相关性。
基因表达分析结果表明,TIGIT在Treg细胞和增殖的Treg细胞中高度特异性表达,并且TIGIT在耐药组和敏感组的Treg细胞中表现出明显差异表达(图4d,e),该基因是一种参与肿瘤免疫逃逸的免疫检查点基因。通过实验验证后,确定了Treg细胞中标记基因FOXP3的表达显著增加(P<0.05)。作者还通过多色免疫荧光法分析了FOXP3和TIGIT的共表达,并观察到这两个基因在同一细胞中表达(图4f)。
接下来,使用Monocle2进行轨迹推断,分析CD4+ T细胞的免疫状态动态转变和细胞分化关系。结果显示CD4-ccr7细胞处于轨迹路径的起点,称为状态3;轨迹的一个分支末端是CD4-FOXP3和CD4-FOXP3&MKI67细胞,称为状态2,该分支末端细胞具有耗竭特征;另一个分支末端是CD4-NUPR1细胞,称为状态1,该分支末端细胞具有细胞死亡特征(图4g-j)。然后,分析了不同患者的CD4+ T细胞轨迹图。作者发现在状态2中富集的细胞大多来自耐药组(图4k),与Treg细胞和增殖的Treg细胞的高富集一致。这表明naïve T细胞在耐药组中更有可能分化为抑制性Treg细胞,并最终发生凋亡。
图4. T细胞内部的异质性
5.髓系细胞的异质性
接着,作者又分析了髓系细胞,并将其分为4个亚群,包括TAM、IDO1_DC、CD1C_DC和LAMP3_DC,它们都高度表达其标记基因LYZ(图5a,b)。值得注意的是,耐药组中IDO1_DC的比例显著增加,可能与伊马替尼耐药有关(图5c)。作者进行了多色免疫荧光(mIHC)来检测TME中IDO1_DC的分布情况,发现IDO1_DC在伊马替尼耐药TME中的分布远多于在敏感TME中(图5d)。
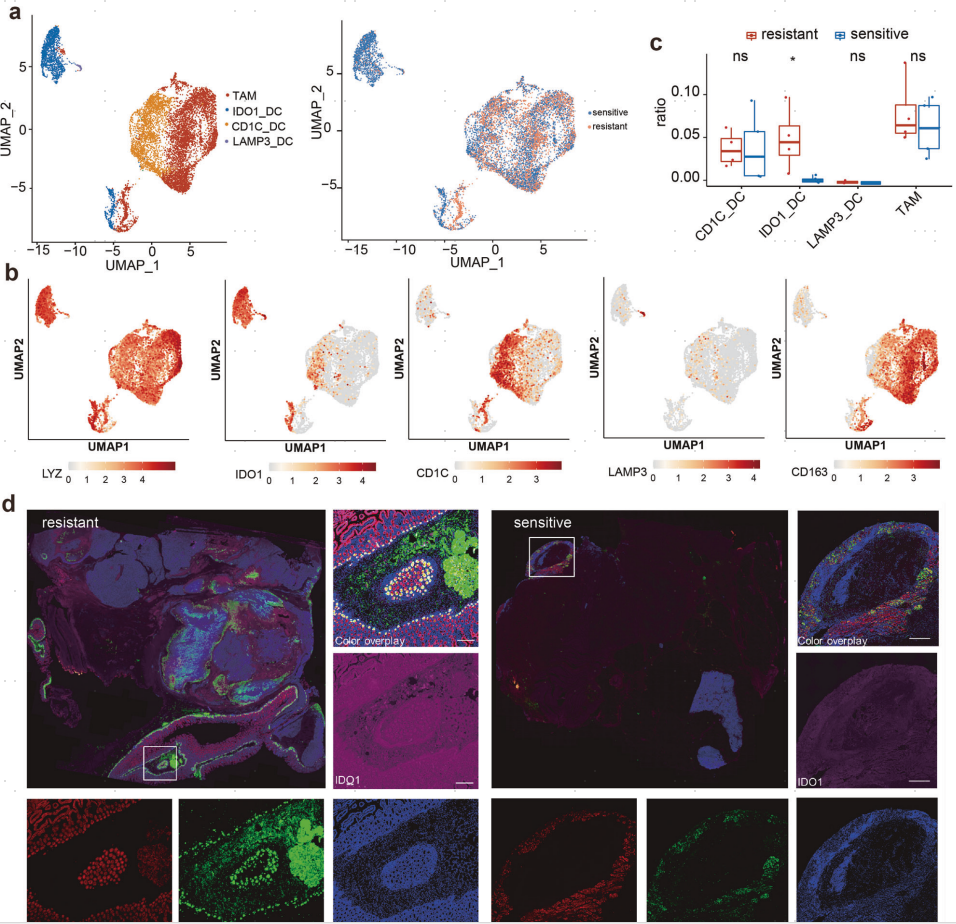
图5. 髓系细胞内的异质性
6.GIST肿瘤微环境中的细胞间通讯
通过分析细胞间通讯来探讨GIST中伊马替尼耐药性的分子机制。作者研究了耐药组和敏感组间不同肿瘤细胞亚群的通讯差异。结果显示,在耐药组中存在PDGFRA_fib、BASP1_fib、DUSP1_fib和IDO1_fib四个亚群,它们通过TIGIT-NECTIN2与Treg细胞和增殖Treg细胞进行细胞间通讯;而在敏感组中,只有BASP1_fib和IDO1_fib与Treg存在弱通讯。此外,在耐药组中,IDO1_DC和髓系细胞之间通过BTLA-TNFRSF14发生细胞间通讯,这在敏感组中并不显著(图6a)。在耐药组中,NECTIN2在肿瘤细胞和LAMP3_DC中高表达(图6b);BTLA在IDO1_DC中高度表达(图6c);TNFRSF14在髓系细胞和肿瘤细胞中高度表达,尤其是在伊马替尼耐药患者中(图6d)。上述基因对的表达表明免疫检查点通路的激活参与了伊马替尼耐药。临床样本的免疫组化分析也证实了这些患者免疫检查点蛋白的表达增加(图6e)。
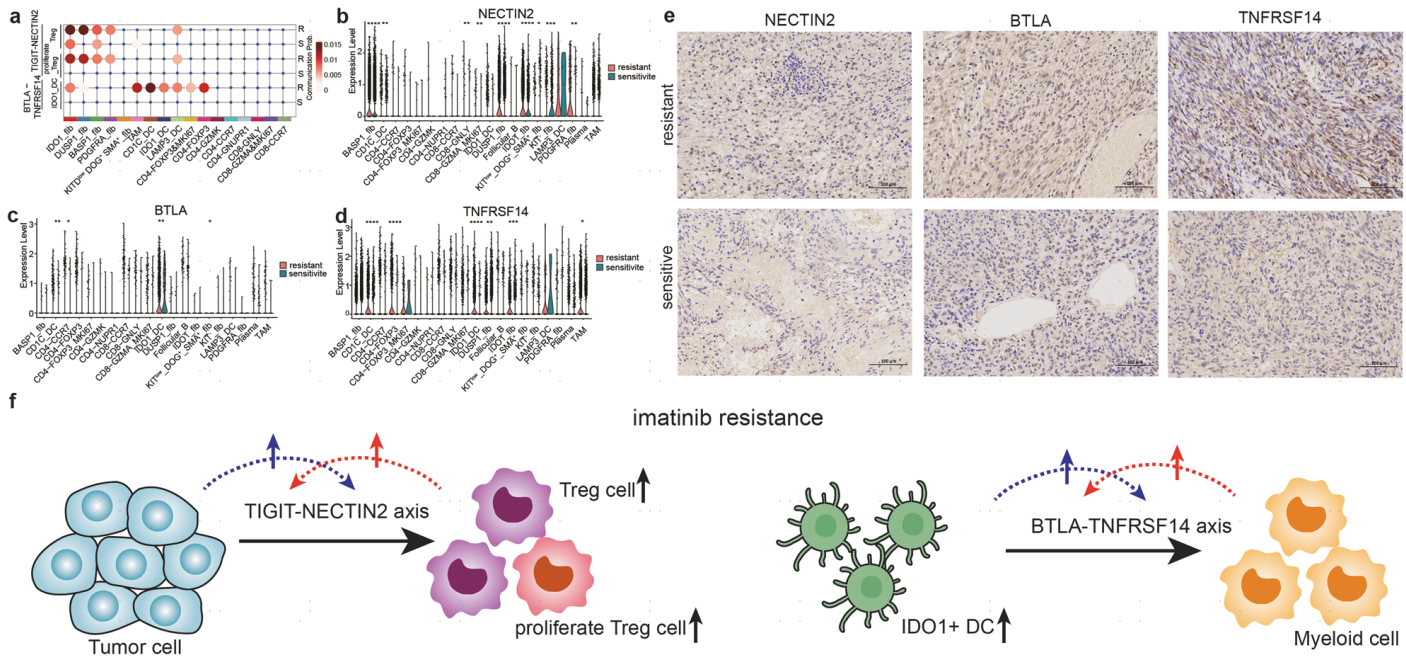
图6. 伊马替尼耐药的综合免疫抑制机制