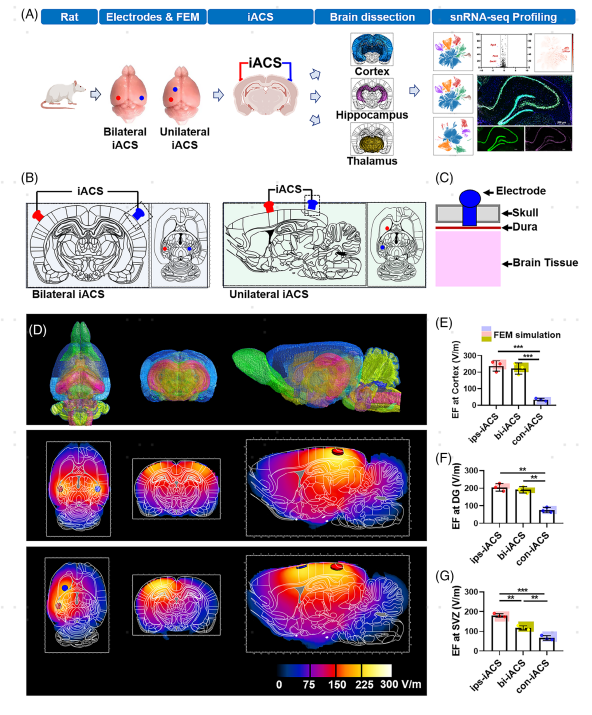
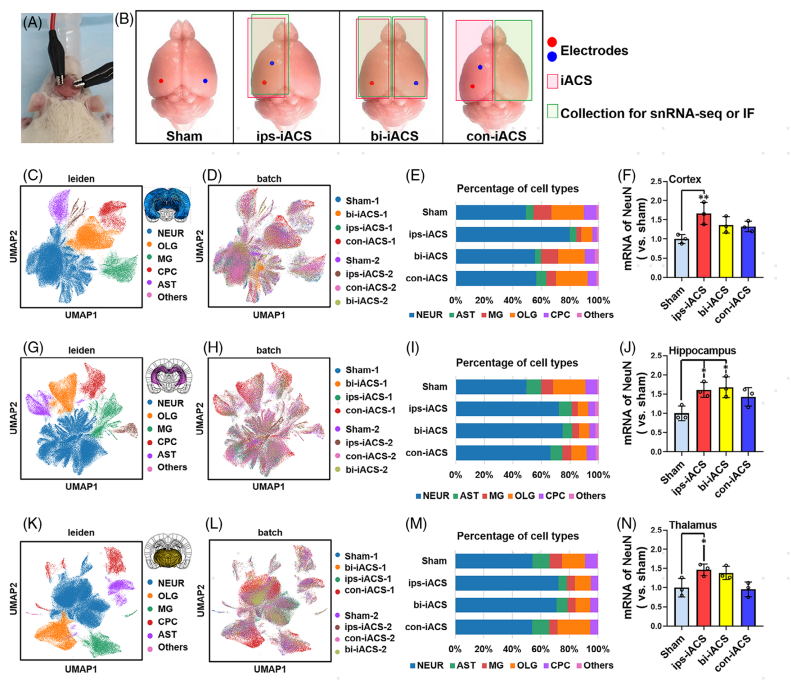
图2 iACS治疗的大鼠皮层、海马体和丘脑的snRNA-seq分析
3.iACS增强了神经元群
结合皮层样本的snRNA-seq、real-time PCR和免疫荧光分析的结果,ips-iACS在增加皮层神经元方面最有效。同时,任何iACS方案对神经胶质细胞均未发现显着或规律的变化(图2E-F,图3A-D)。海马样本中的snRNA-seq、real-time PCR和免疫荧光分析表明,ips-iACS和bi-iACS在增加海马神经元数量方面非常有效。而con-iACS对神经元增加没有表现出显着影响。此外,与在皮层中的观察类似,没有一个iACS方案显示出对海马体神经胶质细胞的显着影响(图2I-J, 图3E-H)。丘脑中通过snRNA-seq、real-time PCR和免疫荧光分析的结果表明证实,ips-iACS对丘脑中神经元的诱导作用较弱,此外,三种iACS治疗对丘脑中的其他细胞类型表现出不规则的影响。综上,说明神经元是所有三个大脑区域(皮层、海马体和丘脑)对iACS做出反应的主要细胞类型。
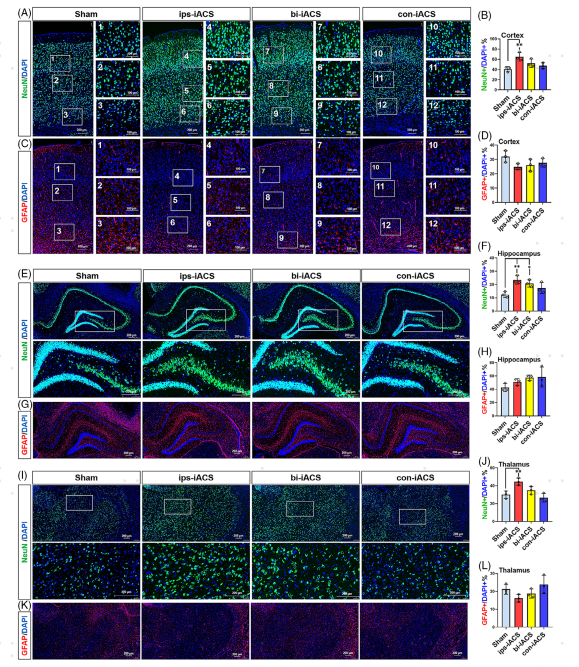
图3 iACS大鼠皮层、海马体和丘脑中神经元和神经胶质细胞的免疫荧光
4.神经元中的Rgs9受iACS负调控
当神经元被确定为对ips-iACS和其他iACS方案最敏感的细胞类型时,作者接下来对神经元进行亚群细分,并分别在皮层、海马体和丘脑中比较ips-iACS的神经元与sham组神经元的差异表达基因。其中,三个大脑区域都发现了Rgs9基因的显著下调。将Rgs9高表达的亚群定义为Rgs9+神经元细胞。对细胞比例观察发现Rgs9+神经元细胞,在三个大脑区域的ips-iACS处理后细胞比例显著下调,且在皮层中下降最多。实时荧光定量PCR结果一致显示,在iACS治疗后,皮层、海马体和丘脑的Rgs9表达降低(图4)。通过免疫荧光进一步证实了Rgs9+神经元比例的衰减(图5)。综上所述,在响应ips-iACS时观察到Rgs9表达最显着的降低。Rgs9表达减少在皮层减少幅度最大,其次海马体,最后是丘脑。这一趋势表明与iACS产生的脑内源性EF的强度相关,表明对EF强度的依赖性。
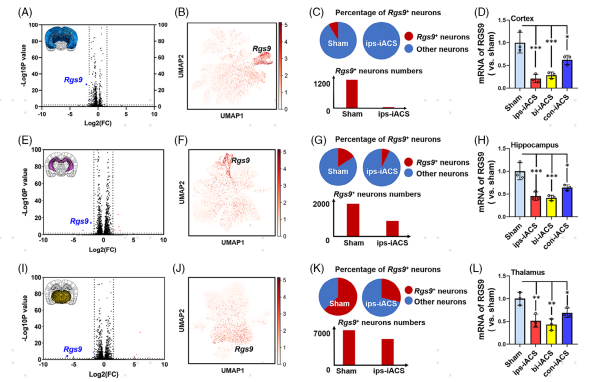
图4 iACS治疗对Rgs9基因表达的差异
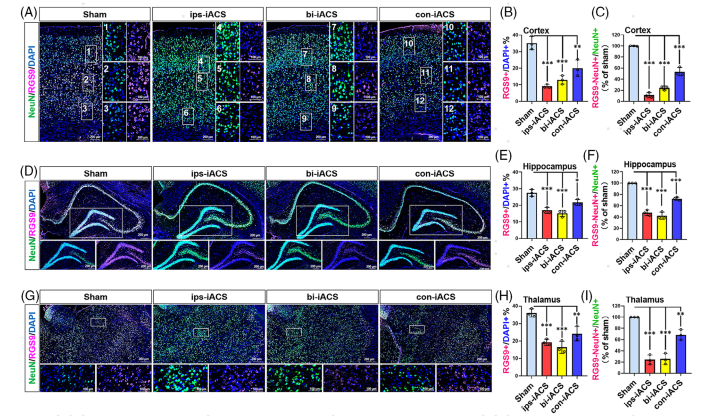
图5 iACS治疗的大鼠大脑中Rgs9+神经元的免疫荧光
5.iACS诱导神经元中的Rgs9信号传导
当Rgs9被确定为神经元中对iACS有反应的关键基因时,接下来对皮层、海马体和丘脑内Rgs9阳性神经元中上调的基因的通路富集进行了分析。GO分析发现Rgs9与神经元分化、成熟和对苯丙胺、吗啡和尼古丁等物质的药物反应过程有关(图6A-C)。通过分析皮层组织样本中的蛋白质表达,进一步检查了与iACS下调Rgs9相关的进一步细胞内信号转导,结果显示ips-iACS处理后Rgs9的减少最显着,而β-catenin通路则被激活(图6D-H)。随着Rgs9在RNA水平上的下调,RGS9的蛋白表达也被检测到下调,R7BP和Gβ5两种蛋白被认为是RGS9/R7BP/Gβ5复合物的另外两个成员,没有发生显著的变化(图6D,E)。结果表明,iACS可以负调控Rgs9的表达,进而影响RGS9/R7BP/Gβ5复合物的功能,然而,iACS不直接影响复合物的R7BP或Gβ5组分;另一方面,iACS通过下调Rgs9触发β-catenin激活。这两种信号都为iACS治疗的大脑中的神经元富集提供了另一种潜在的解释。
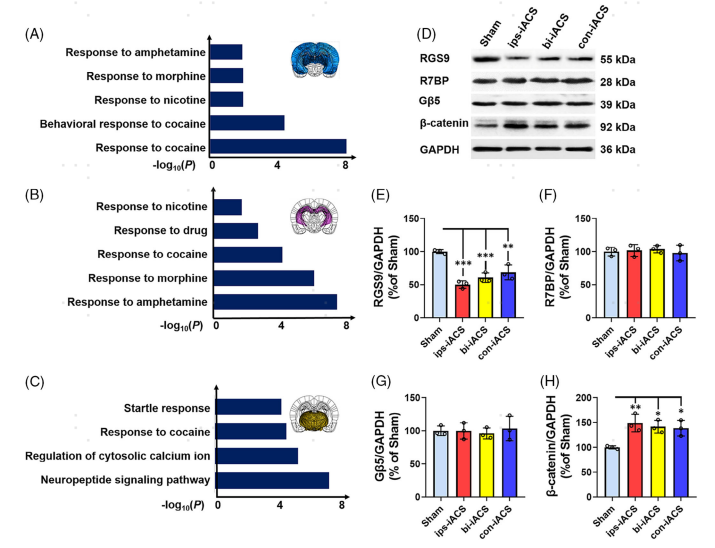
图6 TAM_SPP1高表达MMP9,在CK19 + HCC中特异性富集且代表不良的预后