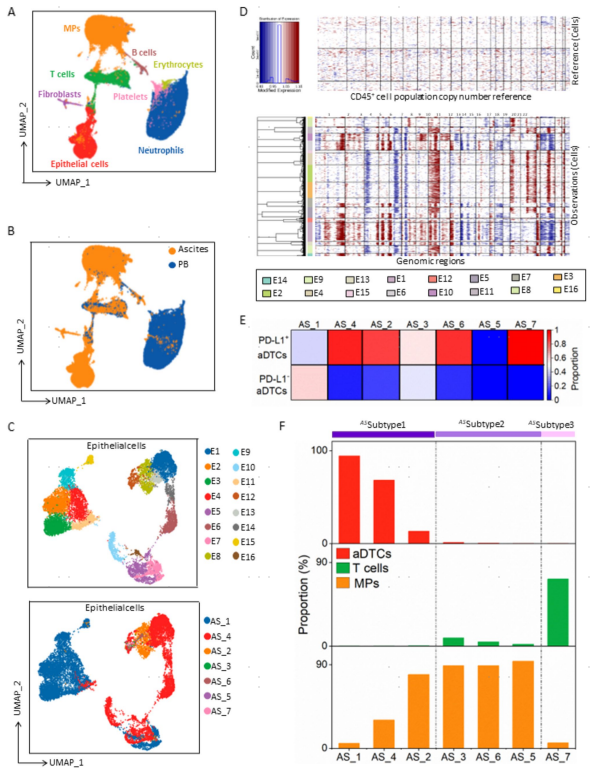
图2. 患者治疗前基线阶段腹水和配对外周血样本的scRNA-seq结果
3.腹水中TAMs发生从CTShigh TAM谱系到C1Qhigh TAM谱系的连续动态演变
巨噬细胞在维持腹腔内免疫环境稳态方面发挥着关键作用。在ASSubtype 1腹水中,巨噬细胞在MPs中占比最高(图3a,b),且巨噬细胞抗炎相关基因表达上调,提示巨噬细胞发挥免疫抑制功能。因此,将巨噬细胞注释为TAMs(图3c)。进一步对TAMs进行亚群细分,依据C1Q相关基因(C1QA、C1QB和C1QC)和CTS相关基因(CTSA、CTSD和CTSL)异质性表达模式,将TAMs分为三个谱系:CTShigh/C1Qhigh(Macro 6)、CTSlow/C1Qhigh(Macro 3和Macro 2)和CTShigh/C1Qlow(Macro 1、Macro 4和Macro 5)(图3e)。使用Monocle 2分析TAMs谱系发育轨迹(图3f)。TAMs的分化始于CTShigh/C1Qhigh,中段分化为CTShigh TAMs谱系(Macro 1、4和5)。C1Qhigh TAM谱系(Macro 2和3)仅在终端阶段发育(图3g)。基于拟时序发育轨迹分析TAMs分化过程中基因表达情况,结果显示,C1Q基因在较晚期阶段升高。CTS基因在早中期阶段表达上调(图3h)。
以上结果支持这样的观点:腹水微环境中TAMs经历了从CTShigh亚型到C1Qhigh亚型的谱系转变(CTS-to-C1Q transition),并且CTShigh谱系是TAMs前体,最终向C1Qhigh谱系分化。
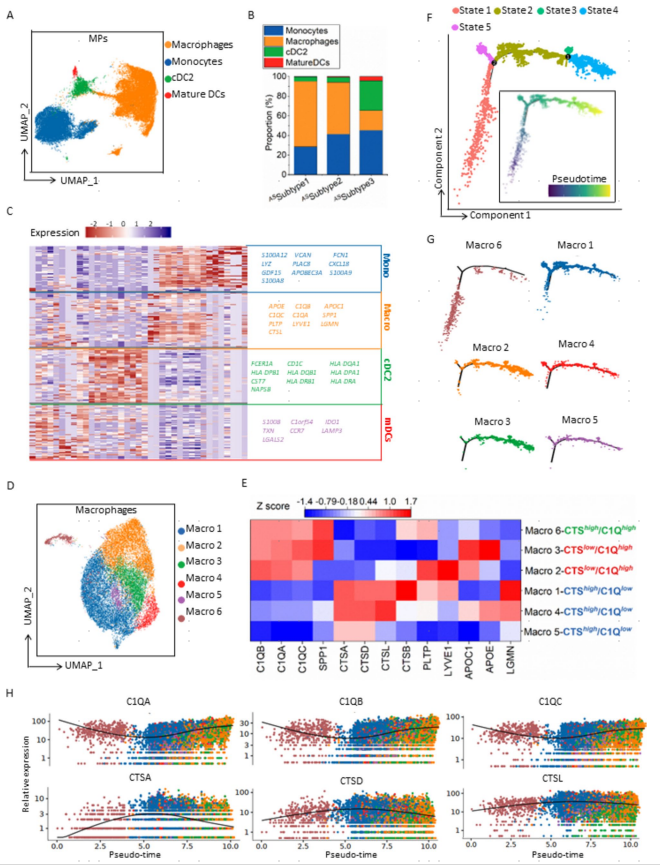
图3. 患者基线阶段腹水样本scRNA-seq的腹水TAMs分析结果
4. TAMs从CTShigh TAMs到C1Qhigh TAMs的转变在转移的不同阶段发挥调节作用
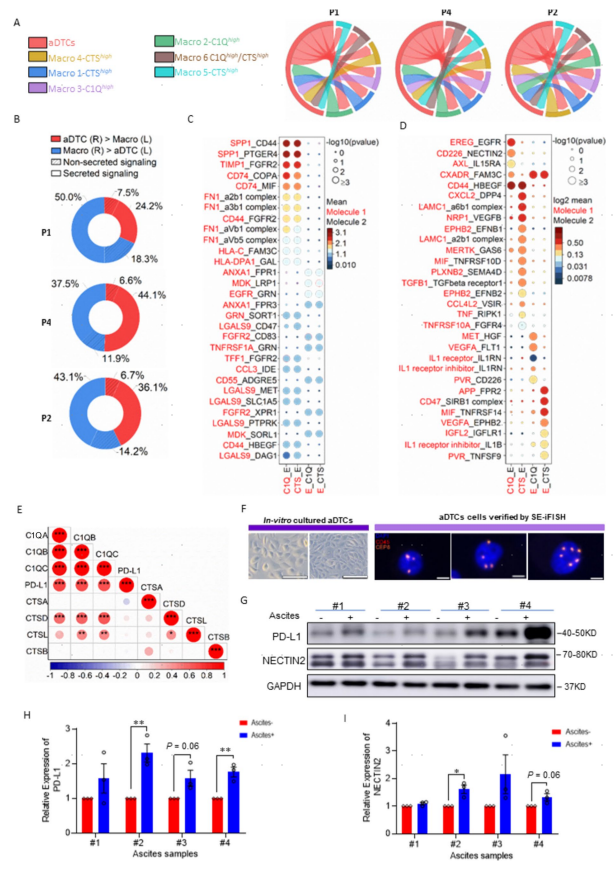
使用cell-PhoneDB分析了ASSubtype 1型腹水中TAMs和aDTCs之间的细胞通信情况。结果显示,aDTCs与CTShigh(Macro 1)和C1Qhigh(Macro 2)谱系的相互作用强度和类型相当(图4a)。CTShigh和C1Qhigh TAMs主要通过分泌参与肿瘤细胞转移增殖相关基因(SPP1、FN1、TIMP1、CD74、CXCL2、LAMC1、NRP1、EPHB2、EGFR)与aDTCs发生免疫抑制相互作用(图4c,d)。研究者提出,CTShigh TAMs可能在aDTCs转移的早期阶段,塑造肿瘤转移前TME并招募aDTCs进入腹水,而CTShigh到C1Qhigh TAMs的转变则调控和维持定植的aDTCs过度增殖。
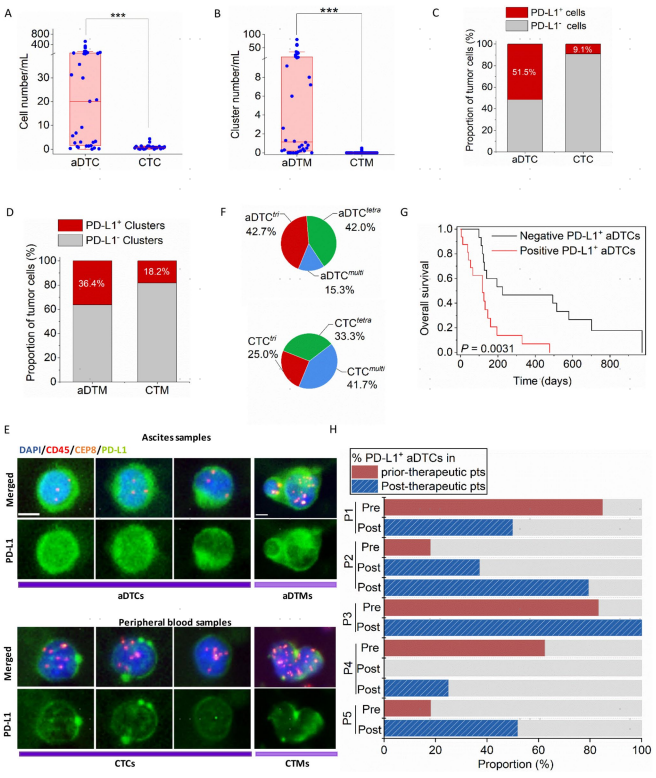
接下来,进一步探讨C1Qhigh TAMs在腹膜转移增殖阶段如何驱动aDTCs发生免疫逃逸。通过分析TCGA数据库中48个转移性胃癌患者的RNA-seq数据,注意到C1Q相关基因,而不是CTS相关基因与PD-L1表达水平呈正相关(图4e)。此外,在体外培养了8例PM-GC患者腹水来源的aDTCs与胃癌细胞系进行共培养(图4f)。腹水上清液的处理显著增强了aDTCs中PD-L1和NECTIN2表达(图4g,h)。表明C1Qhigh TAMs驱动处于转移增殖期的aDTCs上PD-L1的表达上调,促进其发生免疫逃逸。
图4. C1Qhigh TAMs介导aDTCs中PD-L1和NECTIN2基因的上调表达
5. C1Qhigh TAMs通过补体蛋白C1q驱动aDTCs中PD-L1的上调表达
作者利用ELISA检测了SE-iFISH队列腹水样本的上清中相关补体分子丰度,结果显示,腹水中C1q和C3的表达水平都与表达PD-L1阳性的aDTCs和aDTMs的细胞数量呈正相关(图5d),表明适当的经典补体途径的激活是aDTCs中PD-L1上调的基础。进一步通过生物素连接酶TurboID标记系统证实C1q蛋白和腹水肿瘤细胞之间的直接相互作用(图5e-h)。此外,通过细胞共培养实验确认C1q蛋白可以进一步增强aDTCs中PD-L1和NECTIN2的上调(图5i-k)。证实了巨噬细胞特异性分泌的C1q补体介导补体途径的激活,参与PD-L1和NECTIN2的上调,从而促进PM-GC患者中aDTCs的免疫逃逸。
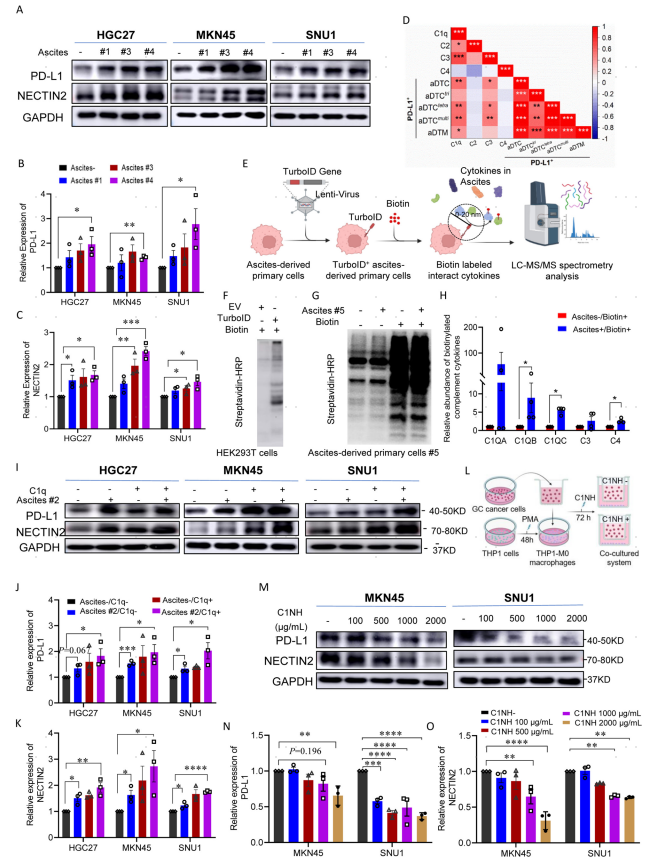
图5. C1Q参与aDTCs中PD-L1和NECTIN2上调
6.CTShigh TAM到C1Qhigh TAM的转变促进PM-GC患者的治疗耐药性
为确定TAMs的CTS-to-C1Q转变是否会导致PM-GC患者的治疗耐药,研究者对8名PM-GC患者治疗前和治疗后耐药的腹水样本进行了scRNA-seq。比较治疗前后的TAMs谱系,鉴定到治疗耐药性(TR)的Macro 4和治疗敏感性(TS)的Macro 5(图6b,c)。
接下来,研究者探讨了C1Qhigh TR TAMs是否从CTShigh谱系转变而来,从而导致患者治疗耐药。Monocle 2分析TAMs的分化轨迹。治疗敏感性的Macro 5在发育初始阶段占主导地位(图6f中的State 1)。在治疗耐药后,Macro 5分化为TR TAMs谱系Macro 4(图6f和g)。进一步观察TAMs谱系发育过程中C1Q和CTS基因的表达变化。CTS基因在拟时间初期表达水平较高,此时TS谱系占主导地位。然而,随着时间的推移,当发展为TR TAMs谱系时,CTS相关基因的过表达逐渐转变为C1Q相关基因的过表达(图6h)。以上结果表明TAMs从CTShigh到C1Qhigh的转变促进了PM-GC患者治疗抵抗性和肿瘤进展。
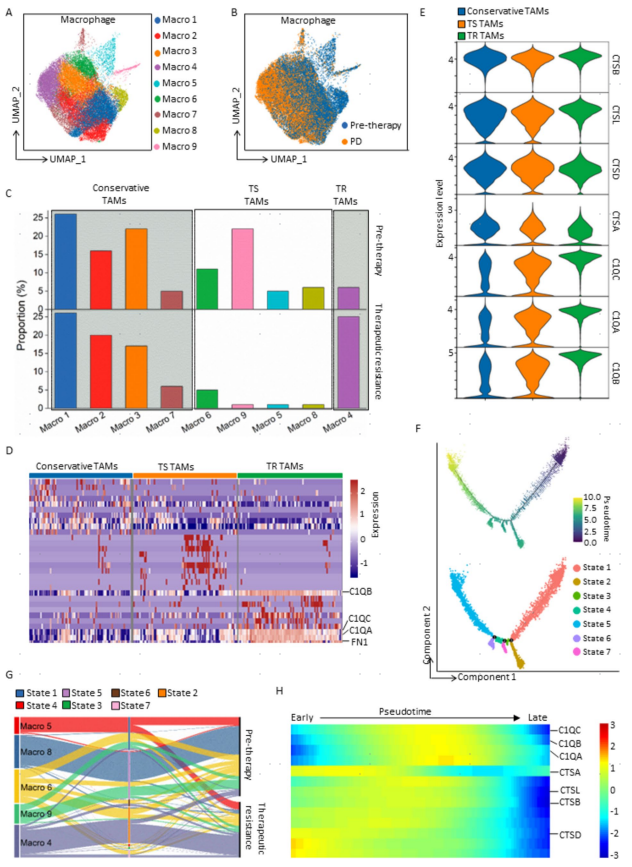
图6. PM-GC患者治疗前和治疗后耐药性腹水中TAMs的scRNA-seq分析