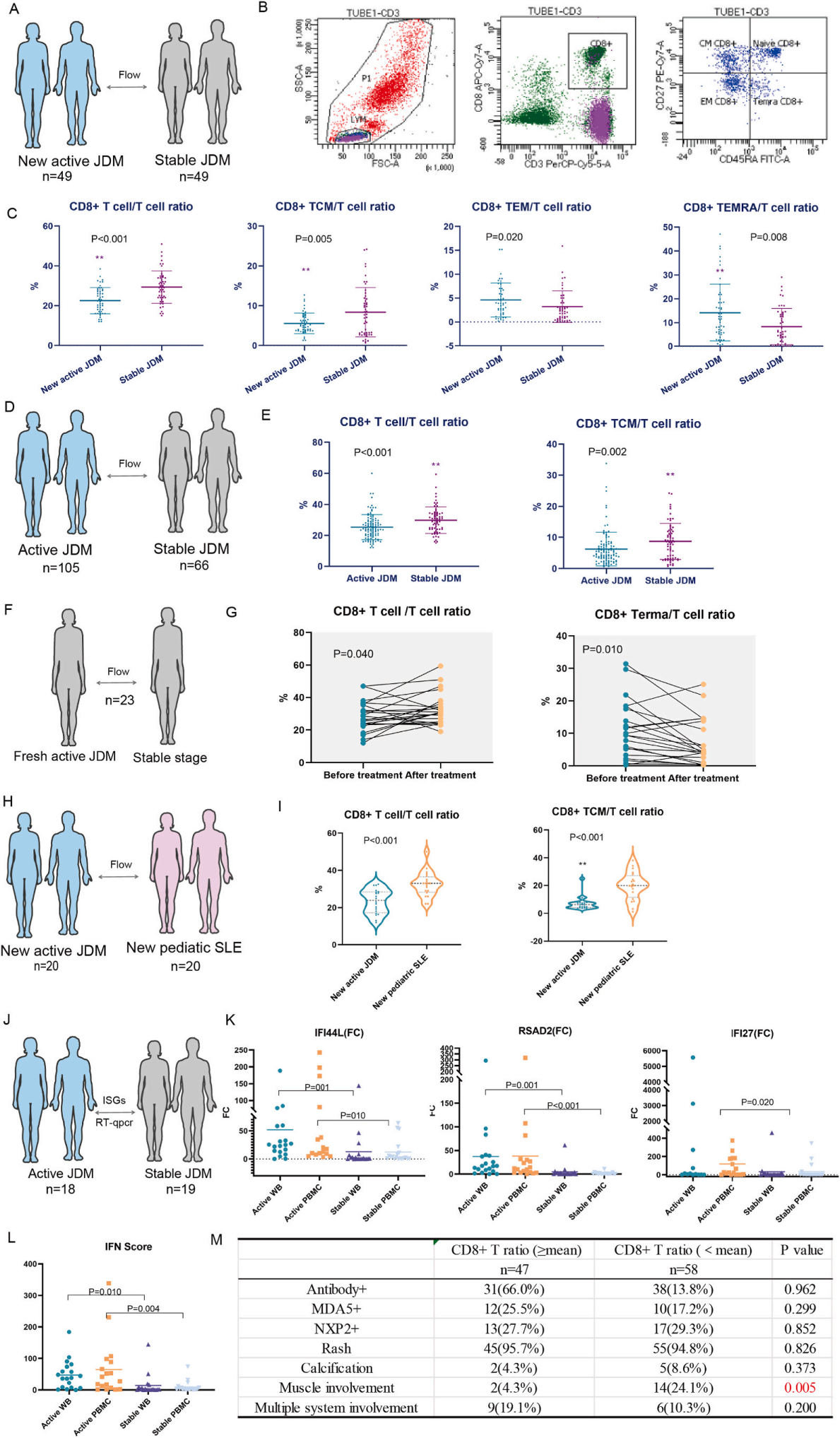
图2 活动期JDM患者的骨骼肌病理
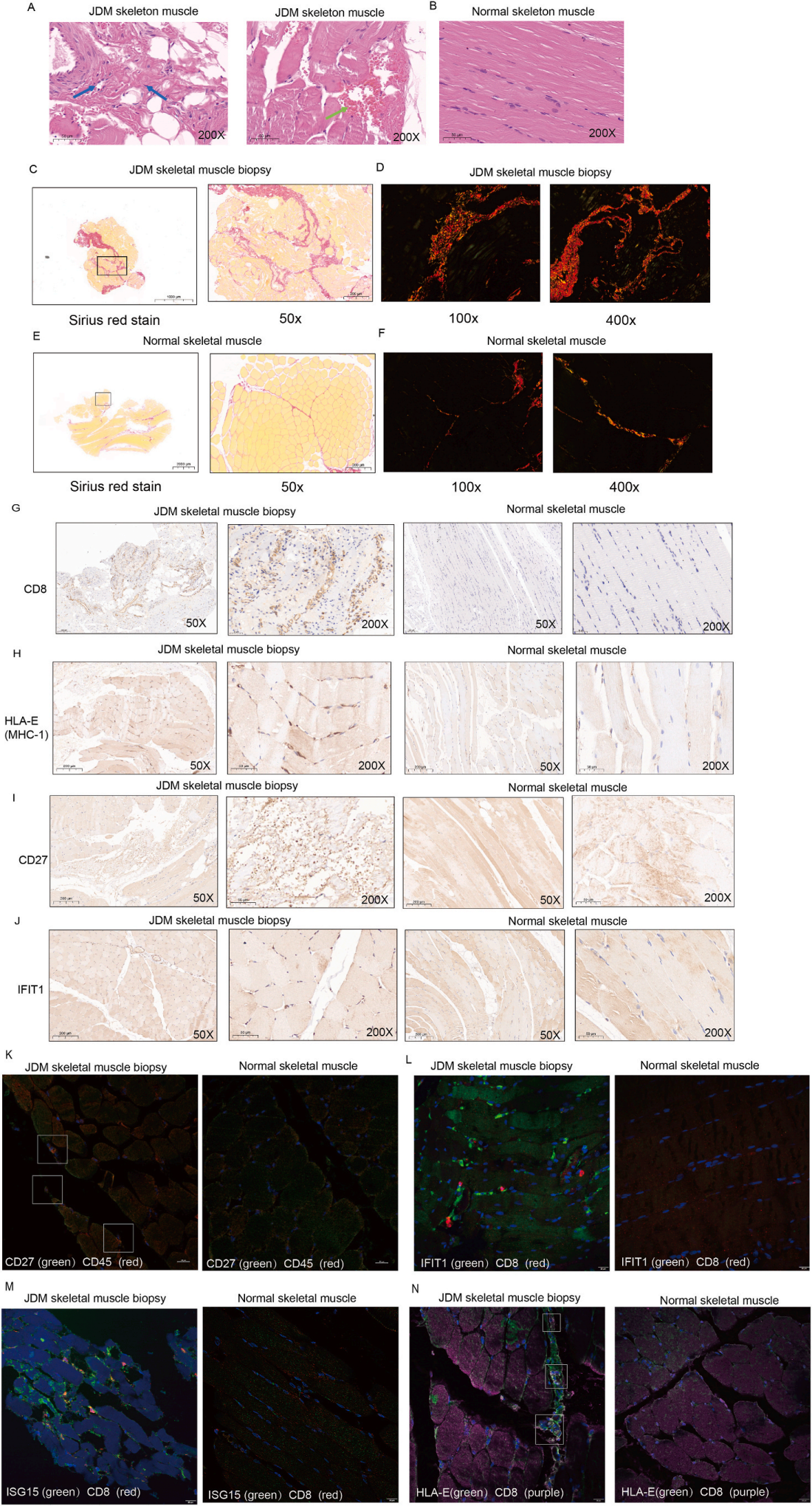
3.单细胞转录组测序揭示I型IFN是活动期JDM患者CD8+ T细胞分化改变的驱动因素
取6例活动性JDM患者、3例稳定期JDM患者和3例年龄匹配的健康儿童PBMC进行单细胞RNA测序,细胞聚类注释得到10种不同细胞类型:T细胞、B细胞、NK细胞、中性粒细胞、中性粒祖细胞、嗜碱性粒细胞、增殖细胞、浆细胞、pDC和单核细胞。组间差异分析发现与稳定期JDM患者和对照组相比,活动期JDM患者的T细胞倾向于表现出I型IFN反应的升高。
将T细胞细分注释得到7种细胞类型:CD8+ naive T细胞、CD4+ naive T细胞、CD8+ Teff细胞、GDT细胞、Treg细胞和ILC3细胞。与流式结果一致,活动期JDM患者的CD8+ naive T细胞比例高于其他组。然后研究者进一步对CD8+ T细胞进行了无监督聚类,得到3个CD8+ naive T亚群和4个CD8+ Teff亚群。与稳定的JDM患者和对照相比,活动期JDM患者CD8+ naive T_2和CD8+ Teff_4亚群比例较高。这两个亚群的差异基因,如IFI44L、ISG15、RSAD2、IFIT3、MX1和IFI6,属于I型IFN下游的ISG。因此研究者假设I型IFN与活动期JDM患者CD8+ T细胞的异常分化有关。
对7个CD8+ T细胞簇的Cytotrace评分,分析CD8+ naive T_2具有最显著的分化潜能,以这一簇为起点,对所有CD8+ T细胞进行了monocle分析,其中CD8+ Teff Cluster 4分布在拟时间轴的末端。通过GeneSwitches分析,研究了从起源到state1的驱动基因。在CD8+ naive T细胞的发育过程中,部分基因如IFIT1、RSAD2、IFI44L的表达随着发育逐渐降低,这些基因是典型的I型IFN刺激基因。通路富集分析显示,下调通路主要富集在感染和I型干扰素相关通路。类似地,state6也进行了GeneSwitches分析。结果显示,CD8+ Teff细胞需要上调ISG15、IFI6、MX1和IFI44L等基因才能进入state6。这些结果提示I型IFN是活动性JDM患者CD8+ T细胞异常分化的驱动因素。
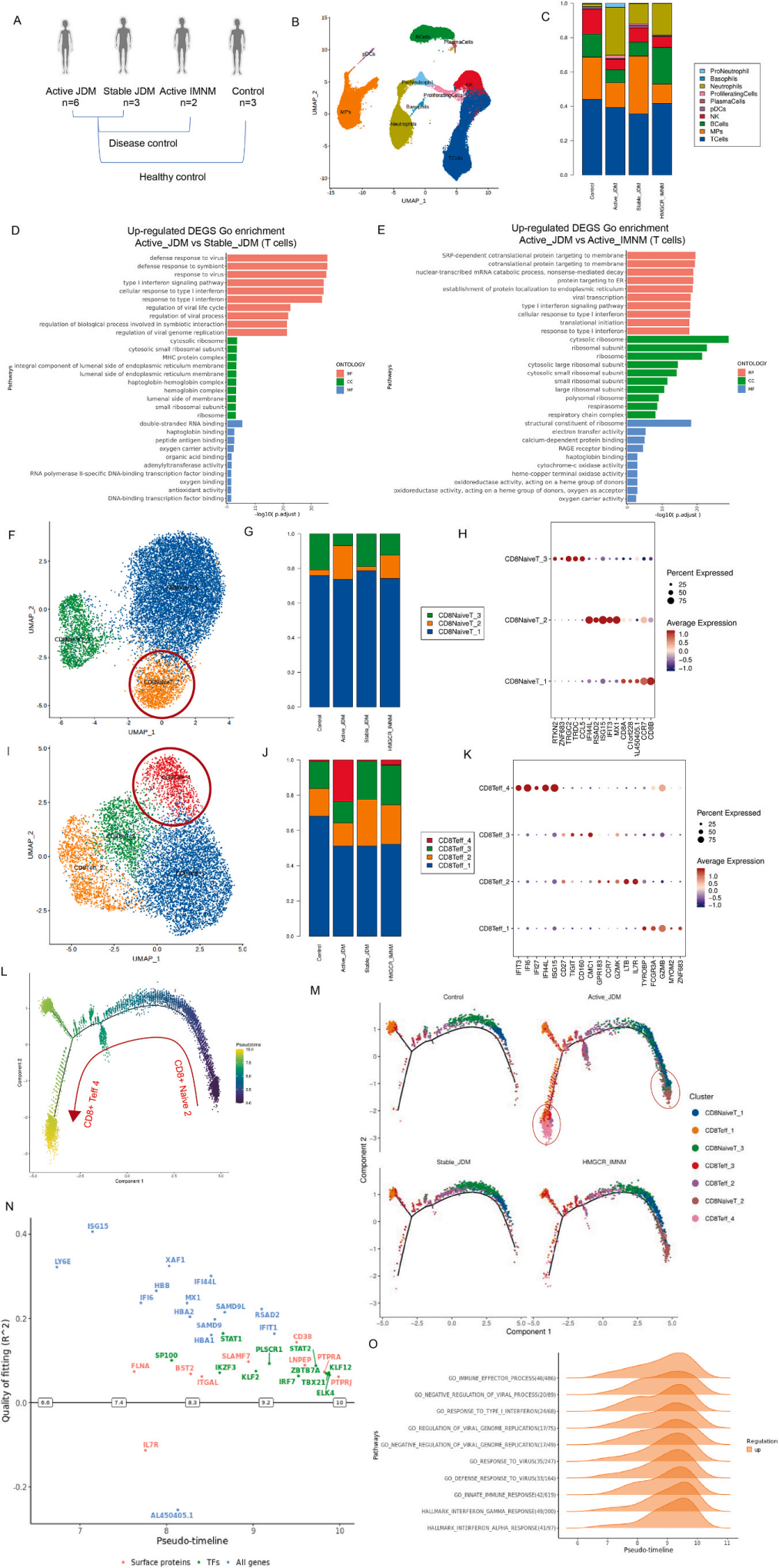
图3 单细胞转录组测序显示JDM患者CD8+ T细胞特征
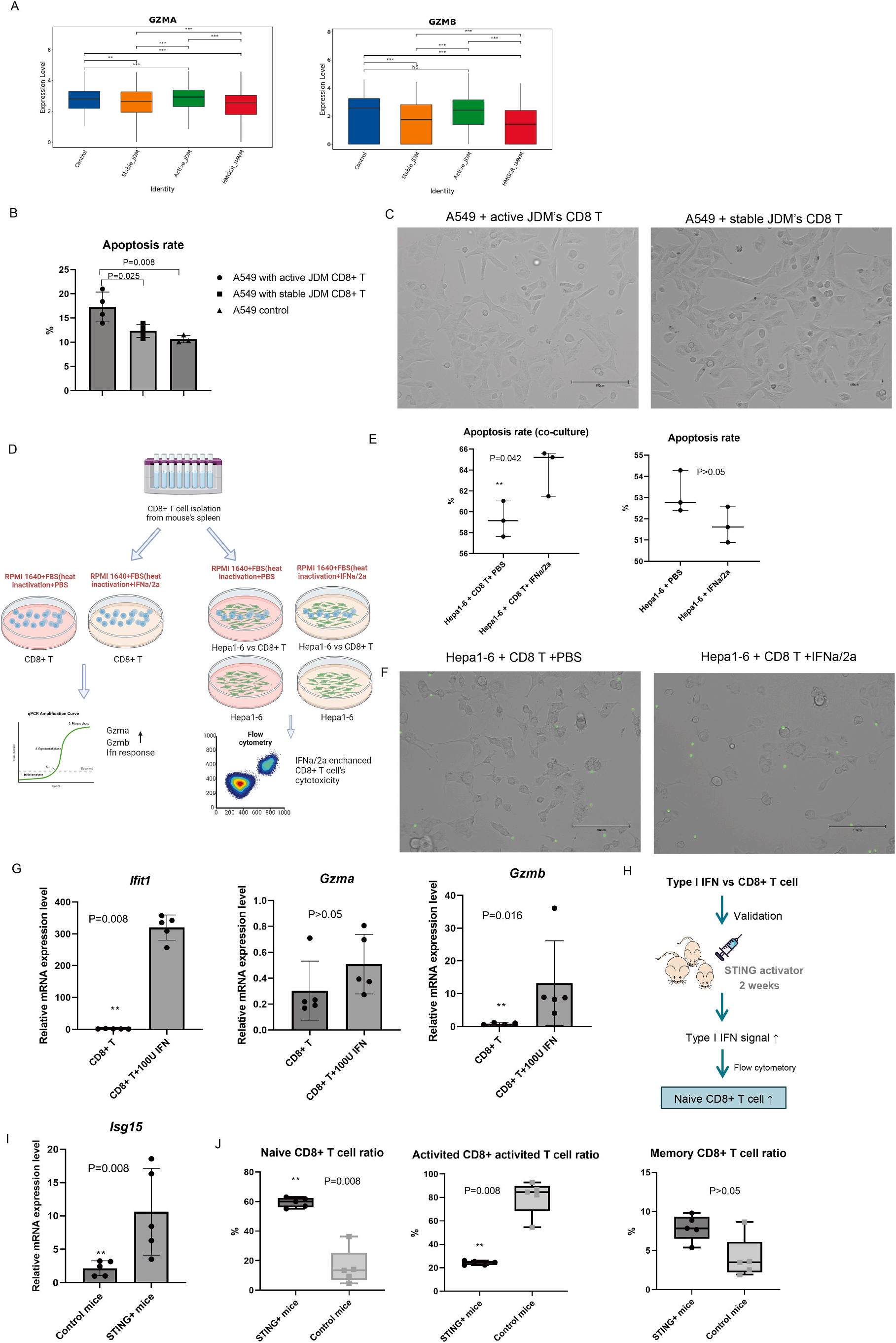
4.I型IFN干扰CD8+ T细胞分化并增强其细胞毒性作用
CD8+ T细胞的细胞毒功能分为直接途径和间接途径,其中直接途径涉及颗粒酶释放以裂解靶细胞。单细胞测序结果显示活动期JDM患者CD8+ T细胞表达较高水平的GZMA和GZMB。细胞实验发现活动期JDM患者的CD8+ T细胞引起更多的靶细胞凋亡;IFNa诱导CD8+ T细胞的迁移和趋化作用更强,凋亡更快,可增强CD8+ T细胞的杀伤能力,进一步导致更多靶细胞死亡;IFNa诱导CD8+ T细胞Ifit1基因表达水平升高,Gzma和Gzmb表达水平也升高,这些结果证实IFNa可以增加CD8+ T细胞的细胞毒性,促进靶细胞的凋亡。
然后,研究者建立了STING激动剂诱导的小鼠模型来验证I型IFN对CD8+ T细胞分化的影响。与对照组相比,STING组血液中Isg15基因表达水平更高,在脾脏中显示出较高的CD8+ naive T细胞比率、较高的活化CD8+ T细胞比率和较低的记忆CD8+ T细胞比率。这些体内外实验均证明I型IFN可干扰CD8+ T细胞的分化和细胞毒性作用。
图4 I型IFN可干扰CD8+ T细胞的分化和细胞毒性作用
5. EAM小鼠模型外周I型IFN反应增强,骨骼肌CD8+ T细胞浸润增加
EAM模型模拟了DM和多发性肌炎(PM)的组织病理学。小鼠EAM造模后,EAM组血液中Isg15基因表达水平和肌炎病理评分高于假手术组。HE染色结果显示EAM组肌细胞损伤,肌间炎性细胞浸润。在基础状态和造模后第14天,两组最大上肢抓地力无显著差异;在建模后第21天和第26天,EAM组的平均最大上肢抓地力显著低于假手术组,表明EAM组存在肌肉损伤。EAM组显示出较高的白细胞和中性粒细胞水平,这表明了全身炎症状态。肌炎的标志之一是肌间血管炎,血管炎表现为血液的高凝状态。EAM组的血小板计数水平高于sham组,提示EAM组发生了血管炎。EAM小鼠肌肉病理与人类活检病理相似,EAM组的腓肠肌中有CD8+T细胞浸润,并显示出强烈的MHC-1信号。EAM小鼠骨骼肌中CD8+T细胞与IFIT1共染色,EAM组腓肠肌MHC-1蛋白表达高于Sham组,这一发现表明异常的CD8+ T细胞和骨骼肌中MHC-1的高表达可能是肌炎表型的原因。
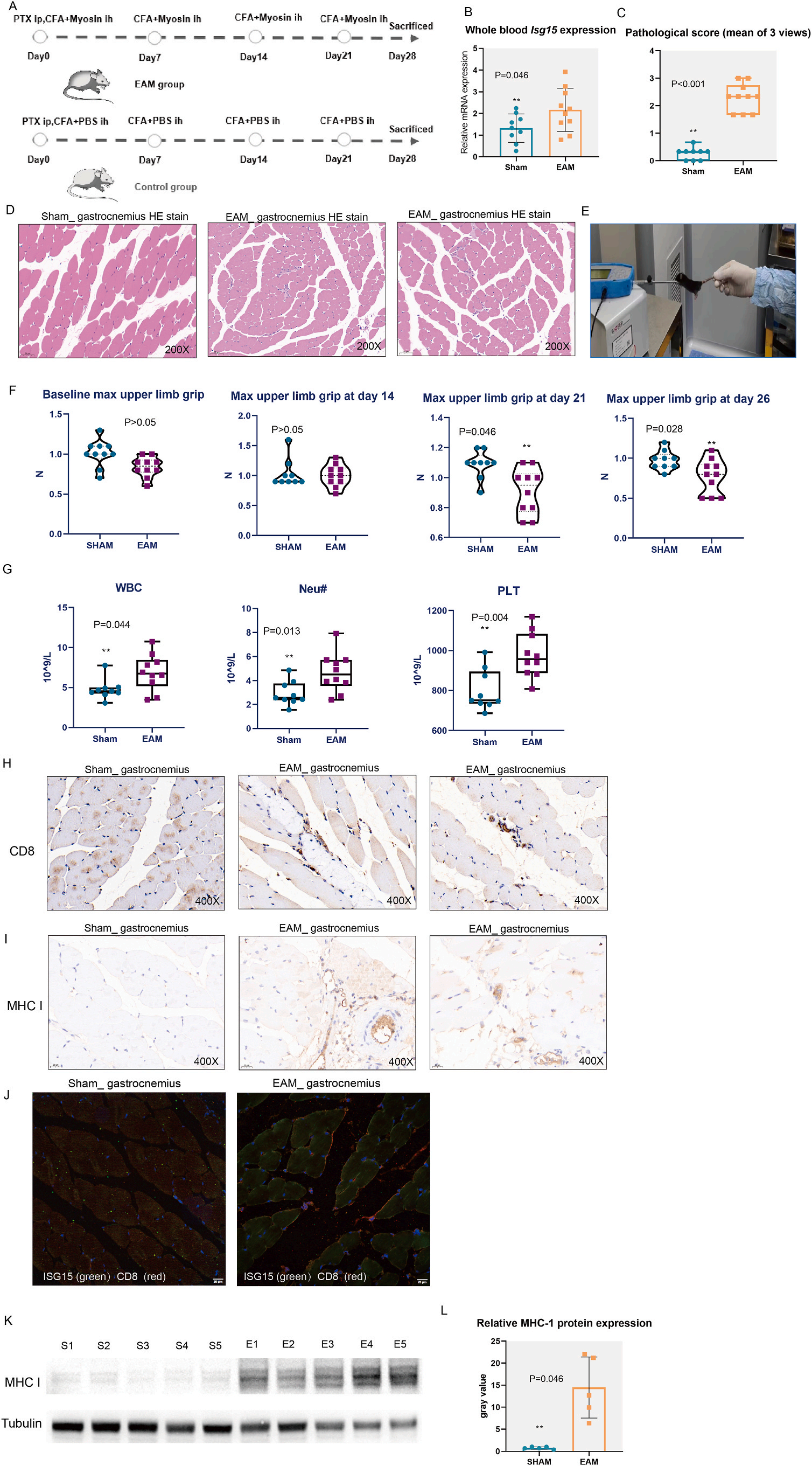
图5 EAM模型的评估和组织病理学