研究人员对10例微血管侵袭(Microvascular invasion, MVI)阳性或阴性的HCC患者样本进行了单细胞转录组测序,并与普通转录组、空间转录组和多重免疫荧光实验进行整合分析。该研究发现,在MVI+肝癌中存在数种对免疫抑制和促转移微环境的形成具有关键作用的细胞亚型,包括循环T细胞、LAMP3+ DC细胞、M2型巨噬细胞、肌成纤维细胞和动脉内皮细胞,这些细胞构成了一个整体,对肿瘤微环境的免疫抑制和肿瘤迁移至关重要。而且在随后的空间转录组水平,进一步证实这些细胞存在空间共定位,在MVI免疫抑制微环境的形成中起主导作用,并与不良预后相关。
思维导图
研究结果
1.scRNA-seq分析揭示MVI+ HCC肿瘤细胞组成景观
研究人员对3个MVI+样本、2个MVI-样本及其各自配对的癌旁样本进行scRNA-seq,大类注释出7种细胞类型。对比癌旁正常样本,恶性肿瘤细胞表现出显著的异质性 (图1E)。肿瘤生态系统表现为髓细胞富集,T/NK细胞和B细胞缺乏,这与先前对HCC的单细胞研究一致。而相较于MVI-样本,不论是癌还是癌旁,MVI+样本都富集了更多的T/NK细胞和间充质细胞(图1G),这表明MVI的形成涉及非常复杂的细胞组成。
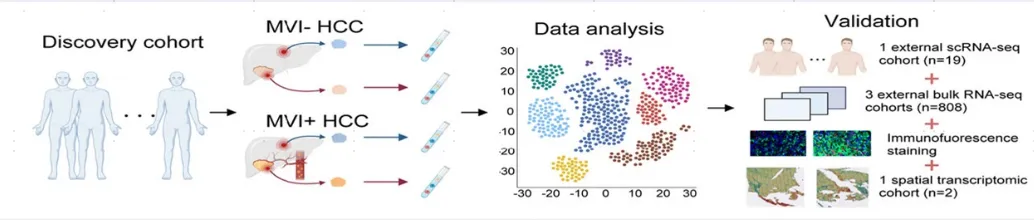

图1. scRNA-seq分析揭示MVI+ HCC肿瘤细胞组成景观
2. MVI+肿瘤免疫微环境中免疫抑制的T细胞亚群的鉴定
鉴于MVI+和MVI-肿瘤之间T/NK细胞组成的巨大差异,研究人员对T/NK细胞进行进一步细分,鉴定5个T细胞亚群、3个NK细胞亚群和1个Cycling亚群(图2A)。OR指数偏好性分析发现,典型的抗肿瘤免疫相关参与者(TNF Tem、T naïve和NK亚群)在非肿瘤组织中富集,而循环细胞和IL7R Tem细胞在MVI+肿瘤中富集(图2D)。进一步区分循环细胞,循环T细胞在MVI+肿瘤组织中比例较高,而循环NK细胞在MVI+NT组织中显著丰富(图2E~H)。GSEA分析显示,循环T中增殖相关通路显著富集,而炎症相关通路下调(图2I, J),表明循环T细胞效应功能降低。在形成MVI+ HCC的免疫抑制微环境中发挥关键作用。多重免疫荧光染色进一步证实,与MVI- HCC样本相比,MVI+ HCC样本中循环T细胞(CD3+Ki67+细胞)的丰度增加(图2K)。
对T细胞功能进行分析,发现这群循环T细胞偏向于终末衰竭状态,高表达MKI67,同时细胞毒性的评分较低(补充图1),这些结果在公共数据的验证队列中同样得到了证实,MVI+肝癌中存在更高的循环T细胞,且循环T细胞与HCC预后不良显著相关(p<0.0001, HR= 2.18)。

图2. MVI+HCC和MVI- HCC中异质T细胞群的特征
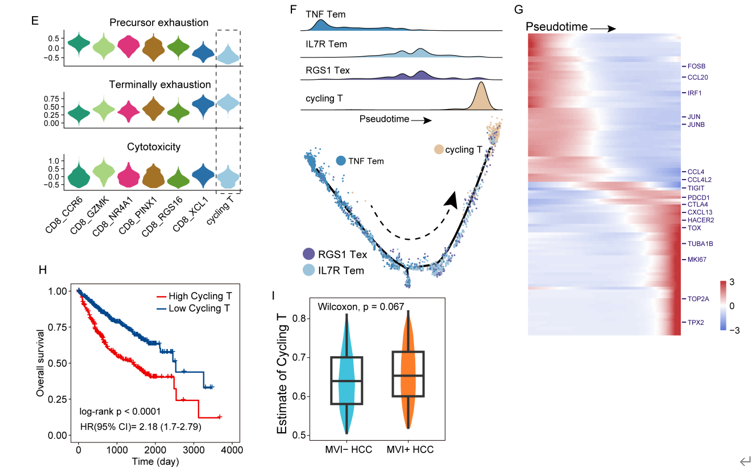
补充图1:Cycling T细胞的功能特征
3.MVI+和MVI-肿瘤中的髓系细胞成分
髓系细胞的细分确定了四个不同的亚群,对巨噬细胞的进一步细分为4个亚群(图3A,B)。其中AP Macro表现出高水平表达与抗原呈递相关的基因,而MARCO Macro则表现出显著的巨噬细胞胶原结构受体(MARCO)表达(图3C)。AP Macro和MARCO Macro在非肿瘤样本中富集(图3D)。炎症活性相关的IL1B Macro在MVI-肿瘤中表现出类似的富集,并且IL1B、CCL3和CXCL2等炎症因子上调(图3C,D)。
利用M1、M2的巨噬细胞极化基因集进行打分,TREM2 Macro表现出高M2评分(抗炎),IL1B Macro表现出M1表型(炎症)(图3E)。GSEA显示,TREM2 Macro中与凝血、脂肪生成和KRAS信号相关的通路显著上调,而炎症相关通路下调,表明高代谢和促转移是TREM2 Macro的关键标志。最后,多重免疫荧光染色显示TREM2 Macro在MVI+ HCC中富集(图3H)。
DC细胞同样细分为4个亚群(图3I)。研究人员鉴定出两种非经典DC亚群,cycling DC和LAMP3 DC,主要存在于MVI+肿瘤中(图3I-K)。LAMP3 DC具有很高的激活能力和从肿瘤向血管区迁移的能力 (图3L),显示出促转移特征。而cycling DC则表现出较高的细胞分裂分数和较低的抗原递呈能力,表明其处于增殖和功能失调的状态。LAMP3 DC还高表达PD-L1,其细胞占比与两种免疫抑制T细胞亚群(循环T细胞和Treg细胞)之间存在正相关性,但与其他T细胞亚群呈负相关(图3O),表明LAMP3 DC在MVI+肿瘤中免疫抑制微环境的形成中起着至关重要的作用。多重免疫荧光染色进一步证实了LAMP3 DC在MVI+ HCC中的富集。研究人员还鉴定并验证了9个在MVI+肿瘤的髓系细胞中显著上调的基因,表明它们有可能成为MVI+肿瘤的独特特征和有前景的治疗靶点(图3P)。
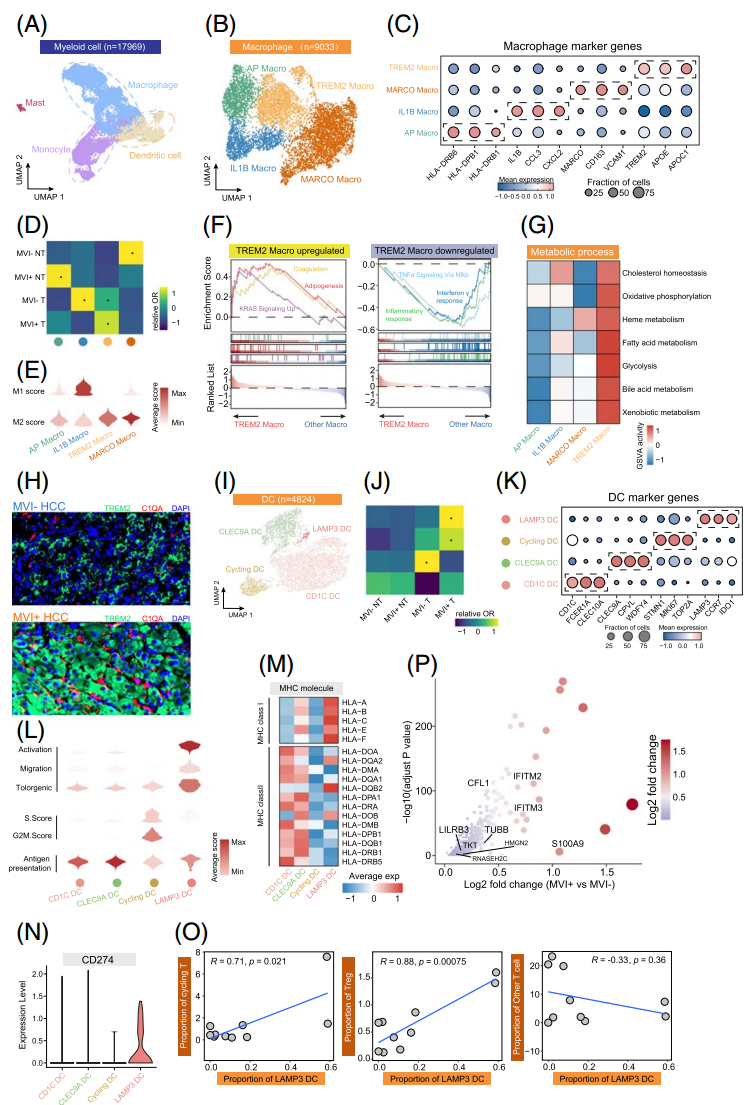
图3.MVI+和MVI-肿瘤骨髓源性细胞的特征
4.MVI+肿瘤基质成分和调节因子的表征
研究人员将基质成分细分成2个间充质亚群和8个内皮亚群,其中动脉内皮被分为arterial i EC和arterial ii EC(图4A, B)。这两个动脉亚群表现出不同的组织富集特异性,arterial ii EC存在于正常样本,而arterial i EC主要富集于MVI+肿瘤,提示动脉EC可能经历了从邻近组织到MVI+ HCC的表型变化(图4D)。进一步分析EC转录异质性和功能差异,发现到arterial i EC中肿瘤发生和代谢相关基因富集。相反,在arterial ii型EC中上调的基因主要与调节体内平衡的激素或蛋白质的产生和分泌有关(图4E, F)。轨迹分析显示,这两个动脉EC亚群在内皮细胞极化的终末阶段被激活,并表现出两个不同的极化方向(图4G)。其中有两个关键的转录因子,BAX在arterial i EC中激活,FOXC1在arterial ii EC中激活。生存分析进一步显示这两种TFs与生存率上存在显著的相关性(补充图2)。
癌症相关标志通路的GSVA分析表明,mCAFs和arterial i EC在MVI+肿瘤中优先富集,并表现出与肿瘤发展相关的通路高度富集,例如:脂肪生成、血管生成和EMT(图4I)。这表明这些基质细胞具有促进肝癌肿瘤血管形成和转移的潜力。
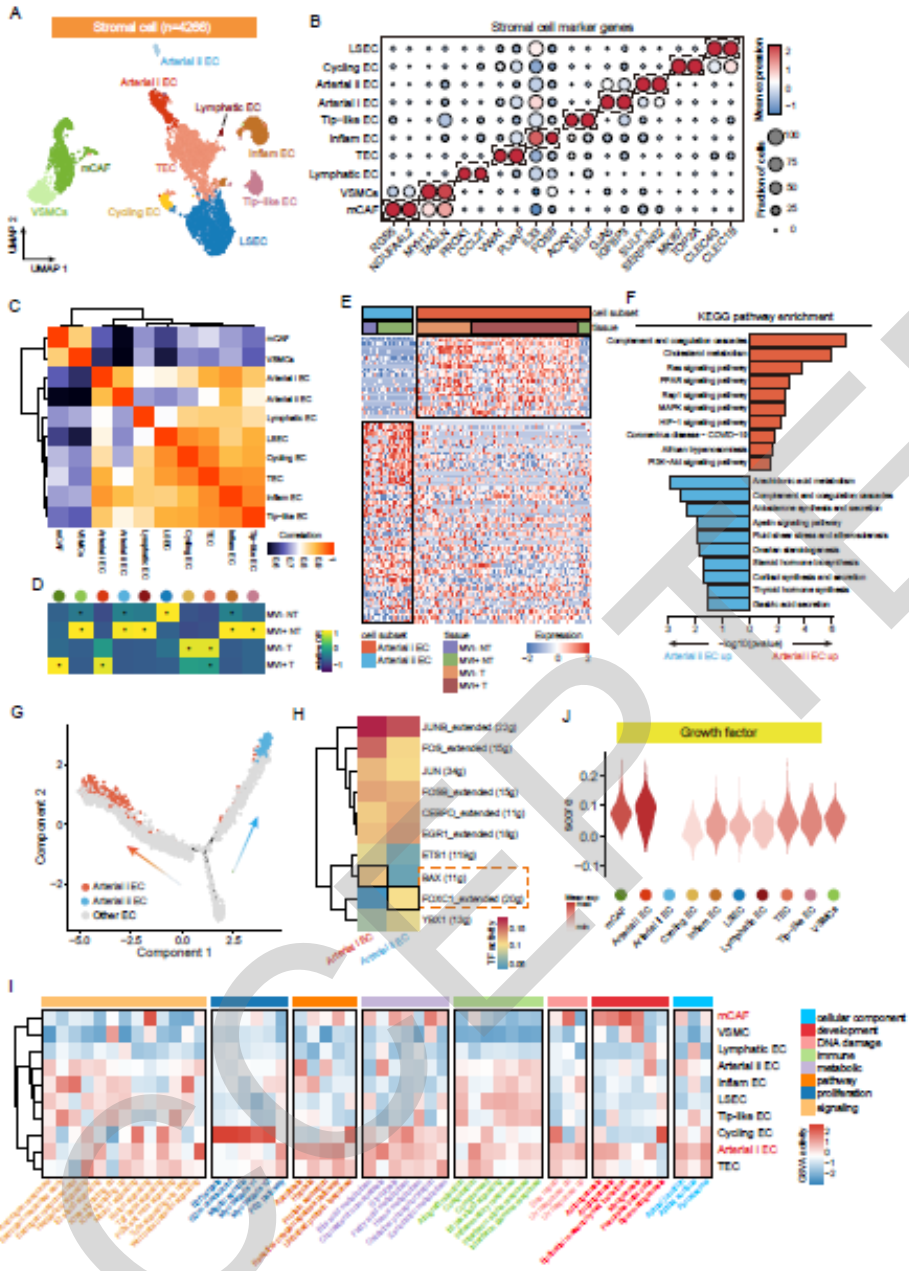
图4. MVI+肿瘤基质成分和调节因子的表征
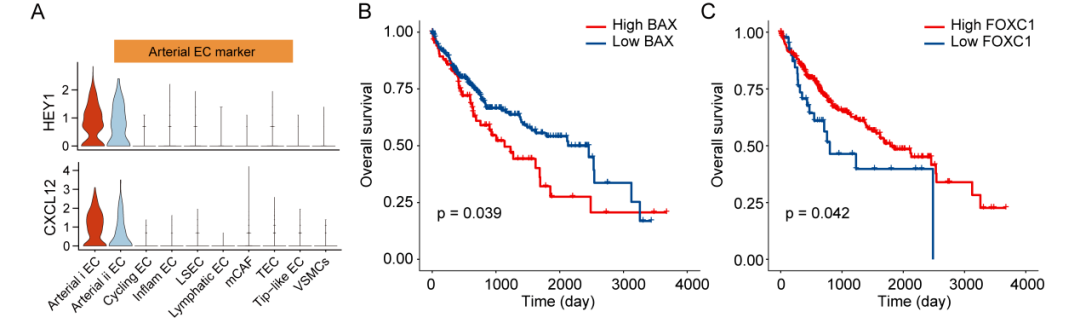
补充图2:两种动脉内皮细胞的特征与转录因子的预后生存曲线
5.MVI-和MVI+ HCC恶性细胞的异质性
为了研究恶性细胞的作用及其异质性,研究人员将HPCs(肝祖细胞)和恶性细胞重新降维,并根据其组织来源分为MVI+恶性和MVI-恶性细胞(图5A)。肿瘤hallmark富集分析显示MVI+恶性细胞表现出与增殖相关通路的显著上调(图5B)。MVI+细胞中,增殖细胞(S期和G2M期)的比例较高,表明其增殖活性增强(图5C)。
轨迹分析显示MVI-恶性细胞起源于HPCs,并进一步过渡到MVI+恶性细胞,同时伴随着干性评分的下降 (图5E)。在富集到的差异通路,起始阶段高表达TNFα Signaling via NF-kB、凋亡和免疫相关信号通路,在组织稳态和发育中起着至关重要的作用。中间恶性状态的标志是代谢活性增加,随后凝血和血管生成升高,最终富集到细胞周期,表明随着肿瘤的进展获得转移和增殖特性(图5F)。
通过CellChat分析发现,TREM2 Macro与恶性细胞的相关性最强(图5H),并且MDK(风险基因)在促进这两种细胞类型细胞串扰中发挥了突出作用(图5I)。在这两种细胞的互作上, MDK-NCL受配体对显示出最强的互作强度(图5I),并在验证队列中进一步验证,样本中MDK的平均表达与TREM2 Macro的比例之间呈现正相关(图5J)。综上所述,这些发现为恶性细胞通过MDK介导的通讯轴招募TREM2巨噬细胞促进MVI+肿瘤的肿瘤进展提供了机制见解(图5K)。
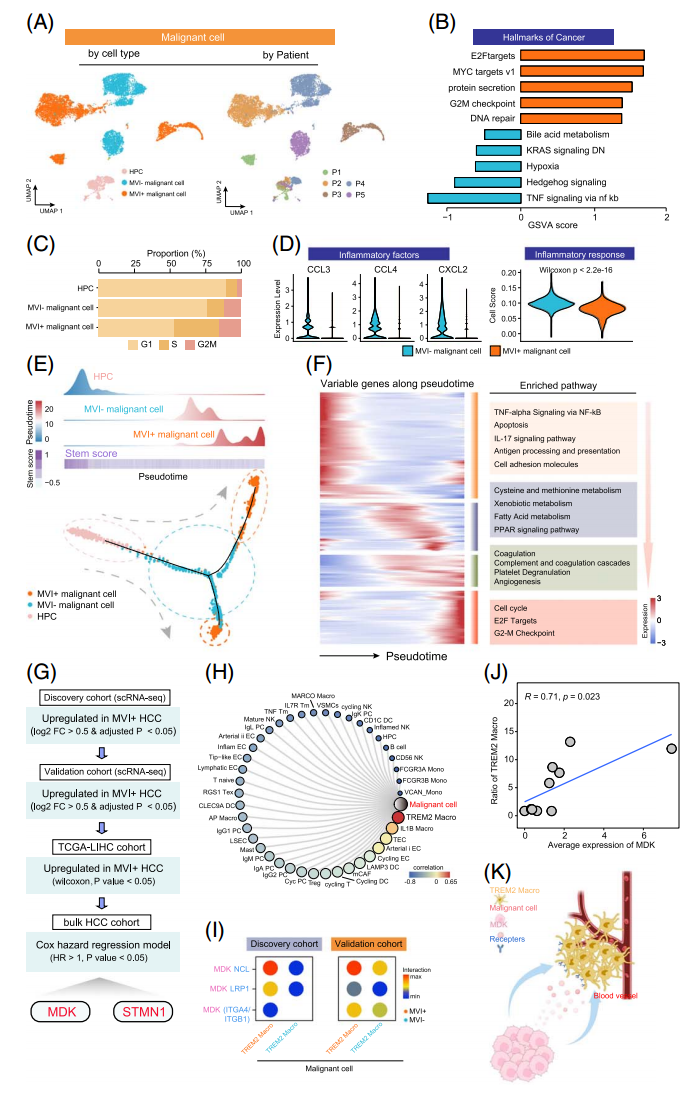
图5. MVI-和MVI+ HCC恶性细胞的异质性
6.MVI+肿瘤中TME的独特多细胞群落鉴定
将所注释出的各个细胞亚群进行共富集分析(图6A),在聚类的细胞群中,研究人员发现了一个由cycling T、LAMP3 DC、arterial i EC、mCAF和Treg组成的细胞集群,缩写为CLAMT,主要富集于MVI+ HCC中。在大队列的验证中,高CLAMT浸润与较差的临床预后之间呈现极显著的相关性(图6 b)。在TCGA-LIHC队列中也证实了MVI+ HCC中CLAMT的显著浸润(图6C)。
构建细胞间通讯网络,与MVI- HCC相比,MVI+ HCC中恶性细胞和间质细胞的相互作用更广泛(图6D)。MVI+HCC表达的配体与肿瘤促进和转移途径有关,主要分布在基质成分中;MVI-HCC源性细胞中表达的配体在细胞因子和炎症途径中富集(图6E)。这些发现表明MVI+和MVI- HCC之间存在不同的互作模式。
最后,为了验证CLAMT细胞簇成员的空间共定位,研究人员对HCC组织进行了空间转录组学分析。通过从两名患者获得的空间转录组数据,分别评估CLAMT的浸润评分。这五种细胞类型在两名患者的肿瘤样本中具有一致的共定位模式(补充图9)。这一观察结果表明,这些细胞亚群被集体招募,从而在HCC微环境中形成一个相互作用的细胞群落,并可能对肿瘤进展产生协同影响。
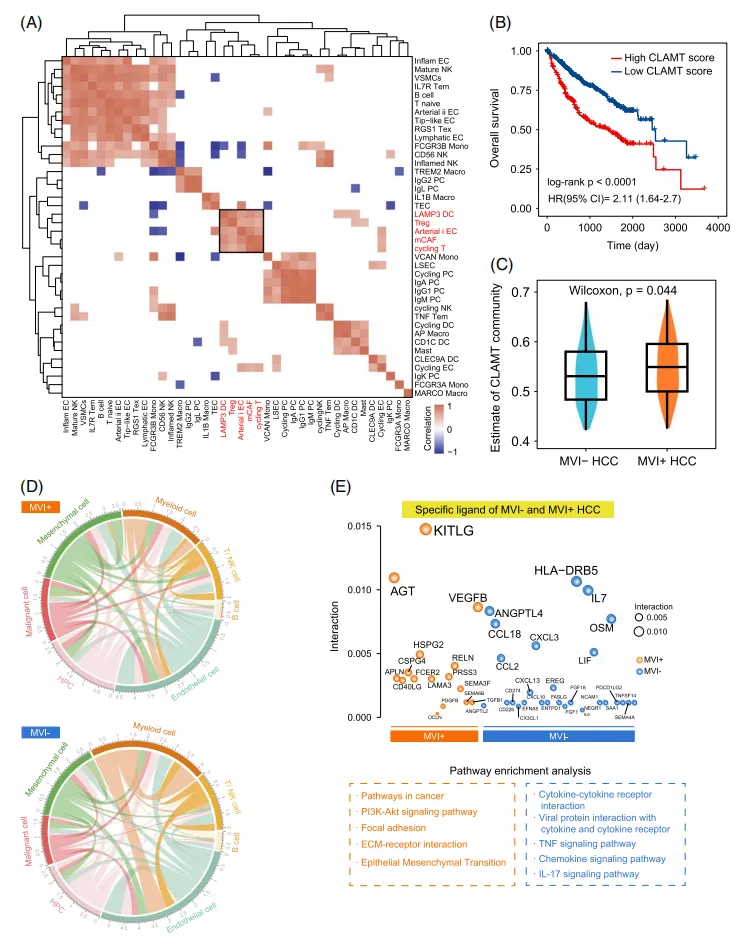
图6. MVI+HCC样本中鉴定独特的细胞群落呈现TME
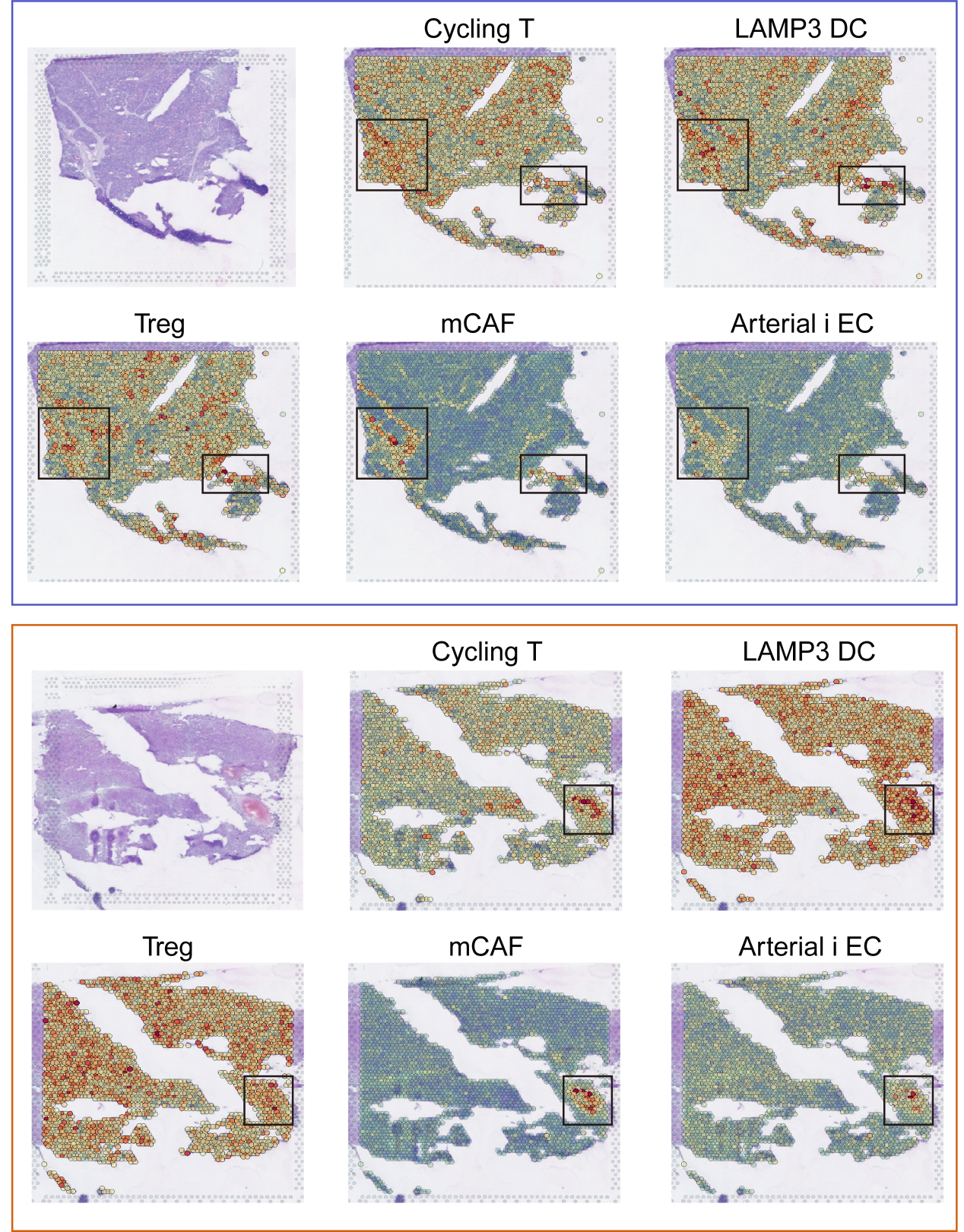
补充图3. CLAMT细胞群的空间共定位
总结
本研究通过单细胞转录组学分析,确定了在MVI+肿瘤中形成免疫抑制和促转移微环境至关重要的免疫和基质细胞的特定亚型,包括cycling T细胞、LAMP3+DC、TREM2+Macro、mCAF和动脉i EC。同时发现TREM2+巨噬细胞和恶性细胞之间MDK主导的相互作用是MVI形成和肿瘤进展的一个因素。上述5种细胞在空间上共定位的多细胞群落在形成MVI的免疫抑制微环境中发挥主导作用,并与不良预后相关。
参考文献
Li Ke, Zhang Rui, Wen Fukai, et al.Single-cell dissection of the multicellular ecosystem and molecular features underlying microvascular invasion in hepatocellular carcinoma.Hepatology. 2023 Nov 16. doi: 10.1097/HEP.0000000000000673. Online ahead of print.








