1.pTCD8+CD28-基线水平的预后价值
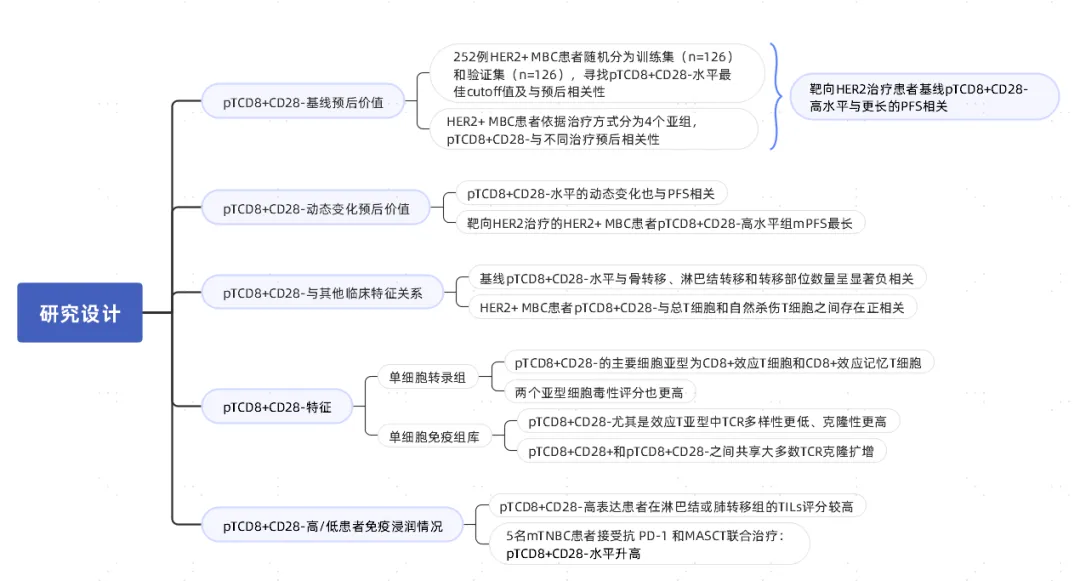
本研究中252例HER2+ MBC患者随机分为训练集(n=126)和验证集(n=126),在训练集中评估了各外周淋巴细胞亚型在一线治疗PFS的预后潜力。其中只有pTCD8+CD28-水平与一线治疗PFS显著相关,最佳cut off值为18.0%(16.5%~19.0%),该阈值的有效性在后续验证集中得到了再次确认(图2a,b)。Cox回归模型证实,基线pTCD8+CD28-水平是HER2+ MBC患者一线PFS的独立预后因素,高水平pTCD8+CD28-与较长的中位PFS (mPFS)显著相关(图2c)。
根据治疗方案不同,将HER2+ MBC患者分为4个亚组。在接受化疗联合曲妥珠单抗治疗亚组中,高水平的pTCD8+CD28-患者的mPFS较低水平者延长(图2d);在化疗联合曲妥珠单抗和帕妥珠单抗亚组、化疗联合酪氨酸激酶抑制剂(TKI)亚组和单纯化疗亚组中,pTCD8+CD28-高水平和pTCD8+CD28-低水平的mPFS差异无统计学意义(图2e-g)。基于HER2靶向治疗亚组,基线pTCD8+CD28-高水平与mPFS延长相关(图2h)。
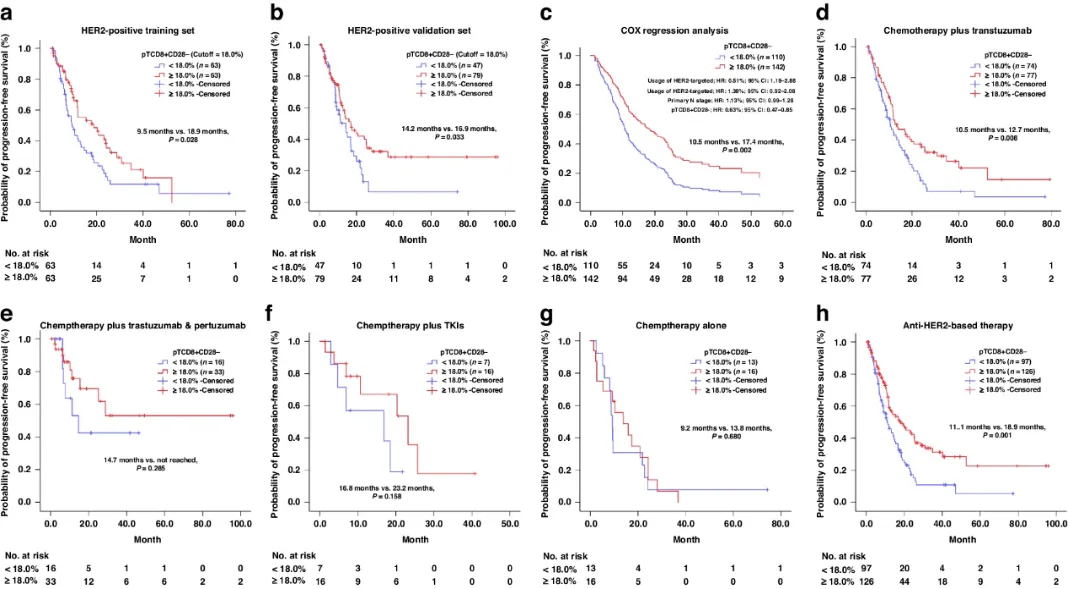
图2 基线pT CD8+CD28-在HER2+ MBC患者一线PFS中的预后作用
2.pTCD8+CD28-动态水平的预后价值
接下来作者确定pTCD8+CD28-的动态变化与一线PFS之间的关系。根据pTCD8+CD28-的变化情况,将接受靶向HER2治疗的患者分为恒高组、恒低组、降低组和升高组。恒高组的pTCD8+CD28-在整个治疗过程中始终保持高水平,而低水平组则始终保持低水平,降低组在起始表现为高水平,随后每次随访呈低水平,增强组则相反。
在关于一线中位PFS的Kaplan-Meier分析中,最终共纳入了139例符合标准的患者,其中恒高组(n=71)一线mPFS最长,为15.5个月;恒低组(n=25)一线mPFS最短,为7.7个月。降低组(n=6, mPFS=11.4个月)和升高组(n=37, mPFS=11.1个月)的mPFS持续时间相似。综上所述,在接受靶向HER2治疗的HER2+ MBC患者中,pTCD8+CD28-水平的动态变化也与一线PFS相关(图3b)。需要注意的是,这一研究结果是在有限的样本量内观察到的,因此未来需要在独立队列中进一步验证。
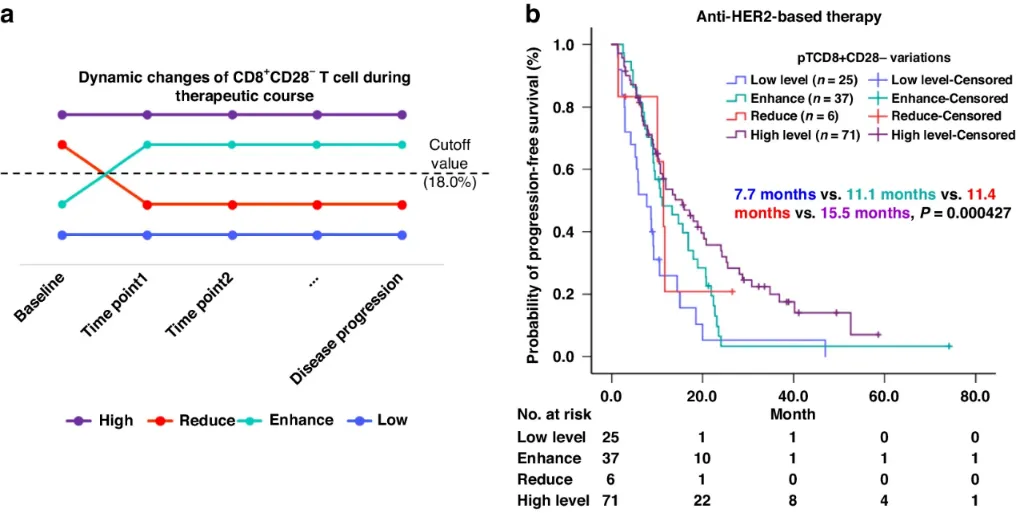
图3 pT CD8+CD28-动态变化在一线PFS中的预后作用
3.pTCD8+CD28-水平与其他临床特征的关系
除了评估pTCD8+CD28-的预后价值外,作者还研究了其与队列中其他临床特征的相关性。基线pTCD8+CD28-水平与骨转移、淋巴结转移和转移部位数量呈显著负相关。与健康对照组相比,pTCD8+CD28-与总T细胞和自然杀伤T细胞之间的正相关只存在于HER2+ MBC患者中。但由于相关系数较低,这些发现需要进一步验证。
4.pTCD8+CD28-在HER2+ MBC中的细胞毒性潜能
为了确定pTCD8+CD28-的细胞毒性潜能,作者评估了来自纳入患者的细胞毒性效应蛋白分泌、T细胞受体(TCR)克隆性和pTCD8+CD28-转录组变化。pTCD8+CD28-细胞的穿孔素和颗粒酶B水平显著高于其前体细胞(pTCD8+CD28+)(图4a)。
通过单细胞转录组测序,在pTCD8+CD28+和pTCD8+CD28-中共确定了7种T细胞亚型。与pTCD8+CD28+相比,pTCD8+CD28-的主要细胞亚型为CD8+效应T细胞和CD8+效应记忆T细胞;同时这两个亚型表现出更高的细胞毒性评分(图4b)。TCR组库进一步分析显示,pTCD8+CD28-的呈现低多样性、高克隆性的特征,尤其是效应T细胞亚型;同时观察到pTCD8+CD28+和pTCD8+CD28-之间共享大多数TCR克隆扩增(图4c)。综上表明,pTCD8+CD28-在HER2+ MBC中发挥抗原效应T细胞功能。
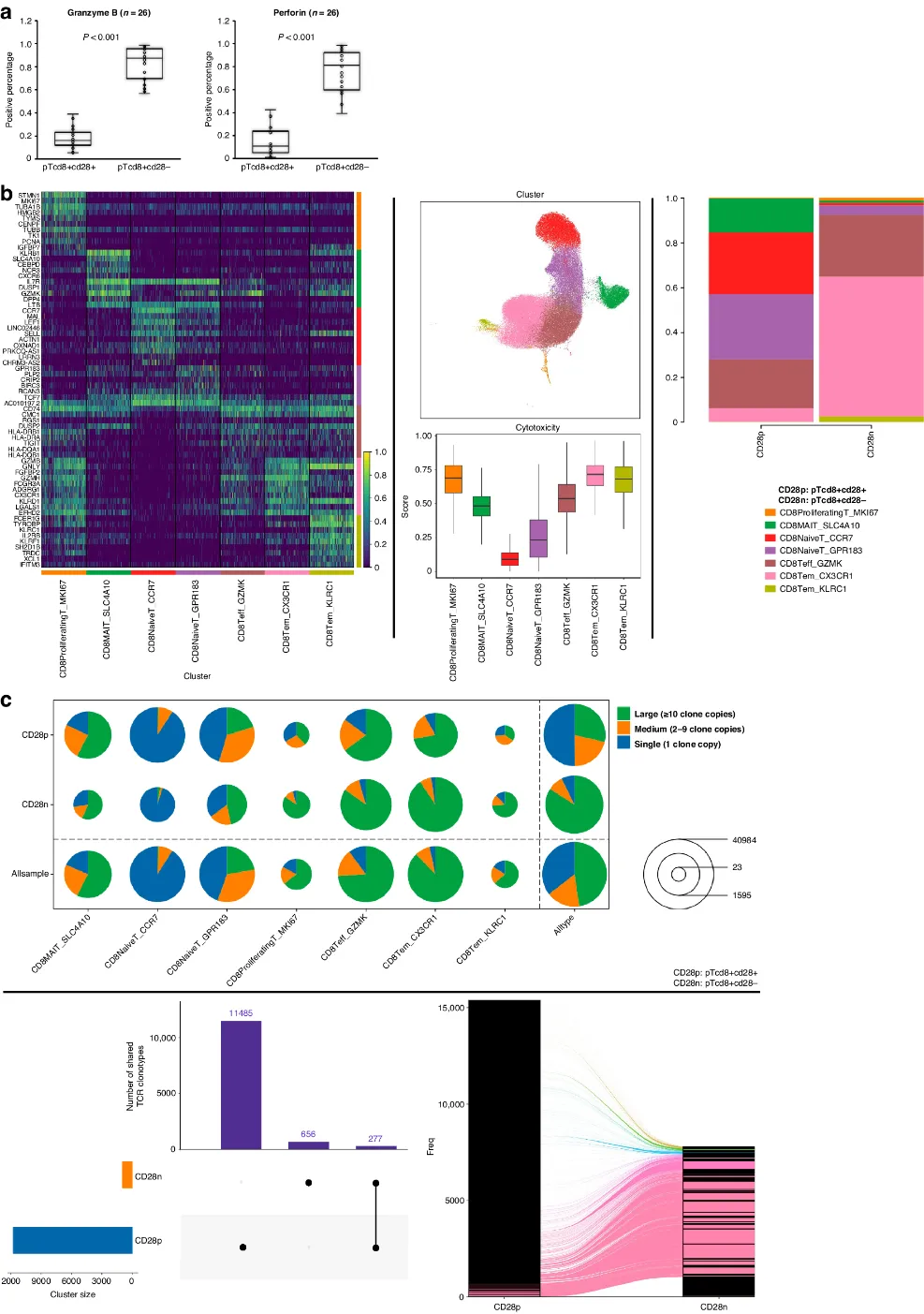
图4 评估pTCD8+CD28-的细胞毒性能力
5.pTCD8+CD28-与肿瘤免疫的关系
为了确定pTCD8+CD28-水平与患者肿瘤免疫之间的关系,作者首先比较了pTCD8+CD28-高水平和低水平患者的TILs浸润情况。考虑到不同转移部位的影响,首先对不同转移部位进行了分析,结果显示,pTCD8+CD28-高表达患者在淋巴结和/或肺转移组的TILs评分较高,但与其他部位转移无显著差异(图5a)。共聚焦免疫荧光分析显示,pTCD8+CD28-和配对肿瘤病灶中浸润的CD8+CD28- T细胞之间呈定量正相关(图5b)。pTCD8+CD28-高水平组IL-2表达高于pTCD8+CD28-低水平组,而TGF-β表达则较低(图5c)。
鉴于目前的治疗原则,HER2阳性乳腺癌尚无免疫治疗的用药指征。因此,作者额外招募了5名转移性三阴性乳腺癌患者(mTNBC)。这些患者接受抗PD-1和多抗原特异性细胞疗法(MASCT,T 细胞和树突状细胞)的联合治疗。基线和随访结果显示,5名患者外周血CD8+PD1+ T细胞水平降低,pTCD8+CD28-水平升高;相反,外周血CD3+ CD8+ T细胞水平的波动并未显示特有的规律,排除了T细胞输入导致pTCD8+CD28-假阳性扩增的可能性(图5d)。
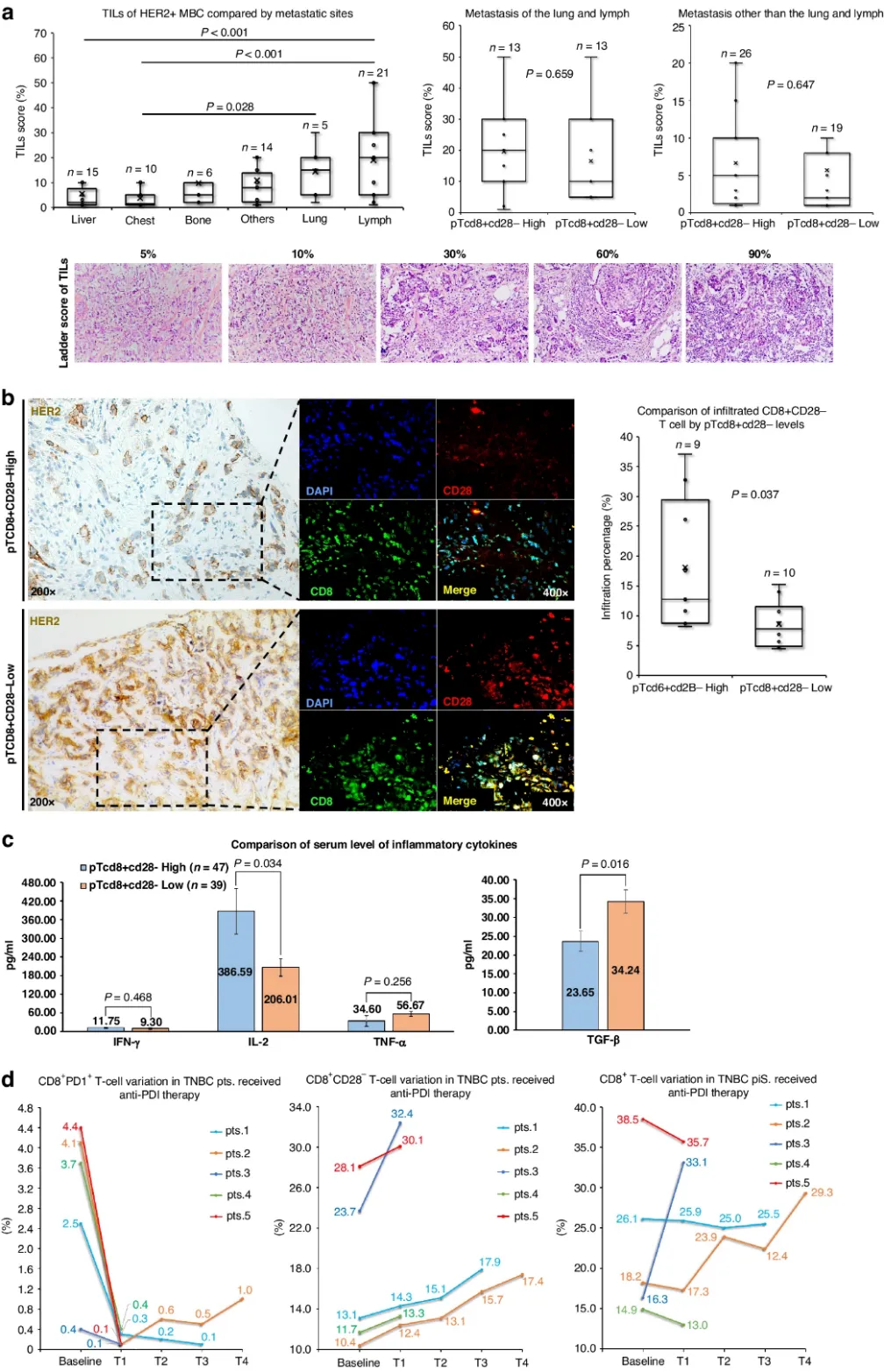
图5 pTCD8+CD28-与肿瘤免疫的关系