[1]Geng Y, Ma Q, Liu YN, et al. Heatstroke induces liver injury via IL-1β and HMGB1-induced pyroptosis. J Hepatol. 2015 Sep;63(3):622-33. doi: 10.1016/j.jhep.2015.04.010. Epub 2015 Apr 27. PMID: 25931416.
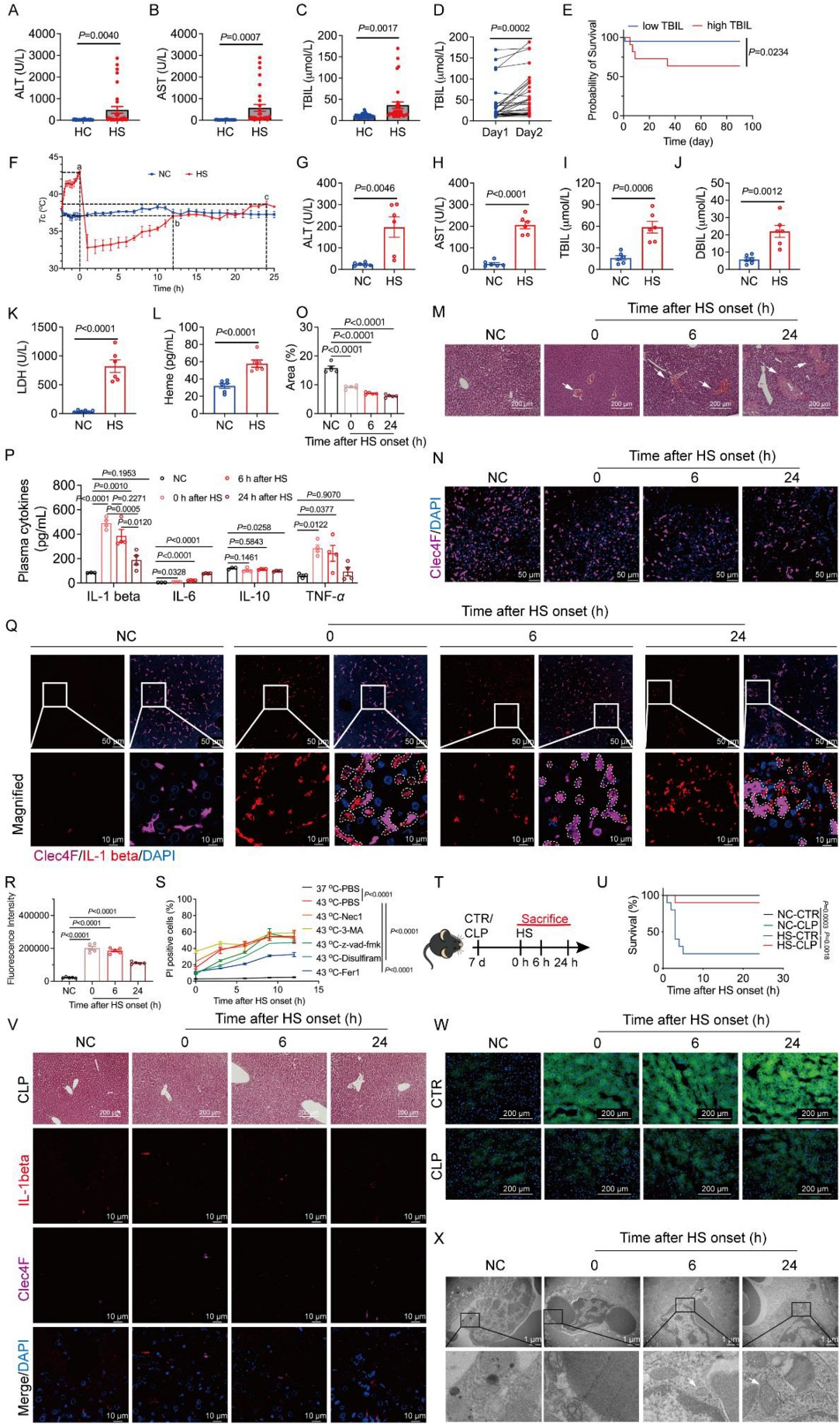
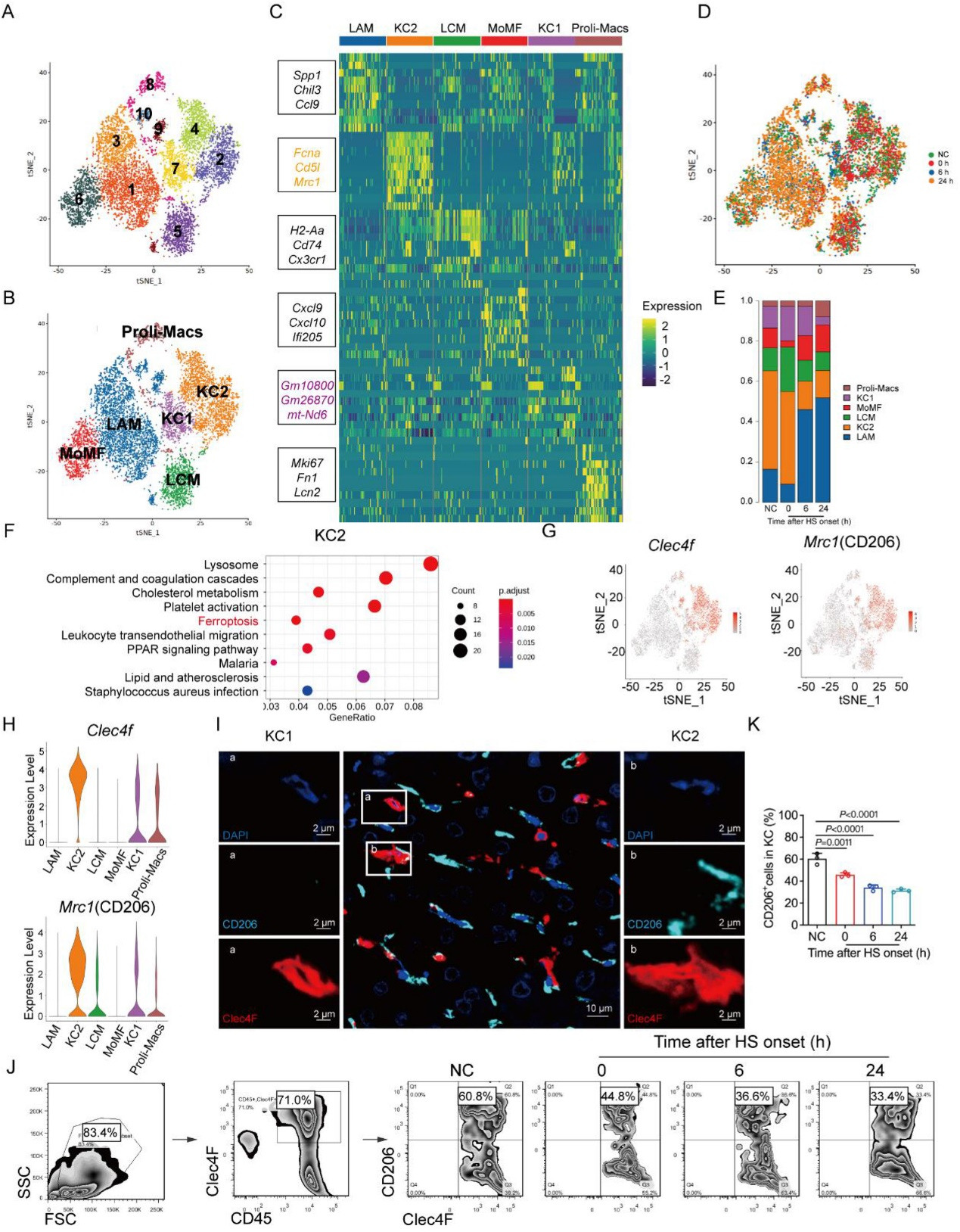
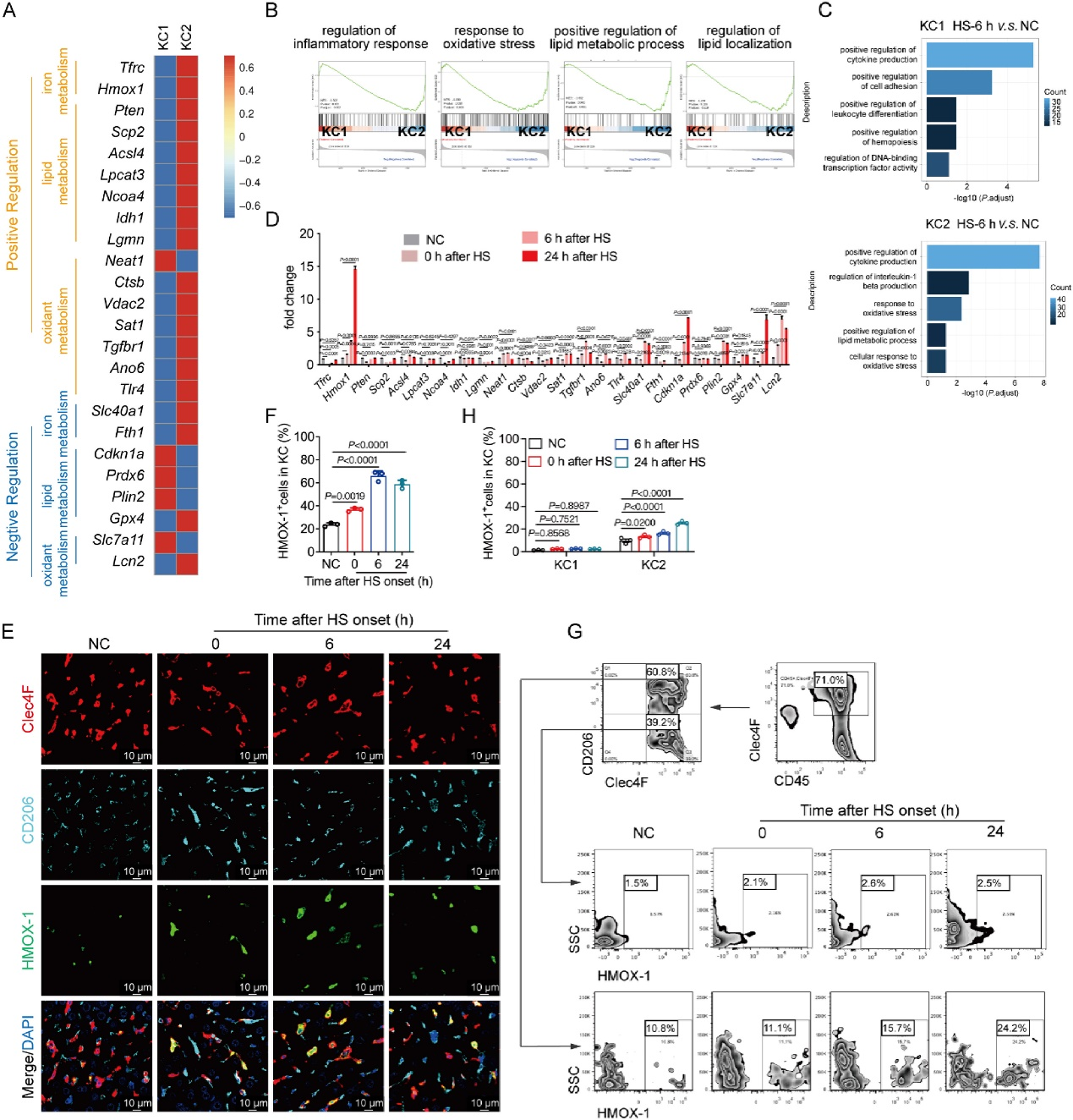
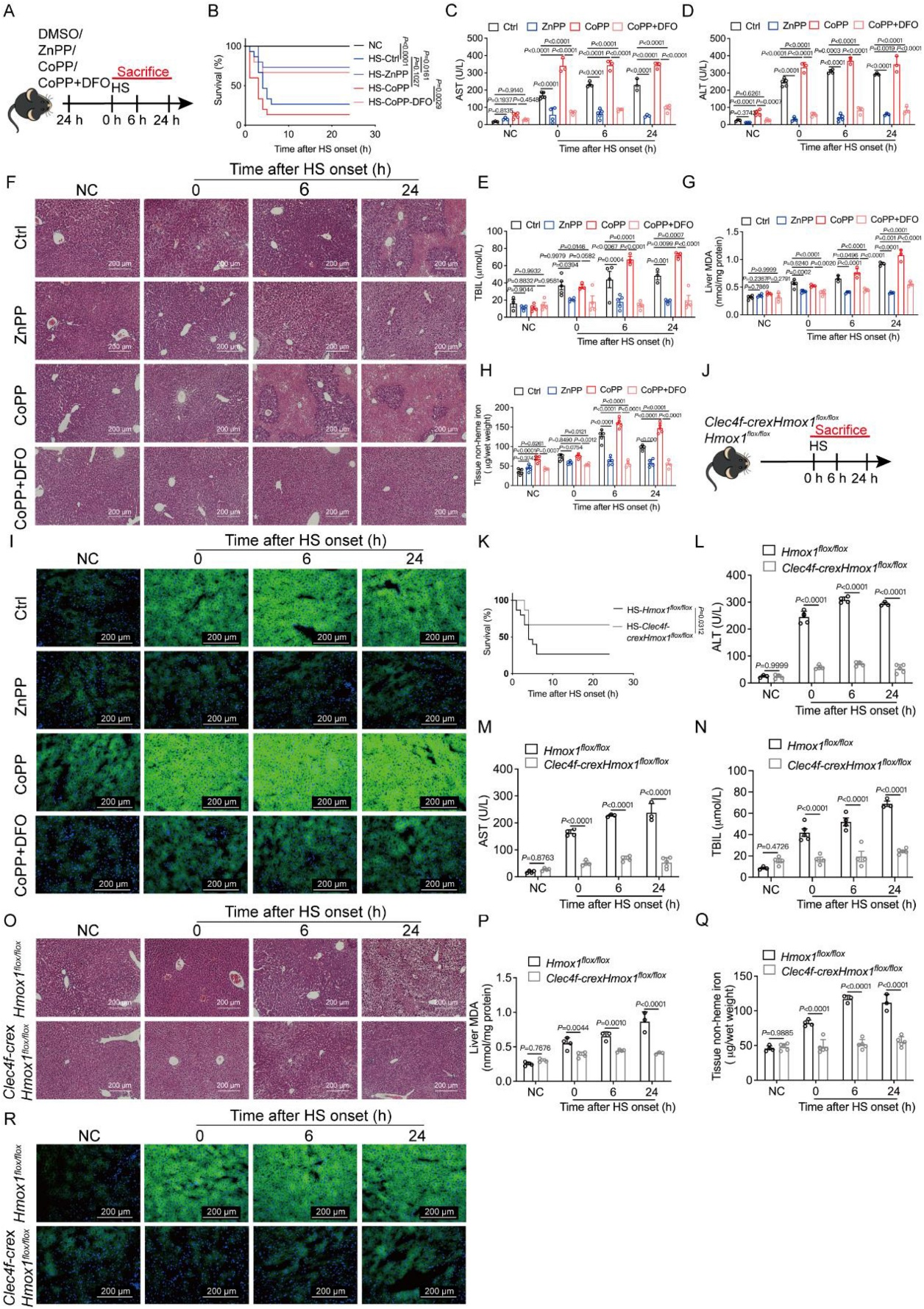
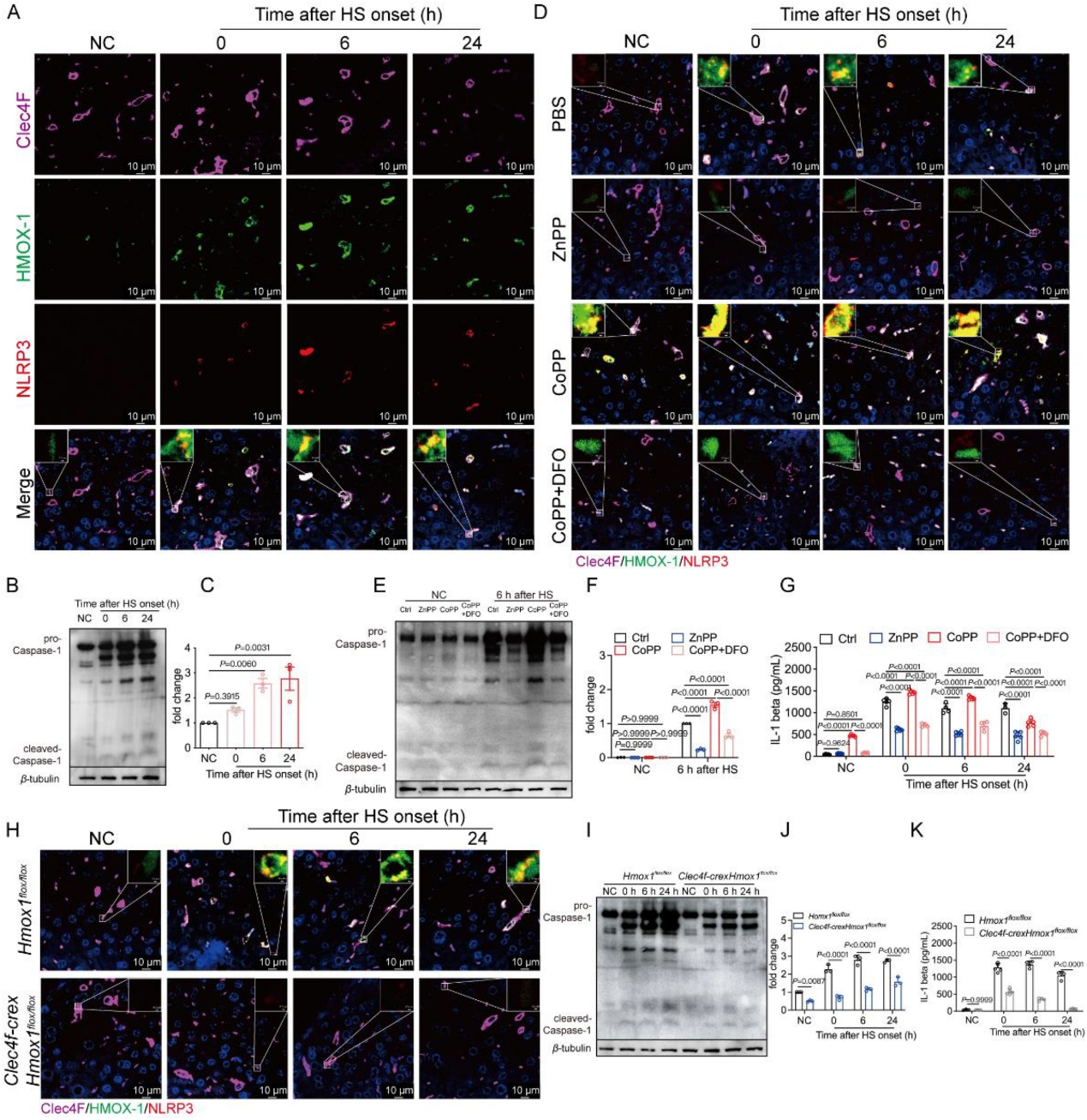
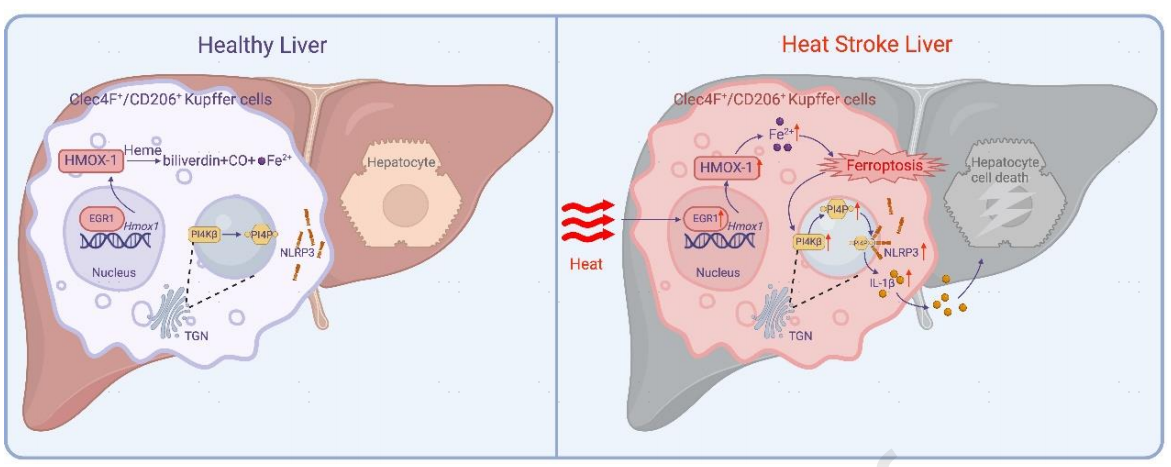
[2]Li R, Wei R, Liu C, et al. Heme oxygenase 1-mediated ferroptosis in Kupffer cells initiates liver injury during heat stroke, Acta Pharmaceutica Sinica B, https://doi.org/10.1016/ j.apsb.2024.05.007.
[3] He S, Li R, Peng Y, et al. ACSL4 contributes to ferroptosis-mediated rhabdomyolysis in exertional heat stroke. J Cachexia Sarcopenia Muscle. 2022 Jun;13(3):1717-1730. doi: 10.1002/jcsm.12953. Epub 2022 Mar 3. PMID: 35243801; PMCID: PMC9178366.