项目文章 | 光遗传学突破:无线装置激活痛觉神经,开辟植入物感染治疗新策略
发布时间:2024-10-10 09:29:18
痛觉神经通过疼痛或瘙痒诱导的伤害性刺激引起的免疫反应调节作用仍然存在争议。与传统手术相比,各种植入手术即使在较低的细菌载量下也更容易发生感染。2024年8月,《Small Methods》杂志上发表了题为“Wireless Optogenetic Targeting Nociceptors Helps Host Cells Win the Competitive Colonization in Implant-Associated Infections”的研究论文,该研究介绍了一种光遗传学技术,利用一种完全植入式、无线可充电的光遗传装置选择性地激活外周痛觉神经。通过针对清醒、自由活动的小鼠肢体中的痛觉感受器,发现激活这些感受器可在其支配区域内引发预期性的免疫反应,并增强了宿主细胞在植入物表面的粘附作用。这种作用介导了急性免疫细胞对植入物上金黄色葡萄球菌的杀伤,使宿主在“植入物表面竞争”中战胜金黄色葡萄球菌。这一发现为预防和治疗植入物相关感染提供了新的策略。
新格元在该研究中提供了GEXSCOPE®单细胞转录组测序。
思维导图
主要研究结果
1.光遗传学痛觉激活在受神经支配的区域内诱导预期性免疫反应
作者提出了一种可无线充电、完全植入式的光遗传装置,并生成Nav1.8+痛觉神经元特异性ChR2表达小鼠(Nav1.8::ChR2),在坐骨神经周围植入光遗传装置,建立靶向痛觉神经元光遗传刺激模型。作者将预先植入了围绕坐骨神经的光遗传学装置的Nav1.8::ChR2小鼠随机分为五组:控制组 (C);光刺激组(λ);植入相关感染组(Inf);光遗传学刺激+感染组(λ+Inf);以及感染+光遗传学刺激组(Inf+λ)。感染后收集胫骨植入物及周围组织进行微生物学分析,结果表明,在感染前激活痛觉神经元对协助宿主防御关节内感染(IAIs)具有有益作用。
因此,作者假设光遗传学激活神经元可能具备在感染前动员免疫细胞的能力。在Nav1.8::ChR2小鼠坐骨神经进行光遗传学刺激三天后,通过磁珠分选收集胫骨植入物周围的CD45+细胞进行单细胞RNA测序,鉴定了10种免疫细胞簇:肥大细胞,B细胞,中性粒细胞 (Neus),巨噬细胞 (Macs),单核细胞,树突状细胞 (DCs),增殖的粒细胞-巨噬细胞祖细胞 (GMPs),增殖的中性粒细胞,T细胞,自然杀伤细胞(NK细胞)(图1A)。功能富集分析表明,光遗传学激活痛觉神经元导致上述免疫细胞中白细胞趋化、迁移和T细胞、巨噬细胞及中性粒细胞激活增强(图1B–E)。
基于这些结果,作者假设光遗传学激活痛觉感受器在关节内感染 (IAIs) 中的抗感染效应与免疫细胞的预激活有关,这种预激活增强了感染发生后宿主的抗菌免疫反应。进一步研究显示在细菌感染之前进行的光遗传学激活痛觉感受器导致感染后受神经支配区域内的免疫细胞(包括巨噬细胞、中性粒细胞、树突状细胞、αβT和γδT细胞)的浸润增加以及炎症细胞因子表达上调(图1G–P)。
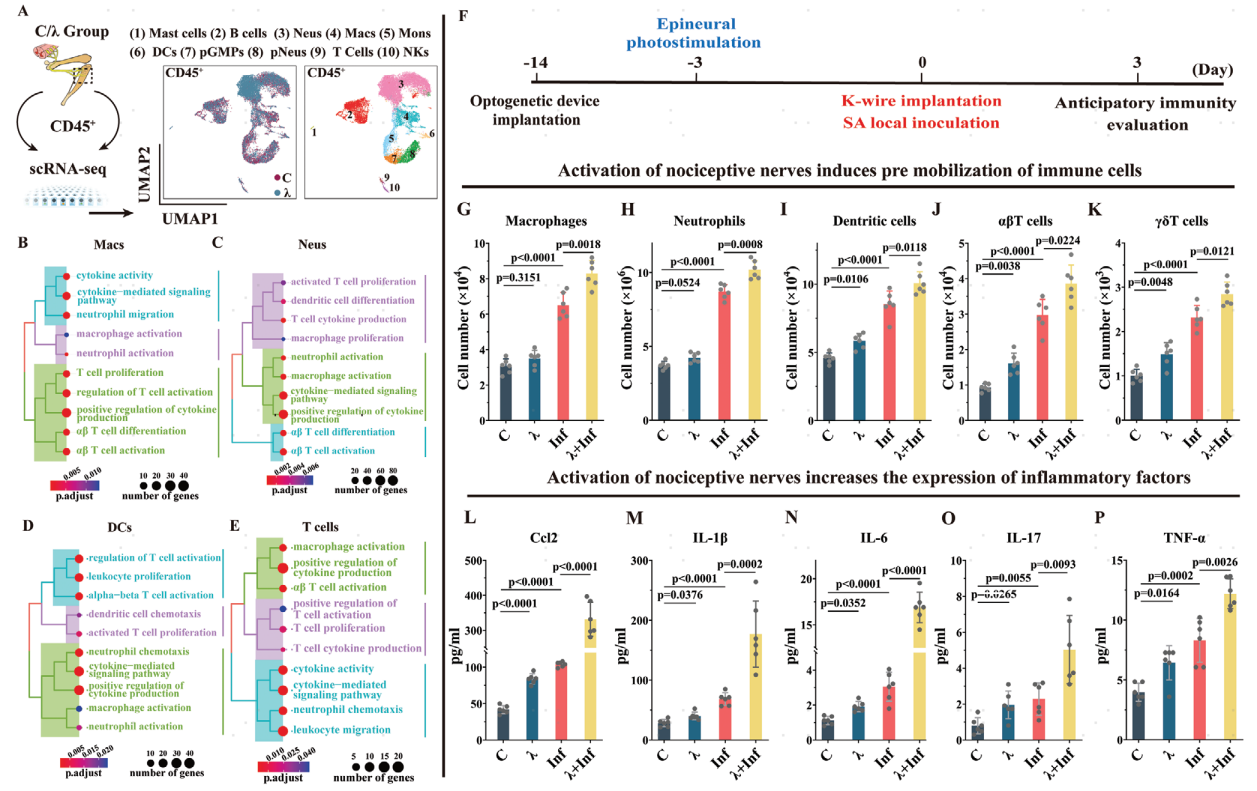
图1 光遗传学激活Nav1.8+神经元可诱导神经支配区域的预期性免疫反应
2.痛觉感受器激活增强宿主细胞“植入物表面竞争力”
关节内感染(IAIs)的结局不仅取决于宿主的抗菌免疫反应,还取决于植入物表面宿主细胞与细菌之间的黏附竞争。在Nav1.8::ChR2小鼠坐骨神经进行光遗传学刺激三天后,从胫骨植入物周围组织中分离CD45−细胞进行单细胞测序,鉴定了7种非免疫细胞:成纤维细胞,壁细胞,内皮细胞,骨骼肌干细胞 (SMSCs),施万细胞,间皮细胞和上皮细胞(图2A)。功能富集分析显示,成纤维细胞、壁细胞和内皮细胞中上调的基因主要与成纤维细胞增殖、整合素激活和细胞黏附相关的途径有关(图2B–D),光遗传学激活痛觉感受器可能通过预先上调黏附分子的表达来增强组织细胞在植入物表面的黏附竞争力。接着作者使用共聚焦显微镜观察激活痛觉感受器对组织细胞和金黄色葡萄球菌(S. aureus)在植入物表面黏附的影响。免疫荧光染色及电子显微镜等结果显示光遗传学激活痛觉神经元能够抑制金黄色葡萄球菌(S. aureus)的黏附和生长。
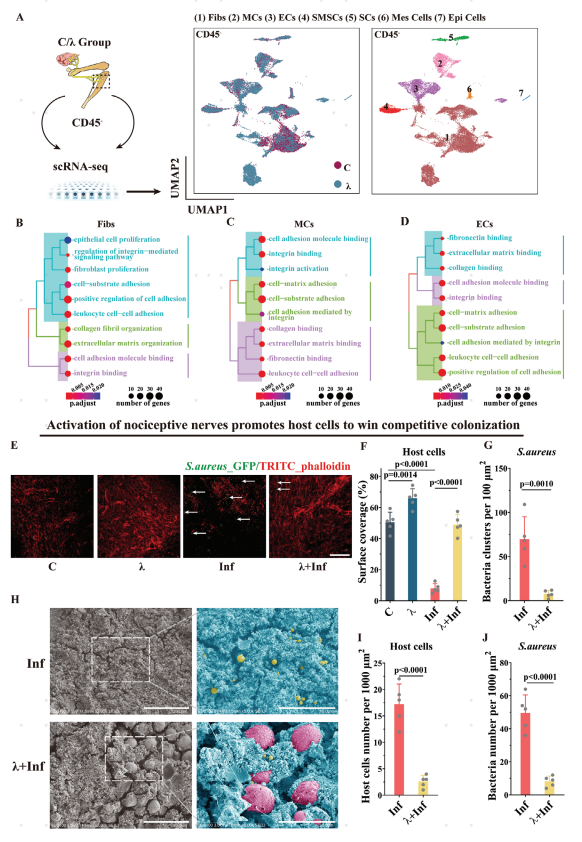
图2 光遗传学激活Nav1.8+神经元可增强宿主细胞在植入物表面的粘附竞争力
3.光遗传学激活痛觉感受器通过CGRP-Ramp1 & Calcrl轴对IAIs发挥抗感染作用
痛觉神经元的细胞体位于背根神经节 (DRG) 中,其轴突投射到周围组织。它们可以通过分泌各种神经肽来调节免疫细胞和其他宿主细胞的生物学功能。收集胫骨上段及其周围组织来检测常见的痛觉神经肽——降钙素基因相关肽(CGRP)、P物质(SP)、神经肽Y(NPY)和血管活性肠肽(VIP)的水平。发现最有可能的痛觉神经元-免疫轴候选者是CGRP-Ramp1 & Calcrl。使用CGRP 受体拮抗剂 BIBN4096 来评估它对光遗传学诱导的免疫反应和黏附效应的影响。结果显示,光遗传学激活痛觉感受器对树突状细胞、αβT细胞和γδT细胞的动员作用,以及对炎症细胞因子的增强作用,可以被 BIBN4096 完全抑制(图3F–J)。
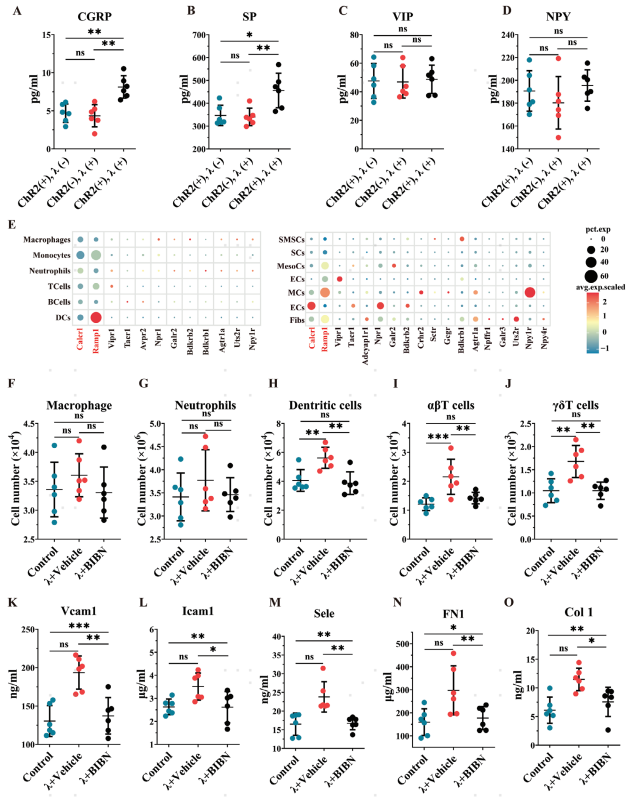
图3 痛觉神经激活通过CGRP信号通路诱导预期性免疫,并增强宿主细胞在植入物表面的黏附
结论
本研究所使用的无线可充电光遗传学设备结合了电池供电和无电池光遗传学设备的优点,能够在任何行为箱中对多只自由移动的小鼠同时进行光遗传学实验。与传统的预期性免疫诱导不同,光遗传学激活痛觉神经提高了预期性免疫引发的效率、安全性和可重复性。这项工作揭示了骨骼系统中神经-免疫相互作用的潜在机制,阐明了痛觉感受器与免疫细胞之间的联系,并为临床预防各种关节内感染 (IAIs) 提供了新的见解。
参考文献
Fang X, Ding H, Chen Y, et al. Wireless Optogenetic Targeting Nociceptors Helps Host Cells Win the Competitive Colonization in Implant-Associated Infections. Small Methods. 2024 Aug 1:e2400216. doi: 10.1002/smtd.202400216.








