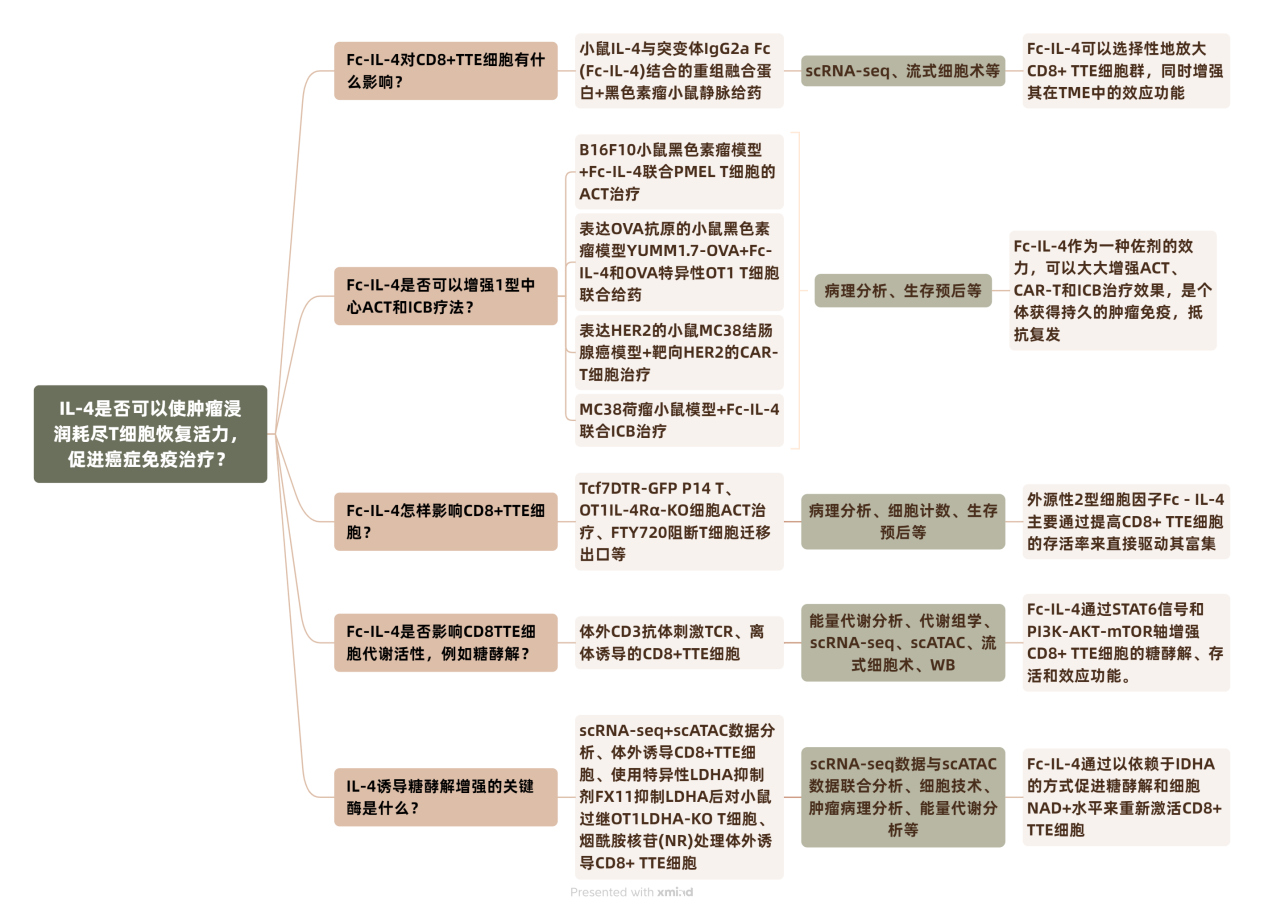
首先作者制作了小鼠IL-4与突变体IgG2a Fc(Fc - IL-4)结合的重组融合蛋白,并结合肿瘤抗原的体外激活PMEL T细胞对黑色素瘤小鼠模型进行静脉注射给药处理(图1a),结果显示联合给药显著促进CD45.2+免疫细胞向TME的浸润(图1b)。通过细胞表型分析,作者发现转移过继的PMEL和内源性TTE细胞(TCF1-TIM3+PD-1+)大量富集(图1c),颗粒酶B产生上调(图1e,f),增强了过继和内源性CD8+ TTE细胞的多功能性(图1e,f)。对ACT联合Fc-IL-4或PBS对照治疗B16F10肿瘤的肿瘤抗原特异性Thy1.1+CD8+ TILs进行了scRNA-seq,通过无监督分群将细胞分为6个cluster(图1g)。其中cluster0、2、4和5中,Fc-IL-4组的细胞比例明显高于PBS组,这些亚群高表达共抑制标志物,包括Pdcd1、Ctla4、Lag3、Nr4a2,表明它们具有瘤内TTE细胞特征(图1h)。相比之下,cluster1细胞显示这些衰竭标志物的表达减弱。而Fc-IL-4组的细胞在cluster1中的比例极低,表明TME中TTE细胞的增加是由于Fc-IL-4的作用(图1i)。与流式细胞术结果一致,除了Prf1和Nkg7外,Ifng和Gzmb在Fc-IL-4处理的细胞中表达显著升高(图1j)。这些发现暗示了Fc-IL-4可以选择性地放大CD8+ TTE细胞群,同时增强其在TME中的效应功能。
图1 Fc-IL-4在TME中富集功能性CD8+ TTE细胞
2.Fc-IL-4增强1型免疫治疗
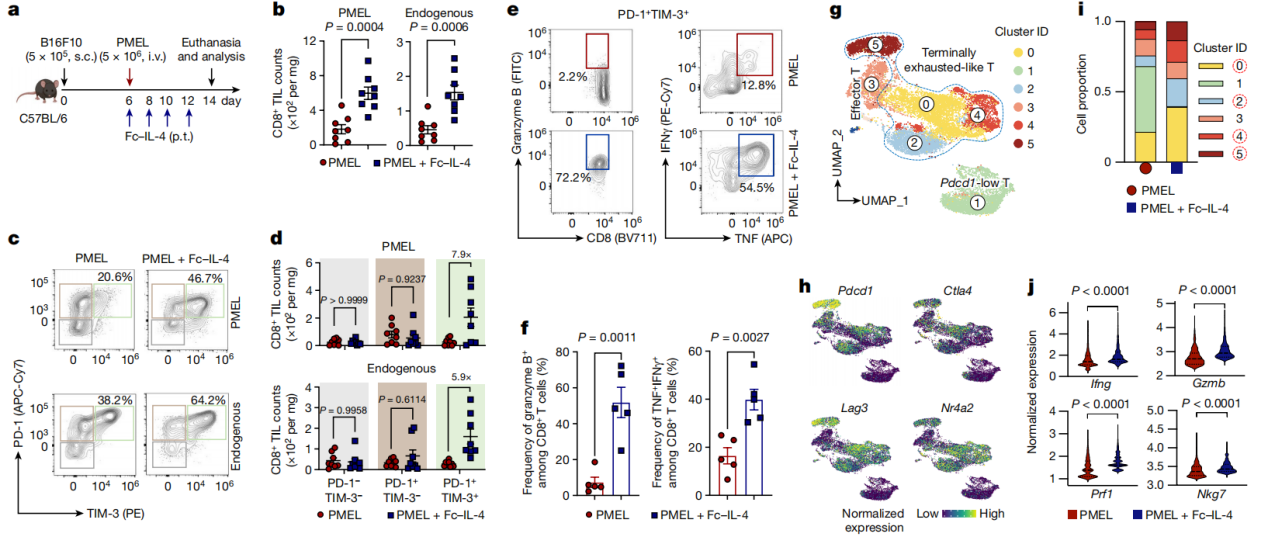
接着作者分析了作为2型细胞因子的Fc-IL-4是否可以增强1型中心ACT和ICB疗法对实体瘤的抗肿瘤功效。在B16F10小鼠黑色素瘤模型和表达人表皮生长因子受体2 (HER2)的小鼠MC38结肠腺癌模型中,作者分别评估了Fc-IL-4联合PMEL T细胞的ACT治疗(图2a)和靶向HER2的CAR-T细胞治疗(图2h)的疗效。结果显示PMEL T细胞的ACT和Fc-IL-4联合治疗完全根除了已建立的肿瘤,使得60%的荷瘤小鼠在没有淋巴消耗预处理的情况下持久治愈(图2b),远超过单独使用ACT疗法。并且联合治疗治愈小鼠在70d后依然抵抗住了相同的B16F10肿瘤细胞攻击(图2e),表明其具有持久的抗肿瘤记忆作用。此外作者还建立了表达OVA抗原的小鼠黑色素瘤模型YUMM1.7-OVA,该模型具有高肿瘤负荷。在单独使用Fc-IL-4或ACT仅能缩小肿瘤病灶的情况下,Fc-IL-4和OVA特异性OT1 T细胞联合给药使得100%的荷瘤小鼠肿瘤完全根除和持久治愈(图2c),且小鼠同样抵抗住了YUMM1.7-OVA细胞的二次攻击(图2f)。而在CAR-T治疗过程中,单独给药Fc-IL-4可有效抑制肿瘤进展并清除约33%的肿瘤(图2d),这表明Fc-IL-4也可作用于内源性T细胞以增强抗肿瘤免疫。经联合治疗治愈的小鼠完全抵抗了随后MC38-HER2肿瘤细胞的再攻击(图2g)。在MC38荷瘤小鼠模型中作者也比较了Fc-IL-4联合ICB治疗的疗效(图2h)。结果显示Fc-IL-4和ICB的联合给药导致了对已建立肿瘤的强大和持久的清除,抵抗肿瘤细胞二次攻击,且没有明显的毒性(图2i-k),强调了Fc-IL-4作为一种佐剂的效力,可以大大增强ICB治疗。
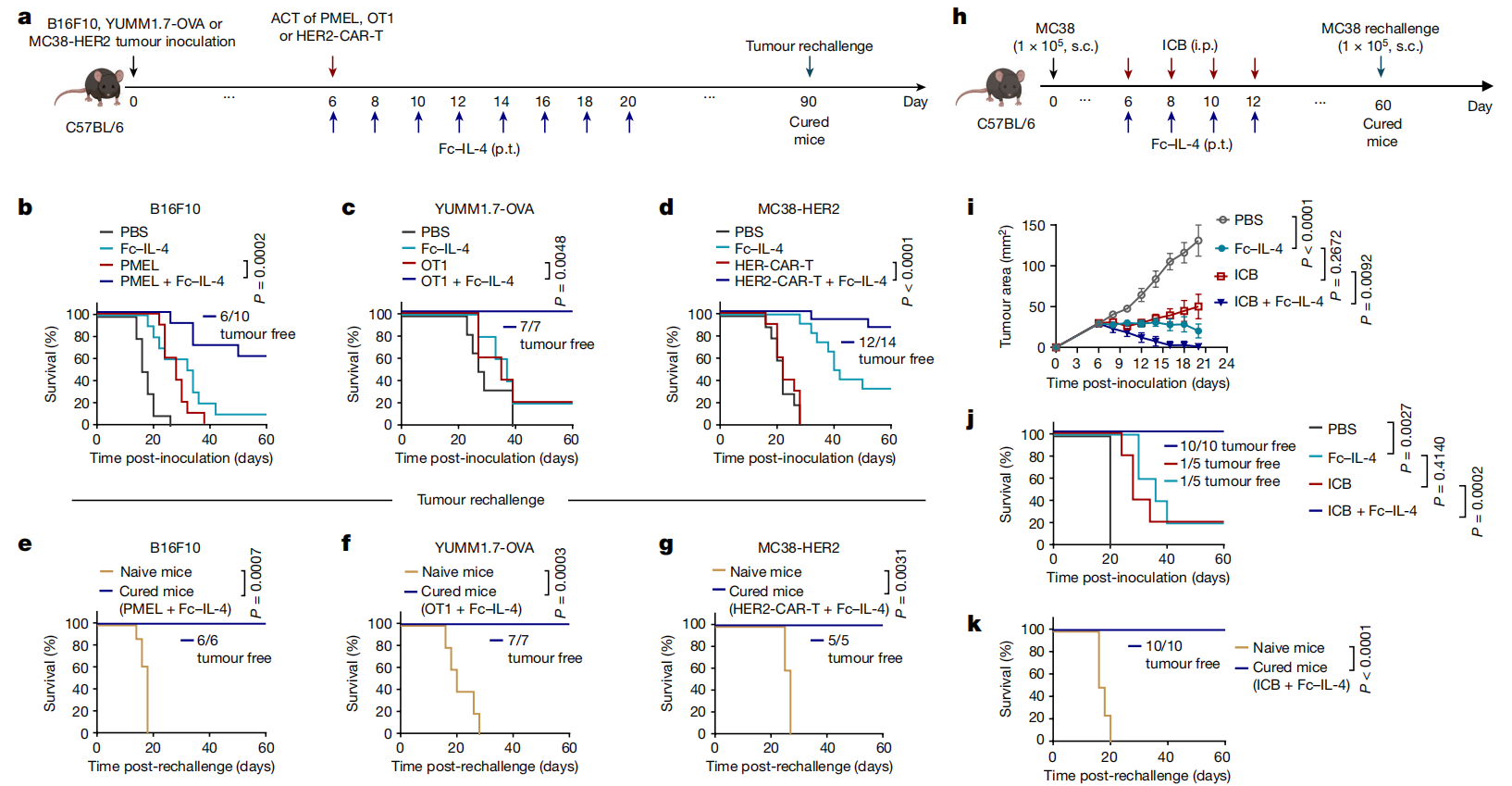
图2 在多种同源模型中,Fc-IL-4增强了ACT和ICB免疫疗法的肿瘤清除和持久保护
3.Fc-IL-4直接作用于CD8+ TTE细胞
为了确定响应治疗的CD8+T细胞亚群,作者利用Tcf7DTR-GFP转基因P14 T细胞(其中DTR为白喉毒素受体,GFP为绿色荧光蛋白),通过白喉毒素体内治疗实现了祖细胞(TCF-1+)的靶向耗竭。携带B16-gp33肿瘤的小鼠进行淋巴细胞清除,然后对识别gp33肿瘤抗原的Tcf7DTR-GFP转基因P14 T细胞进行ACT(图3a)。Fc-IL-4处理也显著增加了肿瘤内CD8+ TTE细胞的数量,并增强了它们的效应功能,其程度与没有白喉毒素处理的小鼠相当(图3b-d)。在没有祖细胞耗竭的情况下,ACT和Fc-IL-4联合治疗与在具有完整亚群的小鼠中观察到的抗肿瘤疗效和治疗反应率相当(图3e)。这表明CD8+ TTE细胞直接对Fc-IL-4作出反应,而不依赖于祖细胞耗尽亚群,从而增强了疗效。继续使用CRISPR-Cas9生成IL-4Rα敲除(KO) OT1 (OT1IL-4Rα-KO) T细胞,并将其转移到淋巴衰竭后携带B16-OVA肿瘤的小鼠体内(图3f)。与野生型(WT) OT1 CD8+ TTE细胞相比,Fc-IL-4治疗未能富集肿瘤内OT1IL-4Rα-KO CD8+ TTE细胞或增强其细胞毒性或效应物功能,导致对B16-OVA肿瘤的疗效大幅减弱(图3g-j),表明Fc-IL-4通过IL-4Rα信号直接靶向肿瘤浸润的CD8+ TTE细胞。为了解释Fc-IL-4富集CD8+ TTE细胞的机制,作者使用FTY720阻断T细胞在淋巴器官中的出口,结果显示Fc-IL-4对CD8+ TTE细胞的增殖能力的影响可以忽略不计,但是Fc-IL-4显著促进CD8+ TTE细胞的存活,上调Bcl-2表达,减轻T细胞凋亡(图3k,i)。这些发现表明,外源性2型细胞因子Fc - IL-4主要通过提高CD8+ TTE细胞的存活率来直接驱动其富集。
图3 Fc-IL-4通过IL- 4Rα信号通路直接提高CD8+ TTE细胞的存活率
4.Fc-IL-4促进CD8+ TTE细胞的糖酵解
由于IL-4可以促进B细胞糖酵解,因此作者接下来研究了Fc-IL-4是否影响CD8+ TTE细胞的代谢活性。在使用二聚体抗CD3抗体刺激T细胞受体(TCR)时,Fc-IL-4显著提高CD8+ TTE细胞的细胞外酸化率(ECAR),提高基础水平、糖酵解能力和糖酵解储备(图4a,b)。代谢组分析显示用Fc-IL-4处理引发了41种代谢物的显著改变,包括三种关键的糖酵解代谢物的上调:甘油醛3-磷酸、磷酸烯醇丙酮酸和乳酸(图4c)。为了进一步在转录组水平上分析代谢网络,作者利用单细胞数据进行了KEGG富集分析。与PBS对照组相比,经Fc-IL-4处理的抗原特异性PMEL T细胞在cluster 0、2和3中富集,其特征是糖酵解-糖异生基因模块的表达富集(图4d,e)。此外,使用2-脱氧-d-葡萄糖(2-DG)阻断糖酵解完全消除了Fc-IL-4在振兴CD8+ TTE细胞中的作用(图4h)。这些发现强调了Fc-IL-4通过促进糖酵解调节CD8+ TTE细胞代谢的作用,糖酵解是富集功能性CD8+ TTE细胞的关键过程。
为了解释Fc-IL-4诱导糖酵解升高的分子机制,作者接下来对离体诱导的CD8+ TTE细胞进行了单细胞染色质可及性(scATAC)和scRNA-seq分析(图4i)。scATAC和scRNA数据联合分析显示IL-4处理和PBS处理两种情况下CD8+ TTE细胞具有的不同分子谱,表明IL-4对这种特定细胞类型具有内在的调节作用(图4j)。使用ATAC数据进行了差异基序分析,以确定开放染色质区域内潜在的转录因子结合位点。与PBS相比,在IL-4处理的CD8+ TTE细胞中,Stat6是最显著增强的基序,而Foxo1和mTOR的是典型负调节因子,显示出最大程度的下调(图4j)。此外,对CD8+ TILs中差异表达基因(DEGs)调控的信号通路的分析显示,与PBS相比,接受Fc-IL-4治疗的小鼠的mTOR、eIF4和p70S6K、PI3K/AKT以及JAK-STAT信号、NF-κB激活和糖酵解显著上调(图4k)。基于DEGs的上游调控分析发现,在Fc-IL-4组中,有几个功能分子被预测上调,特别是NF-κB、Myc、Pi3k、Akt1和Stat6(图4l),这些分子被发现促进糖酵解。
为了解释STAT6和PI3K-AKT-mTOR轴在Fc-IL-4激活CD8+ TTE细胞中的作用,作者进行了流式细胞术和Western Blot分析,发现Fc-IL-4处理后STAT6、AKT和P70S6K的磷酸化水平升高(图4m)。接着作者构建了STAT6- KO OT1 (OT1STAT6-KO) T细胞,进一步研究STAT6的作用。与WT OT1 T细胞相比,在OT1STAT6-KO T细胞中只观察到Fc-IL-4作用的部分衰减,包括糖酵解增强、CD8+ TTE细胞数量和细胞毒性增加(图4n-p。相比之下,当AKT或mTOR信号与STAT6-KO同时被阻断时,Fc-IL-4介导的益处完全消失(图4n-p)。综上所述,这些结果表明Fc-IL-4通过STAT6信号和PI3K-AKT-mTOR轴增强CD8+ TTE细胞的糖酵解、存活和效应功能。
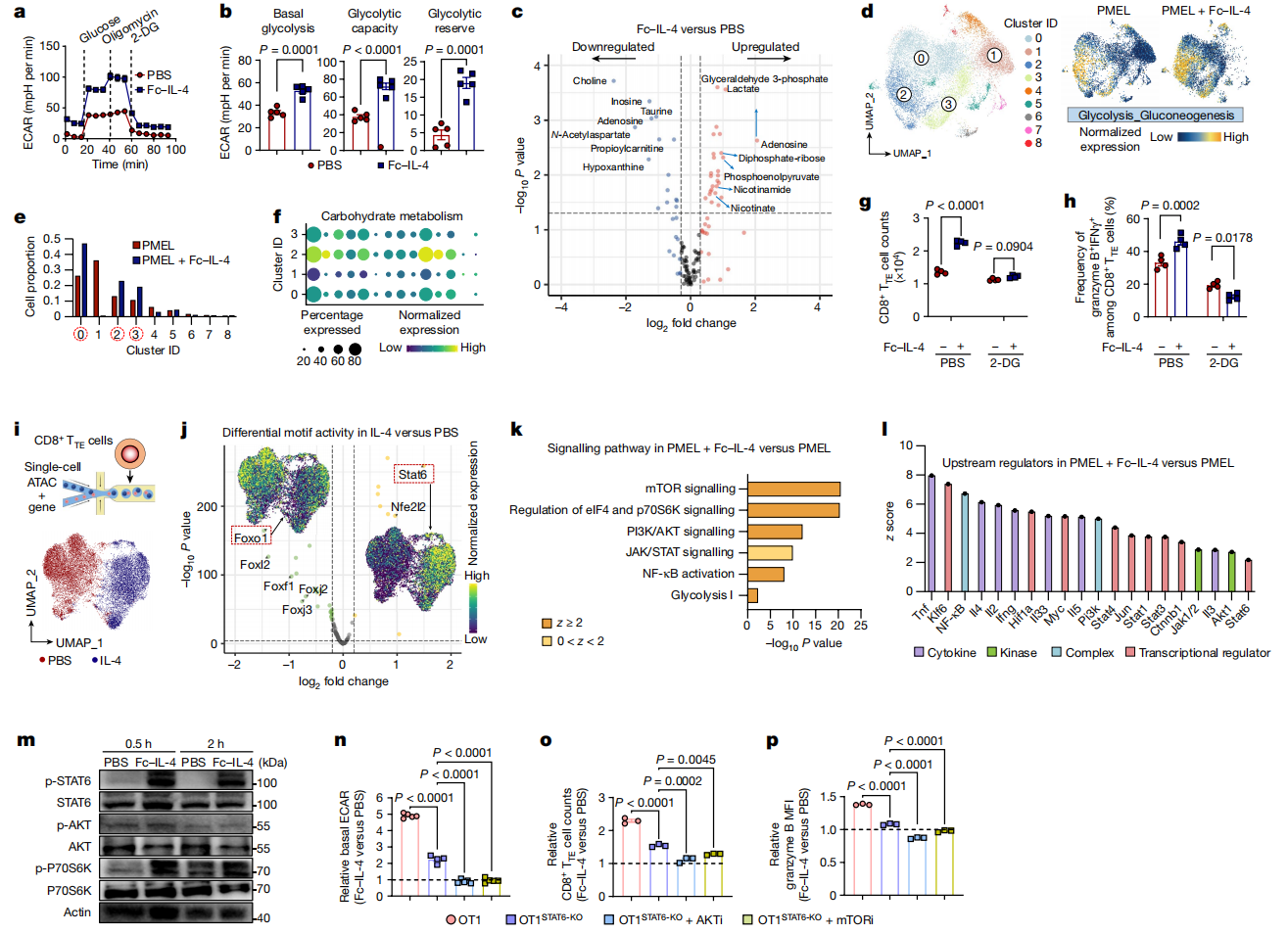
图4 Fc-IL-4通过STAT6信号通路和PI3K-AKT-mTOR轴增强CD8+ TTE细胞的糖酵解代谢
5.Fc-IL-4通过LDHA促进糖酵解和NAD+
为了确定IL-4诱导糖酵解增强的关键酶,作者继续分析scATAC和scRNA-seq数据集。在染色质可及性改变的几个糖酵酶基因中,LDHA在IL-4处理后表现出最明显的上调(图5a)。通过Western Blot和流式细胞术分析进一步验证了Fc-IL-4处理的CD8+ TTE细胞中乳酸脱氢酶A (LDHA)表达升高(图5b,c)。使用特异性LDHA抑制剂FX11抑制LDHA,减弱了Fc-IL-4对CD8+ TTE细胞富集的作用(图5d)。此外,与WT OT1 T细胞不同,过继转移的LDHA-KO OT1 (OT1LDHA-KO) T细胞对体内Fc-IL-4处理没有反应,尽管B16-OVA肿瘤小鼠瘤内CD8+ TTE细胞数量增加(图5e,f),但也没有增强细胞毒性或效应功能(图5g,h)。与WT OT1 T细胞结合Fc-IL-4相比,OT1LDHA-KO T细胞的ACT与Fc-IL-4联合使用对肿瘤生长的控制效果明显降低(图5i)。这些结果表明,Fc-IL-4通过LDHA诱导功能性CD8+ TTE细胞的瘤内富集。LDHA在维持NAD+-NADH循环和促进糖酵解回路中NAD+的产生方面起着至关重要的作用(图5j),而NAD+对提高细胞存活至关重要。在离体诱导的WT CD8+ TTE细胞中,Fc-IL-4处理显著提高了细胞NAD+水平,但在LDHA缺乏的细胞中没有(图5k,i)。作为Fc-IL-4介导的代谢调节的替代方案,直接补充烟酰胺核苷同样可以促进CD8+ TTE细胞的糖酵解代谢(图5m)。总的来说,这些结果表明Fc-IL-4通过以依赖于LDHA的方式促进糖酵解和细胞NAD+水平来重新激活CD8+ TTE细胞。
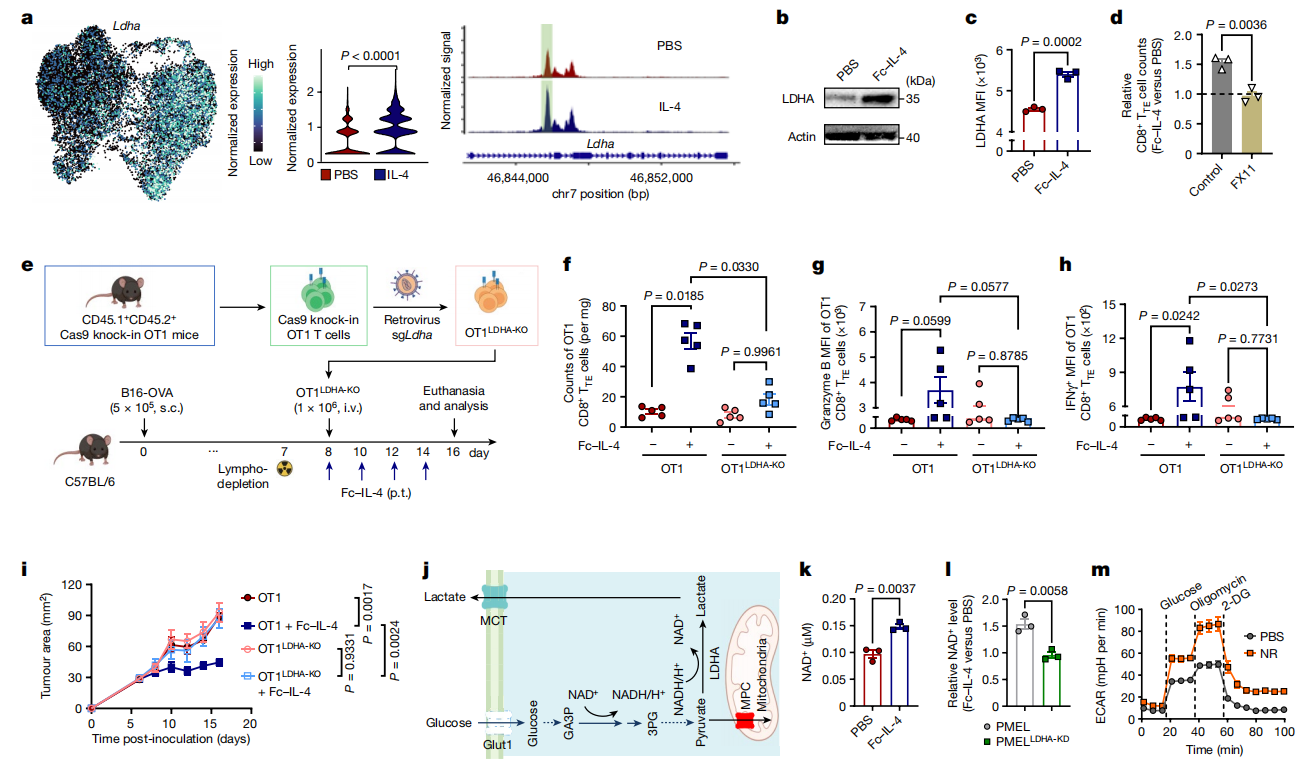
图5 Fc-IL-4促进LDHA介导的糖酵解和CD8+ TTE细胞的细胞NAD+水平